ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2022 - Universidad Ricardo Palma10.25176/RFMH.v22i4.4995
EVALUACIÓN CLÍNICA, BIOQUÍMICA, ENDOSCÓPICA E HISTOPATOLÓGICA DEL TRATAMIENTO BIOLÓGICO DE COLITIS ULCERATIVA
CLINICAL, BIOCHEMICAL, ENDOSCOPIC AND HISTOPATHOLOGICAL EVALUATION OF BIOLOGICAL TREATMENT IN ULCERATIVE COLITIS
Carlos Alberto López-Bernal1,a, Arturo García-Galicia1,b,f, Francisco Javier Quezada-Juárez2,c, Moisés Freddy Rojas-Illanes3,a, Briseida Rubio-Martínez4,a,Álvaro José Montiel-Jarquín1,c,f, Ingrid Jiménez-Luna1,d, Jorge Loria-Castellanos5,e
1Dirección de Educación e Investigación en Salud, Unidad Médica de Alta Especialidad Hospital de Especialidades de Puebla, Centro Médico Nacional “Gral. de Div. Manuel Ávila Camacho, Instituto Mexicano del Seguro Social, Puebla, México.
2Colegio de Ciencias y Humanidades, Universidad Autónoma de la Ciudad de México, CDMX, México.
3Departamento de Cirugía de Colon y Recto, Centro Médico Nacional Siglo XXI, Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez”, Instituto Mexicano del Seguro Social, CDMX, México.
4Departamento de Enfermedad Inflamatoria Intestinal, Centro Médico Nacional Siglo XXI, Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez”, Instituto Mexicano del Seguro Social, CDMX.
5Dirección de Eventos Especiales, Instituto Mexicano del Seguro Social, CDMX.
aMédico Cirujano Coloproctólogo
bMédico Especialista en Pediatría
cMédico Especialista en Cirugía General
dMédico General
eMédico Especialista en Medicina de Urgencias
fMaestro en Ciencias Médicas e Investigación
RESUMEN
Introducción: El tratamiento biológico es una alternativa para manejar la colitis ulcerativa en pacientes refractarios al tratamiento convencional. Objetivo: Evaluar el tratamiento biológico en pacientes con colitis ulcerativa refractarios al tratamiento convencional en un hospital de 3er nivel de atención. Métodos: Estudio descriptivo, retrospectivo, longitudinal en pacientes con colitis ulcerativa refractarios al tratamiento convencional y que recibieron tratamiento biológico. Las cortes se evaluaron en tres momentos: estado basal (sin terapia biológica), a los seis y doce meses de inicio del tratamiento biológico. Se utilizó estadística descriptiva para la caracterización de la población en general, posteriormente los tres puntos de corte se describieron con sus respectivas variables. Resultados: Se incluyeron 18 pacientes con edad media de 41,2 años. Las evaluaciones, en un estado basal, a los seis y 12 meses; demostraron presencia de sangre en las evacuaciones y dolor abdominal en 94,4%, 22,2% y 11,1% respectivamente, concentración de hemoglobina >10,5 g/dl en 50%, 83,3% y 88,9%; concentración sérica de albúmina >3,2 g/dl en 72,2%, 83,3% y 88,9% y escala visual endoscópica de Mayo 38,9%, 33,3% y 16,7% presentaron Mayo 2 y 61,1%, 16,7% y 1,7% Mayo 3. La actividad histológica en la evaluación basal llego hasta un nivel severo (11,1%), mientras que en evaluaciones a seis y 12 meses llegaron hasta moderada en un 55,6% y 27,8% respectivamente. Conclusiones: La terapia biológica en pacientes con colitis ulcerativa refractaria demostró mejoría en manifestaciones clínicas, bioquímicas, endoscópicas e histológicas. No se registró remisión profunda de la enfermedad, ni reacciones adversas al tratamiento.
Palabras Clave: Colitis Ulcerosa; Tratamiento; Biológico; Endoscópica; Clínica.(fuente: DeCS BIREME).
ABSTRACT
Background: Biological treatment is currently used as an alternative for the treatment of ulcerative colitis in patient’s refractory to conventional treatment. Objective: To evaluate biological treatment in patients with ulcerative colitis refractory to conventional treatment in a 3rd level care Hospital. Methods: A descriptive, retrospective, longitudinal study was carried out in patients with UC who were refractory to conventional treatment and who received biological treatment. The variables were evaluated in 3 moments: basal state (without biological treatment), at six and twelve months from the start of biological treatment. Descriptive statistics were used to characterize general population, later the 3 states mentioned above were described with their respective variables. Results: Eighteen patients with a mean age of 41.2 years were included. Evaluations at baseline and at 6 and 12 months showed: presence of blood in stools and abdominal pain in 94.4%%, 22.2% and 11.1% respectively; hemoglobin concentration >10.5 g/dl in 50%, 83.3% and 88.9%; serum albumin concentration >3.2 g/dl in 72.2%, 83.3% and 88.9%; the visual Mayo endoscopic scale 38.9%, 33.3% and 16.7% presented Mayo 2 and 61.1%, 16.7% and 1.7% Mayo 3. The histological activity in the baseline evaluation reached a severe level (11.1%), while in evaluations at 6 and 12 months they reached moderate in 55.6% and 27.8% respectively. Conclusions: Biological therapy as a treatment in patients with ulcerative colitis showed improvement in clinical, biochemical, endoscopic and histological manifestations, so far none with deep remission of the disease, no adverse reactions to treatment have been presented.
Keywords: Colitis, Ulcerative; Treatment; Biological; Endoscopic; Clinical. (Source: MeSH NLM).
INTRODUCCIÓN
La colitis ulcerativa (CU) es la inflamación crónica e inespecífica del intestino caracterizada por periodos de actividad y remisión de la enfermedad. Su diagnóstico se basa en una serie de criterios clínicos, endoscópicos e histológicos (1). La CU usualmente predomina en pacientes adultos de entre 30 y 40 años (2). En México, la media de casos nuevos de CU aumentó de 28,8 en el periodo de 1987 a 1996, a 76,1 de 1997 a 2006 (3). La incidencia y prevalencia tiene un comportamiento similar en el resto del mundo (4). La presentación y el desarrollo se afecta por los cambios ambientales (5).
El objetivo principal del tratamiento fue inducir y mantener la remisión a largo plazo. De acuerdo a la escala de Montreal, la actividad leve, moderada o severa determina el tratamiento (6-9).
El tratamiento para actividad leve es el uso de ácido 5-aminosalicílico (5-ASA) (10), agregando esteroides (por ejemplo, prednisona 40-60 mg por día) o equivalentes en caso de resistencia (11). En la actividad moderada se recomienda agregar al tratamiento tiopurinas (azatioprina o mercaptopurina), que también se pueden usar en pacientes dependientes de esteroides (12). Para la actividad severa se utiliza terapia biológica (adalimumab, infliximab, entre otros), y recientemente el inhibidor de quinasa Janus (JAK) para rescate. Se suele iniciar el tratamiento con esteroides intravenosos o ciclosporina como inducción a la remisión. Esta terapia tiene como objetivo mantener la remisión de la enfermedad (13-15). El uso de infliximab con azatioprina tiene una respuesta superior en pacientes dependientes de esteroides, alcanzando una remisión a las 16 semanas de tratamiento (16,17).
El tratamiento quirúrgico se reserva para urgencias o presencia de lesiones premalignas y malignas (18,19).
Se ha propuesto el uso de terapia biológica en caso de resistencia al tratamiento primario (19), pero la información es aún escasa.
Hasta el momento no existen predictores del comportamiento real de la enfermedad, que ayuden a mejorar el tratamiento e incluso a su prevención. Tampoco el estudio del manejo en caso de persistencia a pesar del tratamiento. Por eso la importancia de evaluar la respuesta al uso de la terapia biológica, ante la carencia de estudios a largo plazo.
El objetivo de este trabajo fue evaluar los resultados del tratamiento biológico a 12 meses en pacientes con CU refractaria al tratamiento convencional, en el Servicio de Coloproctología de un Hospital de tercer nivel en la Cd. de México, México.
MÉTODOS
Diseño y área de estudio
Se realizó un estudio descriptivo, retrospectivo, longitudinal en pacientes con CU que fueron refractarios al tratamiento convencional y que recibieron tratamiento biológico en el Servicio de Coloproctología en un Hospital de tercer nivel.
Población y muestra
Se revisaron los expedientes de los pacientes diagnosticados con CU en el Servicio de Coloproctología. Se incluyeron los casos identificados con diagnóstico confirmado de CU, que se encontraban bajo terapia biológica (adalimumab o infliximab) por 12 meses, previamente refractarios a tratamiento convencional (mesalazina, azatioprina y esteroides), de cualquier sexo y edad, que contaran con seguimiento endoscópico, bioquímico, clínico e histopatológico.
Variables e instrumentos
Se registraron los resultados de las evaluaciones: basal, a seis y a 12 meses del inicio de la terapia biológica, de las manifestaciones clínicas, bioquímicas, endoscópicas e histológicas.
Después de la evaluación basal se inició terapia biológica con inhibidor del factor de necrosis tumoral (anti-TNF) tipo Infliximab o Adalimumab. Como complemento se utilizó Azatioprina o 5-ASA.
Se recabó información de: edad, género, talla, peso, índice de masa corporal (IMC), antecedente de diabetes mellitus y/o hipertensión arterial, tiempo de enfermedad, tabaquismo, alcoholismo, apendicectomía. En cada evaluación se registraron características clínicas como número de evacuaciones al día, presencia de moco y/o sangre en heces, dolor abdominal, manifestaciones extraintestinales (artralgias, mialgias, uveítis y cirrosis), e ingreso a hospitalización por complicaciones asociadas. Las características bioquímicas registradas fueron hemoglobina, albúmina y proteína C reactiva (PCR) séricas, y velocidad de sedimentación globular (VSG). Endoscópicamente se evaluó la calificación de acuerdo a la escala endoscópica Mayo y el grado de actividad histopatológica.
Se aplicaron las siguientes escalas:
• Se midió la actividad de la enfermedad, con nueve características clínicas y bioquímicas: el número de deposiciones por día, sangre en heces, fiebre, taquicardia, hemoglobina, VSG, leucocitos totales, albúmina y potasio séricos (20,21).
• La escala endoscópica Mayo para CU evalúa su actividad a través de la frecuencia de deposiciones, características del sangrado, hallazgos endoscópicos de la mucosa y valoración médica. La actividad se divide en: 0) normal, mucosa sin lesiones o en fase inactiva; 1) leve, leve eritema, disminución del patrón vascular, leve friabilidad; 2) moderada, marcado eritema, ausencia del patrón vascular, friabilidad, erosiones o úlceras puntiformes; y 3) intensa, sangrado espontáneo y ulceraciones (7,21,22).
• La actividad histológica para la CU se clasifica como sin actividad, actividad leve, actividad moderada y actividad severa. Se reporta de acuerdo al estudio anatomopatológico.
• Todos los pacientes son interrogados acerca de sintomatología agregada a CU. Se buscó intencionadamente en los expedientes acerca de cualquier condición clínica relacionada o no con la aplicación de los medicamentos.
Procedimientos
El tratamiento biológico consistió en la administración de Infliximab o Adalilumab de acuerdo a los siguientes esquemas:
• La administración del Infliximab es a las cero, dos y seis semanas y posteriormente cada ocho semanas a dosis de cinco a diez mg/kg por vía intravenosa.
• El Adalimumab se administró a dosis de 160/80 mg u 80/40 mg subcutánea cada dos semanas (23,24).
• La azatioprina se aplicó a dosis de 2,5-3 mg/kg/día (25).
Análisis estadísticos
Se realizó mediante estadística descriptiva. Se utilizaron medidas de tendencia central y de dispersión para las variables cuantitativas. Se utilizó el programa estadístico SPSS versión 25,0 de IBM.
Aspectos éticos
El presente estudio cumplió con los principios éticos para la incorporación de pacientes en el estudio, con manejo de los datos personales con estricta confidencialidad. Todos los pacientes firmaron carta de consentimiento informado, al momento de aplicar la escala de calidad de vida. El protocolo fue aprobado por el Comité de Investigación en Salud n° 3 601 del Instituto Mexicano del Seguro Social, con número de registro R-2020-3601-090.
RESULTADOS
Se incluyeron 18 pacientes con edad media de 41,2 (±11,8) años, fueron diez (55,6%) mujeres y ocho (44,4%) hombres. La talla media fue de 1,61 (±0,8) metros, peso medio de 66,6 (±13,8) kilogramos, el IMC medio fue de 24,2 (±4) kg/m2. No se encontraron antecedentes de diabetes mellitus ni hipertensión en la población evaluada. El antecedente de tabaquismo estuvo presente en dos (11,1%) pacientes, de consumo habitual de alcohol en seis (33,3%) pacientes, y de apendicectomía en tres (16,7%) pacientes.
Evaluación basal
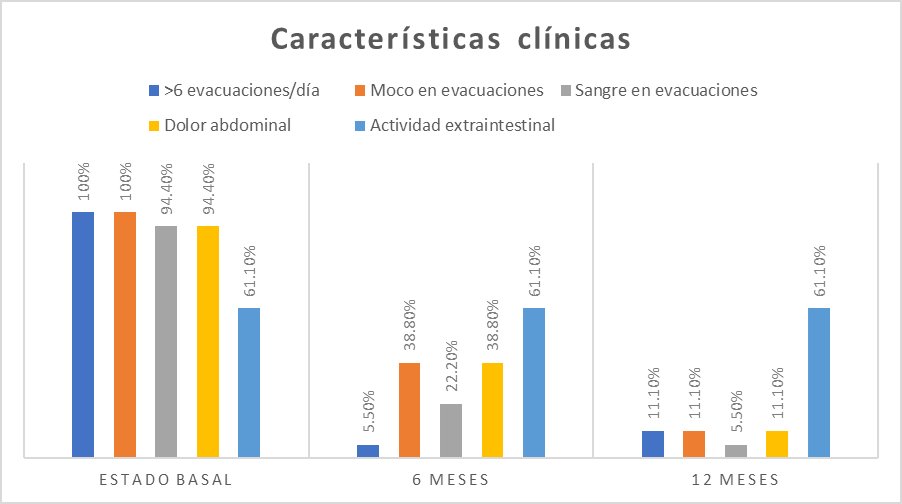
Se observó que los 18 pacientes incluidos presentaron más de seis evacuaciones al día, 18 reportaron moco en evacuaciones y 17 pacientes registraron hematoquecia y dolor abdominal. Además, 11 pacientes presentaron actividad extraintestinal (artralgias, mialgias, uveítis y cirrosis) (Figura 1).
La hemoglobina sérica mayor de 10,5 g/dl se registró en 50% de los pacientes, la albúmina sérica mayor de 3,2 g/dl en 72,2%, la VSG mayor de 10 mm/h en 94,4%, y la PCR menor de 10 mg/dl en 88,9% (Figura 2).
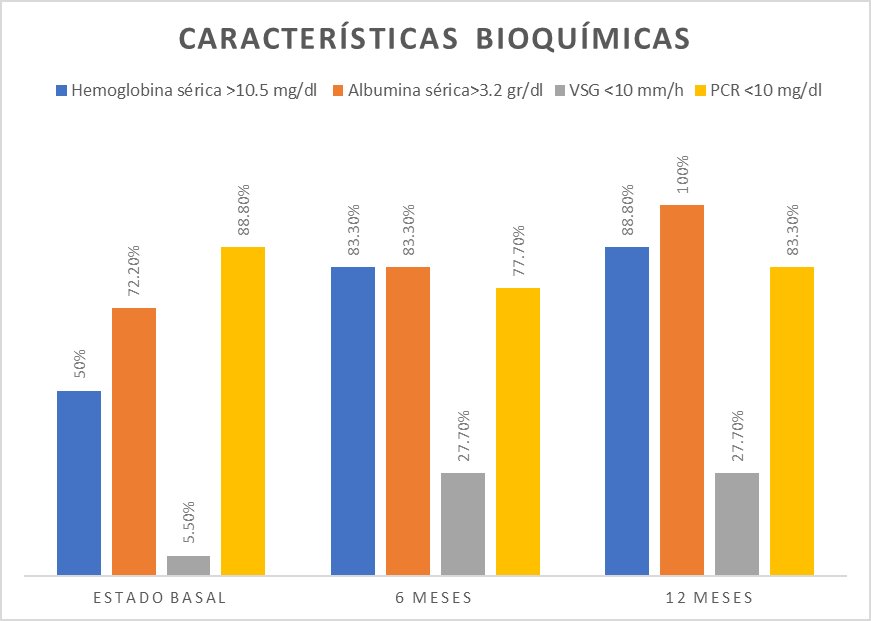
Figura 2: Características bioquímicas de los pacientes.
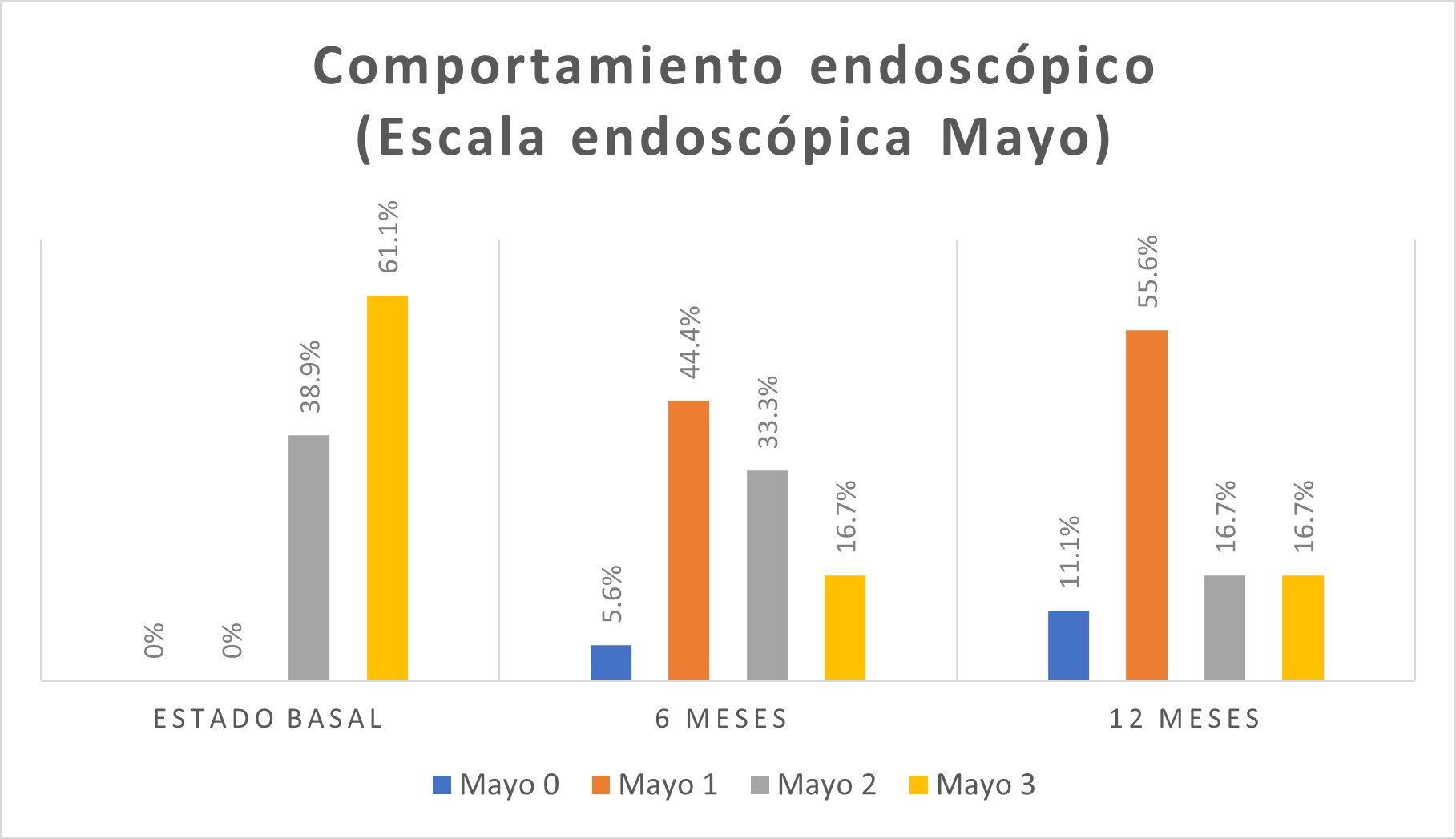
En la escala visual endoscópica de Mayo para CU, 11(61,1%) pacientes presentaron un nivel de Mayo 3 (Figura 3).
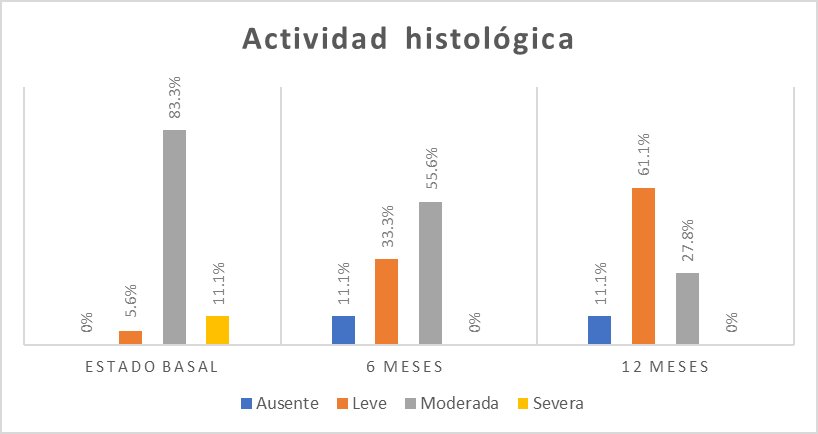
El grado de actividad histológica más frecuente fue la actividad moderada en 15 (83,3%) personas (Figura 4).
Respecto a las hospitalizaciones, 13 (72,2%) pacientes no ameritaron manejo hospitalario y en 5 (27,8%) pacientes fue necesaria la atención hospitalaria antes del inicio del biológico. El 100 % de los pacientes fueron refractarios al tratamiento convencional combinado para el control de la enfermedad antes del inicio del biológico.
Después de la evaluación basal se inició terapia biológica con agentes anti-Factor de Necrosis Tumoral tipo Infliximab en 10 (55,6%) pacientes y Adalimumab en 8 (44,4%) pacientes. Se complementó con Azatioprina en 50% de los pacientes, y con 5-ASA en el 83,3%.
Evaluación a los seis meses
Clínicamente, 17 pacientes presentaron menos de seis evacuaciones al día, siete pacientes tenían evacuaciones con moco, cuatro presentaron sangre en las evacuaciones y siete pacientes tuvieron dolor abdominal. Respecto a la actividad extraintestinal se encontraba presente en 11 pacientes (Figura 1).
Se encontró una concentración de hemoglobina >10,5 g/dl en 15 (83,3%) pacientes; la concentración sérica de albúmina fue >3,2 g/dl en 15 (83,3%) pacientes. La VSG fue <10 mm/h en 5 (27,8%) pacientes, y la PCR <10 mg/dl se encontró en 14 (77,8%) pacientes (Figura 2).
En la escala visual endoscópica, se encontró mayor frecuencia de nivel de Mayo 1 en 8 (44,4%) pacientes (Figura 3). La actividad histológica se encontró moderada en 10 (55,6%) pacientes (Figura 4).
Evaluación a los 12 meses del inicio del biológico
Se encontraron 16 pacientes con menos de seis evacuaciones al día, dos pacientes con moco en evacuaciones, un paciente con presencia de sangre en las evacuaciones y dos pacientes con dolor abdominal. La actividad extraintestinal se encontraba presente en 11 pacientes (Figura 1).
La concentración de hemoglobina fue >10,5 g/dl en 16 (88,9%) pacientes, la concentración sérica de albúmina >3,2 g/dl se encontró en 18 (88,9%) pacientes. La VSG fue mayor a 10 mm/h en 13 (72,2%) pacientes y en cuanto a la PCR era <10 mg/dl en 15 (83,3%) pacientes (Figura 2).
En la escala visual endoscópica de Mayo para CU, en 10 (55,6%) pacientes fue Mayo 1 (Figura 3). Se encontró actividad histológica leve en 11 (61,1%) pacientes (Figura 4).
No se registró sintomatología clínica diferente al cuadro inicial de CU que se presentara relacionada con la aplicación de los medicamentos hasta las 72 hrs posteriores a ellos.
DISCUSIÓN
La terapia biológica ha demostrado eficacia y seguridad sobre la CU, logrando remisión clínica, endoscópica, histológica y bioquímica (13,15).
En el seguimiento de los pacientes, una vez hecho el diagnóstico e iniciado el tratamiento, se recomienda control endoscópico a los tres a seis meses, clínicamente deben ser evaluados cada tres meses, una vez conseguida la remisión, la vigilancia puede ser cada seis a doce meses (26). El presente trabajo se realizó mediante un estado basal y dos cortes a seis y doce meses, analizando cuatro aspectos, el clínico, bioquímico, endoscópico e histológico.
La curación histológica es la remisión completa de la CU y se asocia a la reducción de complicaciones a futuro en la práctica clínica. En este trabajo se obtuvo una respuesta histológica adecuada y un paciente consiguió la remisión histológica completa más no una remisión profunda, la cual consiste en la ausencia de actividad clínica, endoscópica, histológica y bioquímica.
La terapia con infliximab es considerada la primera línea de tratamiento ante CU refractaria a tratamiento convencional y actividad severa. Induce y mantiene su remisión hasta a 52 semanas de su inicio (27). El tratamiento con infliximab predominó ligeramente en este trabajo. La mayoría de los pacientes registraron respuesta sostenida, la cual consiste en la ausencia de recaídas durante el tratamiento. Además, se utilizó la terapia combo, la cual consiste en el uso del biológico (Infliximab/Adalimumab), agregado el uso de inmunomodulador tipo azatioprina.
El infliximab registra una ventaja del 80% frente a placebo en un seguimiento a cinco años, con la reducción en 50% del riesgo de colectomía en pacientes con colitis ulcerativa severa (28). En el presente trabajo también se observa una respuesta superior de la terapia biológica con infliximab a los seis y 12 meses en relación a la terapia convencional, agregando además la percepción de calidad de vida de nuestros pacientes.
Adalimumab induce y mantiene la remisión en un 40 a 59,9% de los pacientes con actividad moderada a severa en seguimiento de uno cuatro años (29,30). La respuesta con adalimumab en este trabajo fue similar a la observada con infliximab; también en conjunto con la terapia combo. El seguimiento se registró a los 12 meses, y actualmente continúa.
Las reacciones adversas inmediatas asociadas al uso de infliximab y adalimumab son muy similares. Incluyen prurito, edema, urticaria, hipotensión o hipertensión, bradicardia o taquicardia, cefaleas, fiebre, shock anafiláctico, entre otros. A las 24 horas de la administración pueden presentarse artralgias, mialgias, urticaria, erupciones, fiebre o cefaleas (21). Los efectos adversos asociados a la azatioprina son fiebre, artralgia, erupción cutánea, malestar general, náuseas, pancreatitis aguda, leucopenia, trombocitopenia, anemia, infecciones y algunos casos hepatitis o tumores (22). En el presente estudio no se registraron efectos adversos. Ello argumenta en favor de la seguridad de los esquemas medicamentosos utilizados. Sin embargo, su presentación puede ocurrir en muestras mayores.
Es necesaria una comparación de una evaluación formal de la calidad de vida antes y después del inicio de la terapia biológica para conclusiones más robustas. También es deseable ampliar la muestra y el seguimiento a mayor plazo para evidenciar las diferencias entre ambos tratamientos.
En conclusión, la respuesta clínica, endoscópica, bioquímica e histológica en pacientes que refractarios al tratamiento convencional fue satisfactoria. Ninguno de ellos ha presentado eventos adversos, ni se han hospitalizado pacientes hasta el momento.
Contribuciones de Autoría: Los autores participaron en el diseño, recolección de datos, análisis de resultados y aprobación de la versión final del articulo.
Financiamiento:Autofinanciado .
Conflictos de intereses: Los autores declaran no tener conicto de interés.
Recibido: 31 de mayo, 2022
Aprobado: 26 de abril, 2022
Correspondencia: Arturo García Galicia.
Dirección: Calle 2 norte # 2004. Colonia Centro. CP 72000. Puebla, Puebla-México.
Teléfono: +521 2222384907
Email: arturo.garciaga@imss.gob.mx
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS