ARTÍCULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2023 - Universidad Ricardo Palma10.25176/RFMH.v23i2.5637
INTEGRIDAD DEL ADN ESPERMÁTICO Y LA TOXICIDAD REPRODUCTIVA
DEL NITRATO DE PLOMO EN RATONES MACHOS ADULTOS
SPERM DNA INTEGRITY AND REPRODUCTIVE TOXICITY OF LEAD NITRATE IN ADULTS MALES MICE
Jonathan H. Vásquez Cavero
 1, 2a,
José M. Gonzáles Daga
1, 2a,
José M. Gonzáles Daga
 1,2b,
1,2b,
Rosmary Y. López Sam
 1,2b,
Pilar V. Pino Velásquez
1,2b,
Pilar V. Pino Velásquez
 1c
1c
,
José L. Pino Gaviño
 1,3a,
Betty Shiga Oshige
1,3a,
Betty Shiga Oshige
 1,3a
1,3a
1Laboratorio de Reproducción y Biología del Desarrollo, Departamento de Zoología. Instituto de Investigación en Ciencias Biológicas “Antonio Raimondi” (ICBAR). Universidad Nacional Mayor de San Marcos (UNMSM). Lima, Perú.
2Laboratorio de Fisiología de la Reproducción Animal. Instituto de Investigación en Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas, UNMSM. Lima, Perú.
3Centro de Investigación de Recursos Naturales (CIRNA) Universidad Nacional Mayor de San Marcos (UNMSM). Lima, Perú.
aBiólogo.
bMagister en Biología Molecular.
cMagister en Procedimietnos de Reproducción Asistida.
RESUMEN
Introducción: La toxicidad del plomo se ha relacionado a diferentes patologías en humanos y varias evidencias sugieren una fuerte relación con el daño observado sobre la función reproductiva en humanos y roedores. Método: Se proporcionó a ratones una dosis única de nitrato de plomo (NP) (50mg/kg/pc), los cuales fueron eutanizados siete días postinyección con el objetivo de evaluar los espermatozoides que han salido de los túbulos seminíferos y están en tránsito por el epidídimo; además, se evaluó la fragmentación del ADN espermático mediante el ensayo TUNEL. Resultados: La disminución del peso corporal en ratones, tratados con NP (p < 0,05), sugiere un efecto tóxico sistémico. Sin embargo, no sucedió lo mismo sobre el sistema reproductivo, debido a que los pesos de los testículos, epidídimos, próstata y vesícula seminal no fueron alterados (p > 0,05); de igual manera, los valores fisiológicos como conteo y movilidad espermática no disminuyeron con el tratamiento (p > 0.05). El tránsito y maduración de los espermatozoides en el epidídimo no sería afectado por el NP, y al no observar aumento en la fragmentación del ADN espermático en el grupo tratado (p > 0,05), la protaminación espermática estaría cumpliendo su rol protector sobre el material genético murino, por lo que no hubo daños genotóxicos por el NP. Conclusión: La administración intraperitoneal de 50mg/kg/pc de NP, por siete días, no causa toxicidad sistémica ni efecto en la espermatogénesis en ratón.
Palabras Clave: Concentración espermática, fragmentación del ADN, movilidad espermática, nitrato de plomo, protaminación espermática. (Fuente: DeCS–BIREME)
ABSTRACT
Introduction: Lead toxicity has been linked to different diseases in humans and several evidences suggest a strong relationship with the observed damage on reproductive function in humans and rodents. Methods: Mice were given a single dose of lead nitrate (NP) (50mg/kg/bw), which were euthanized seven days post-injection with the aim of evaluating sperm to come out from the seminiferous tubules and are in transit through the epididymis. Also, the TUNEL test was done to evaluate the sperm DNA fragmentation. Results: The decrease in body weight in mice treated with LN (p < 0.05), suggest a toxic systemic effect. However, the same didn’t happen on the reproductive system because the weights of the testes, epididymis, prostate and seminal vesicles were not altered (p>0.05), in the same way physiological values such as sperm concentration and motility didn´t decrease with the treatment (p > 0.05). Transit and sperm maturation in the epididymis would not be affected by the LN, and because we did not observe increased sperm DNA fragmentation in the treated group (p > 0.05), sperm protamination would be fulfilling its protective role on murine genetic material avoiding genotoxic damage by LN. Conclusion: The intraperitoneal administration of 50mg/kg/pc of LN for seven days does not cause systemic toxicity or effect on spermatogenesis in mice.
Keywords: Sperm concentration, DNA fragmentation, sperm motility, lead nitrate, sperm protamination. (Source: MeSH-NLM)
INTRODUCCIÓN
La población, en general, está expuesta a metales a baja concentración en forma voluntaria, por consumo de suplementos alimenticios, o involuntarias, a través de
la ingesta de agua o alimentos contaminados y por el contacto con suelos, polvo y aire contaminados (1).
Entre los metales pesados, el plomo es un contaminante ampliamente distribuido en todos los sistemas ambientales y biológicos (2).
La detección y prevención de la toxicidad del plomo es un problema importante de salud pública (3).
Si bien la exposición de la población al plomo ha disminuido en las últimas tres décadas, con la introducción de pinturas bajas en plomo, petróleo sin plomo y la
prohibición de soldaduras de plomo en latas de alimentos (4),
aún permanece la exposición subclínica en otras fuentes como tuberías de plomo, juguetes de plomo, insecticidas, refinerías de petróleo, material de construcción,
balas de armas de fuego, rayos-X y subproductos industriales (3).
Se debe agregar la alta exposición sobre las poblaciones que habitan cerca de las minas, relaves y depósitos de este metal como en la Oroya y el Callao, donde se
han reportado altos niveles de plomo en la sangre de los habitantes, especialmente en niños (5)
e incluso, en recién nacidos (6), por lo que su potencial riesgo sobre la salud humana es aún un tema de mucho debate.
La toxicidad del plomo se ha relacionado a diferentes patologías en humanos (7)
y se sugiere su relación con el daño observado sobre la función reproductiva en humanos y roedores (8,9).
La mayoría de reportes indican que trabajadores expuestos a Pb+2 exhiben una densidad espermática disminuida y una alta tasa de teratozoospermia (10).
El plomo se encuentra en la naturaleza como un óxido o sal; así, el acetato de plomo (AP) ha mostrado producir infertilidad en ratones (11,12);
la evaluación desde la primera a quinta semana postinyección de AP en dosis única de 100 mg/kg de peso corporal (pc), aumentó el estrés oxidativo y las anormalidades morfológicas del
espermatozoide, mientras que disminuyó el recuento espermático en la cola del epidídimo (13).
A su vez, el nitrato de plomo (Pb(NO3)2) (NP) tiene una multitud de usos y es un producto de importancia económica (14);
es embriotóxico en ratas (15) pero no teratogénico (16) y sus efectos genotóxicos aún son
muy controversiales (17,18).
Se ha reportado que 44,8 mg/kg/pc de NP induce daño en el ADN de células sanguíneas aún después de siete días de exposición (14).
El mecanismo por el cual el plomo ejercería efectos tóxicos sobre el sistema reproductivo aún no ha sido totalmente elucidado, pero ha sido reportado que induce estrés oxidativo en
diferentes tejidos con la consecuente generación de especies reactivas de oxígeno (EROs) (13,19).
El daño por EROs conlleva a infertilidad por dos mecanismos: daño a la membrana espermática que disminuye la movilidad del espermatozoide y su capacidad para fusionarse con el ovocito,
y el daño al ADN espermático que altera la contribución genómica paterna hacia el embrión. La fragmentación del ADN espermático se ha relacionado a muchos aspectos
reproductivos (20) y es predictivo de las tasas de fertilización y embarazo (21) lo que demuestra la importancia de su evaluación.
En la actualidad, no existe ningún reporte acerca del efecto del NP sobre la integridad del ADN espermático y considerando que la exposición al plomo sigue siendo un serio problema de
salud pública, este trabajo intenta esclarecer si una dosis única de NP (50mg/kg/pc) afecta las características reproductivas masculinas y la integridad del ADN espermático evaluadas
siete días postinyección.
MÉTODOS
Diseño y área de estudio
Estudio experimental preclínico de casos y controles, área de biología experimental.
Población y muestra
La muestra estuvo conformada por ratones machos (N = 20) (Mus musculus) de 6-7 semanas de edad, de la cepa Balb C; el grupo casos (GT) (experimental), 10 ratones, a quienes se les administró intraperitonealmente (ip) una dosis única de nitrato de plomo (50 mg/kg/pc); el grupo control (GC) lo integró 10 ratones, los cuales recibieron, por la misma vía, agua bidestilada. Todos fueron mantenidos en condiciones de bioterio: temperatura de 25 ºC a 27 ºC, con libre acceso a la comida balanceada (Purina-Perú), agua ad libitum y un fotoperiodo de 14/10 horas luz/oscuridad.
Variables
Variables independientes: Sexo (macho, tratamiento ratones machos).
Variable dependiente: Calidad reproductiva del ratón macho. Se realizó una ficha de recolección de datos con todas las variables del estudio de investigación donde se
registraron los hallazgos encontrados.
Procedimientos
1. Tratamiento: Los ratones fueron divididos en dos grupos: al grupo tratado (GT) (n = 10) se les administró el NP, siete días postinyección, se registró el peso corporal y los animales fueron eutanizados por dislocación cervical; se registró el peso de los testículos, epidídimos, próstata y vesícula seminal mediante una balanza analítica con 0,001 g de sensibilidad. Este tiempo de evaluación postinyección permite analizar a los espermatozoides luego de su tránsito por el epidídimo (22). Se registró la concentración y movilidad espermática; la fragmentación del ADN espermático fue evaluada por la técnica TUNEL.
2. Obtención de los espermatozoides: Se diseccionó la cola del epidídimo, se lavó con PBS (pH 7,4) y en 0,5ml de medio Flushing (MediCult®, Copenhagen, Dinamarca), se realizaron varias incisiones, lo que permitió la liberación de los espermatozoides durante 10 minutos a 37 ºC, el contenido espermático se recuperó en su totalidad en tubos de polipropileno de 1,5 ml (Axygen Scientific).
3. Evaluación de la Movilidad y concentración espermática: Se consideró que un espermatozoide presentaba movilidad progresiva (MP), cuando se desplazaba, movilidad no progresiva (MNP) a aquellos que no se desplazaban y solo tenían un movimiento in situ e Inmóviles (I), los que no presentaban ningún tipo de movimiento (23). El recuento espermático se realizó en una cámara de Newbauer.
4. Fragmentación del ADN espermático: La fragmentación del ADN espermático se evaluó mediante el ensayo TUNEL, el cual evalúa la presencia de extremos 3´-hidroxil libres, los cuales son identificados por la enzima TdT (terminal deoxynucleotidyl transferase) que cataliza la adición de deoxiuracilos trifosfatos marcados con fluorescencia en las roturas de las hebras del ADN. Se utilizó el Kit In Situ Cell Death (Roche, Perú); en resumen y siguiendo las instrucciones del proveedor, la técnica consiste en fijar los espermatozoides con 4 % de paraformaldehído, lavar en PBS, permeabilizar la membrana de los espermatozoides e incubar una hora con la enzima TdT a 37 ºC y en oscuridad. Se incluyó un control positivo, el cual se incubó con 50 unidades de ADNasas por 30 minutos a 37 ºC antes de colocar la enzima, y un control negativo al cual no se añadió enzima. La visualización de los espermatozoides se realizó en un microscopio de fluorescencia y el color verde evidenció daño al ADN espermático. Se analizaron 250 células por cada individuo.
Análisis estadísticos
Los resultados fueron evaluados usando el paquete estadístico SPSS 17,0 para Windows. Se realizó el test de Shapiro Wilk y Leneve para comprobar normalidad y homocedasticidad de los datos. Las diferencias entre los grupos se analizaron mediante la prueba t-Student (pesos, movilidad y concentración espermática) y U de Mann Whitney (fragmentación del ADN espermático). Los resultados son expresados como media ± EE (error estándar), n=10. Un valor de p < 0,05 fue considerado estadísticamente significativo.
Aspectos éticos
El cuidado y manejo de los animales se realizó de acuerdo con las pautas éticas de nuestra institución y del Consejo Nacional de Investigación para el cuidado y uso de animales de laboratorio (24).
RESULTADOS
Se observaron diferencias significativas entre los pesos corporales final e inicial durante el experimento; fue menor y negativa en el grupo NP (p < 0,05) (Tabla 1). Los pesos de los órganos reproductivos: testículos, epidídimos, próstata, vesícula seminal (Tabla 1), los valores fisiológicos de movilidad (Figura 1) y concentración espermática (Figura 2).
Tabla 1. Diferencia del peso corporal, pesos de testículo, epidídimo, próstata, vesícula seminal en el grupo de tratamiento Pb(NO3)2 (50mg/kg/pc) vs Control (H2O). *p < 005, Student's test. Media ± Error estándar (EE), n=10.
|
|
Control (H2O) |
Pb(NO3)2 (50mg/kg/pc) |
|---|---|---|
|
∆Peso Corporal |
1,7752 ± 0,5694* |
0,1632 ± 0,0991 |
|
Peso Testículo |
0,0913 ± 0,0030 |
0,0932 ± 0,0037 |
|
Peso Epidídimo |
0,0295 ± 0,0011 |
0,0302 ± 0,0016 |
|
Peso Próstata |
0,0122 ± 0,0012 |
0,0129 ± 0,0011 |
|
Peso Vesícula Seminal |
0,2591 ± 0,0291 |
0,2675 ± 0,0476 |
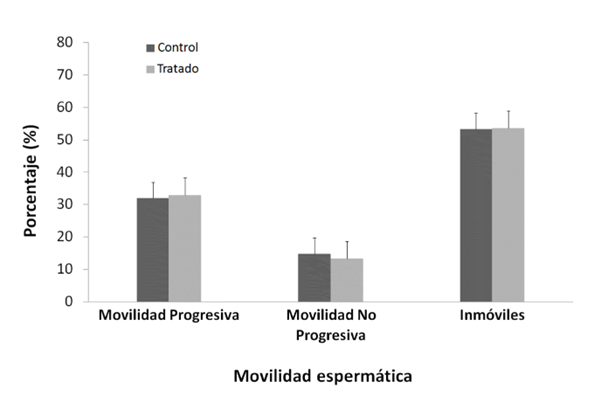
Student's test. Media ± Error estándar (EE), n=10.
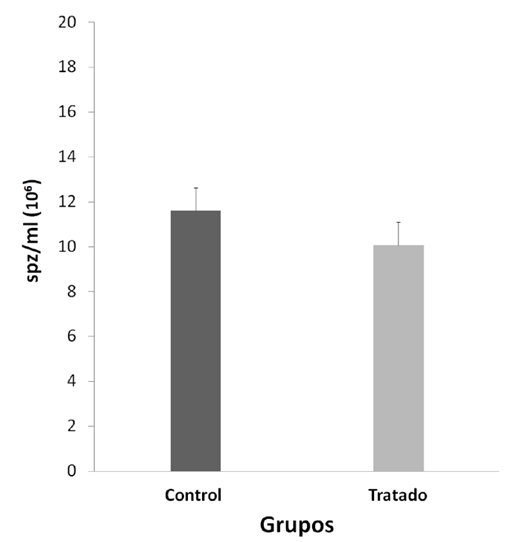
Student's test. Media ± Error estándar (EE), n=10.
Tabla 2. Test de fragmentación del DNA (TUNEL) de células espermáticas de ratón tratadas con nitrato de plomo frente al control.
|
|
Control (H2O) |
Pb(NO3)2 (50mg/kg/pc) |
|---|---|---|
|
Fragmentación del ADN |
0,2 |
0,8 |
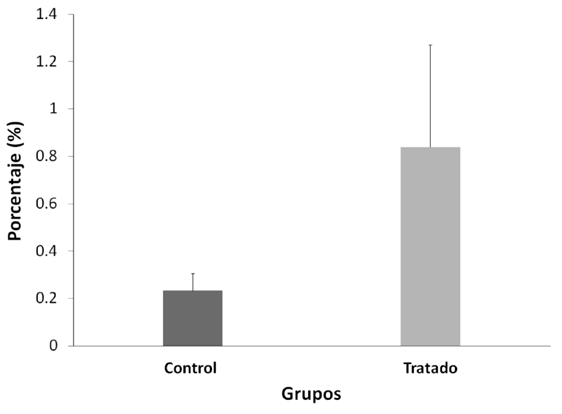
Mann-Whitney U-test. Media ± Error estándar (EE), n=10.
La fragmentación espermático evaluada con TUNEL entre ambos grupos no fue alterada después del tratamiento con NP (p>0.05) (Figura 3); el control positivo en esta prueba fue 99% y el control negativo, 0 %. Las fragmentaciones del ADN no presentaron diferencias significativas (p > 0,05).
DISCUSIÓN
El presente trabajo intenta investigar los efectos de una dosis única de NP en espermatozoides de ratón. Se evidenció un efecto tóxico sistémico del NP al disminuir el peso corporal de los
ratones tratados (Tabla 1, p < 0,05).
Sin embargo, los pesos de los testículos, epidídimos, próstata y vesícula seminal, que son órganos blanco dependientes de andrógenos (25), no disminuyeron,
por lo cual el NP no estaría ejerciendo un efecto tóxico ni antiandrogénico sobre el sistema reproductor masculino (Tabla 1, p > 0,05).
El NP no ejercería un efecto localizado sobre la fisiología espermática, debido a que no se observaron diferencias significativas en la movilidad y concentración espermática entre ambos grupos
(Figura 1 y Figura 2, p > 0,05); el tránsito y maduración de los espermatozoides en el epidídimo no sería afectada por el NP. En esta investigación, dentro
del ciclo espermatogénico del ratón, se evaluaron los espermatozoides depositados en el epidídimo (22),
los que ya han intercambiado sus histonas por protaminas; ello permite condensar fuertemente el genoma paternal dentro del núcleo (26). Mientras que las histonas de
una célula somática compactan el ADN y forman nucleosomas; las protaminas, proteínas exclusivas de los espermatozoides, enrollan y condensan el ADN en subunidades mucho más grandes, conocidas
como toroides (26). De esta manera, la cromatina espermática experimenta una fuerte compactación, seis veces más que en una célula
somática (27) y protege la integridad del ADN espermático (25,27,28).
Sin embargo, los múltiples residuos de cisteína que rodean el núcleo espermático son oxidados para formar puentes disulfuros entre las protaminas y estabilizar la cromatina durante los
estados finales de la maduración espermática (28),
con lo que se consigue la completa protección del ADN espermático recién en el propio epidídimo. Devi (14)
observó daño en el ADN de células sanguíneas en ratones evaluados siete días postadministración de una dosis de NP (44,8 mg/kg/pc), concentración similar usada en este trabajo (50 mg/kg/pc).
Por ello, se esperaba que el NP cause daño al ADN de los espermatozoides; sin embargo, nuestros resultados demuestran lo contrario (Figura 3, p > 0,05),
lo que pone en evidencia la importancia de la protaminación como mecanismo de protección del espermatozoide frente al NP (29).
A su vez, el epidídimo al poseer una gran cantidad de enzimas antioxidantes (30),
podría contrarrestar de manera adecuada el bien documentado efecto del plomo sobre la inducción de EROs en distintos tejidos (31).
En otro aspecto, se ha demostrado que los efectos del plomo sobre el sistema reproductivo dependen del tiempo de exposición y retornan a valores normales después de un tiempo prologando
de exposición (32),
lo que sugiere que un animal expuesto a este metal es capaz de adaptarse a sus efectos tóxicos; en el presente trabajo, al administrar dosis única de NP se descarta la posibilidad de no
observar daño al sistema reproductor, fisiología espermática e integridad del ADN espermático, debido a un prolongado tiempo de exposición al NP.
Como limitaciones del estudio, se tuvo la naturaleza logística en la institución donde se desarrolló el trabajo, principalmente de índole de cortes de luz durante los fines de semana que
perjudicó la dosificación y la continuidad del seguimiento de los animales. Además, la imposibilidad de ingreso los días domingo al pabellón de investigación por falta de personal de
vigilancia. Todo esto ocasionó retrasos y repetición del diseño experimental.
CONCLUSIÓN
Una dosis única de nitrato de plomo 50mg/kg/pc no altera parámetros reproductivos ni ejerce daño sobre al ADN espermático en ratones.
Contribuciones de Autoría: Los autores participaron en la génesis de la idea, diseño del proyecto, desarrollo, recolección e interpretación de data,
análisis de resultados y preparación del manuscrito.
Financiamiento: Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos (Proyecto con fondos monetarios, Código 091001301).
Declaración de conflictos de intereses: Los autores declaran no tener conflicto de interés en la publicación de este artículo.
Recibido: 21 de noviembre del 2022.
Aprobado: 13 de febrero del 2023.
Correspondencia: José Luis Rafael Pino Gaviño.
Dirección: Av. German Amézaga 375, cercado Lima-Perú.
Teléfono: +51 992169186
Correo electrónico: jpinog@unmsm.edu.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0 (https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS BIBLIOGRÁFICAS
