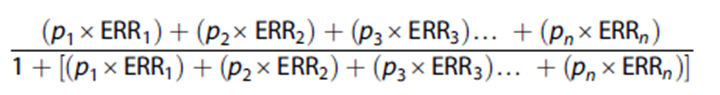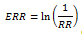ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2019 - Universidad Ricardo PalmaDOI 10.25176/RFMH.v20i1.2657
ESTUDIO DE FACTIBILIDAD PARA EVALUAR LA PROPORCION DE CANCER ATRIBUIBLE A FACTORES DE RIESGO MODIFICABLES EN EL PERÚ Y LATINOAMERICA.
FEASIBILITY STUDY TO ASSESS THE PROPORTION OF CANCER ATTRIBUTABLE TO MODIFIABLE FACTORS OF RISK IN PERU AND LATIN AMERICA.
Jhony A. De La Cruz-Vargas1,4
, Willy Ramos2,3
, Willer Chanduví1
, Rubén Espinoza1
, Nadia Guerrero2
, Joan A. Loayza-Castro1
, Alfonso Gutiérrez Aguado1,2
, Ronald Carpio1
, Manuel Loayza Alarico1,2
1 Instituto de Investigación en Ciencias Biomédicas (INICIB), Universidad Ricardo Palma, Lima-Perú.
2 Centro Nacional de Epidemiología, Prevención y Control de Enfermedades, Ministerio de Salud, Lima-Perú.
3 Instituto de Investigaciones Clínicas, Universidad Nacional Mayor de San Marcos, Lima-Perú.
4 Latin American Lifestyle Medicine Association.
RESUMEN
Objetivo: Evaluar la factibilidad y validar la propuesta metodológica para estimar la incidencia y mortalidad por cáncer atribuible a factores de riesgo modificables para el Perú y Latinoamérica.
Métodos: Estudio piloto, ecológico a partir de fuentes secundarias. Se buscó y seleccionó los factores de riesgo modificables, prevalencia de exposicion, los riesgos relativos de dichos factores (RR) o una aproximación mediante la razón de posibilidades (OR). La información fue consignada en una ficha de recolección de datos la cual fue validada mediante juicio de expertos. Para el cálculo de la Fracción Atribuible Poblacional (FAP) se ensayó la fórmula planteada por Parkin y se desarrolló un modelo de simulación estadística con el software R. Studio V. 3.6.1.
Resultados: En el Perú se cuenta con estudios de prevalencia para la mayoría de factores de riesgo modificables; asimismo, se dispone en Latinoamérica de estudios con estimaciones de OR para varios de los factores; sin embargo hubo que utilizar estudios de los Estados Unidos para los factores restantes. No hallamos estudios nacionales de radiaciones ionizantes ni ultravioleta. Se ensayó la sintaxis del modelo de simulación estadística la cual mostró ser válida y consistente con los resultados de investigaciones internacionales de FAP encontrándose dentro de los rangos de los estudios publicados.
Conclusión: Es factible y viable realizar estudios de FAP de factores de riesgo modificables para cáncer en países de Latinoamérica, particularmente en el Perú, donde se cuenta con la información requerida para su estimación.
Palabras Clave: Cáncer; Factores de riesgo, Fracción atribuible poblacional; Medicina del estilo de vida (fuente: DeCS BIREME).
ABSTRACT
Objective: To evaluate the feasibility and validate the methodological proposal to estimate the incidence and mortality due to cancer attributable to modifiable risk factors for Peru and Latin America.
Methods: Pilot study, ecological from secondary sources. Modifiable risk factors, exposure prevalence, relative risks of these factors (RR) or an approximation by means of possibilities ratio (OR) were searched and selected. The information was recorded in a data collection form which was validated by expert judgment. For the calculation of the Population Attributable Fraction (FAP), the formula proposed by Parkin was tested and a statistical simulation model was developed with R. Studio V. 3.6.1 software.
Results: In Peru there are prevalence studies for the majority of modifiable risk factors; Likewise, studies with OR estimates for several of the factors are available in Latin America; however, studies from the United States had to be used for the remaining factors. No national studies of ionizing or ultraviolet radiation were found. The syntax of the statistical simulation model was tested, which proved to be valid and consistent with the results of international FAP studies within the ranges of published studies.
Conclusion: It is feasible and viable to carry out PAF studies of modifiable risk factors for cancer in Latin American countries, particularly in Peru, where the information required for its estimation is available.
Key words: Cancer; Risk factors; Population attributable fraction; Lifestyle medicine (source: MeSH NLM).
El cáncer constituye una de las principales causas de morbilidad y mortalidad y está influenciado en gran medida por el estilo de vida y los factores de riesgo ambientales. Los factores de riesgo que contribuyen con la carga general del cáncer son aquellos con los riesgos relativos más altos asociados con la exposición, con la mayor prevalencia de exposición en la población y con el mayor número de tipos de cáncer comunes asociados o combinaciones de los mismos. La prevalencia de exposición a estos factores de riesgo varía con el sexo, período de tiempo, con la geografía y las edades elegibles para los programas de detección.(1-3)
Debido a ello, muchos cánceres están causalmente relacionados con factores de riesgo potencialmente modificables y las estimaciones de esta proporción en una población es conocida como la fracción atribuible poblacional (FAP). De este modo, la FAP constituye una herramienta valiosa para establecer prioridades para la prevención y el control del cáncer(4,5).
Los cambios en la exposición a los factores de riesgo modificables son impulsores clave de los cambios en la incidencia y mortalidad del cáncer y las mejoras en el diagnóstico de este. La cuantificación de la participación de estos factores de riesgo contribuiría a la reducción en la incidencia de cáncer, que podría lograrse mediante la reducción o eliminación de la exposición al riesgo. Por ende, la prevención primaria a través de modificaciones de estos factores del estilo de vida y ambientales a nivel de la población, conocido ahora como Medicina del Estilo de Vida(6), ofrece grandes posibilidades para reducir la cantidad de personas diagnosticadas con cáncer. Sin embargo, en el Perú faltan estimaciones de los casos de cáncer atribuibles a factores de riesgo modificables.
El objetivo de este estudio fue evaluar la factibilidad y validar la propuesta metodológica para la estimación de la incidencia y mortalidad por cáncer atribuible a factores de riesgo potencialmente modificables en el Perú durante el año 2018, utilizando datos representativos a nivel nacional en adultos mayores de 30 años para 20 tipos de cáncer (excluyendo el cáncer de piel no melanoma).
MÉTODOS
Estudio piloto, cuantitativo, ecológico realizado a partir de fuentes secundarias.
Con fines de obtener la fracción atribuible a factores de riesgo modificables para cáncer fue necesario obtener previamente información de la prevalencia de exposición y riesgo relativo según sexo de dichos factores a partir de fuentes secundarias. Para ello se realizó una busqueda sistematica de los factores de riesgo modificables con suficiente nivel de evidencia disponible para ser incluidos.
Prevalencia de Exposición, Incidencia y Mortalidad por cáncer
La prevalencia de exposición de los factores de riesgo modificables para cáncer fue obtenida a partir de las siguientes fuentes de información.
- Observatorio Mundial de Cáncer (GLOBOCANCancer today): A partir de las estimaciones de la Agencia Internacional para la Investigación del Cáncer (IARC) se pudo obtener el número de casos incidentes de cáncer. La estimación del número de casos de cáncer realizada por la IARC está disponible también para los demás países Latinoamericanos(7).
- Estadísticas vitales: El número de defunciones puede obtenerse a partir de los Registros de Defunciones de cada país. En el caso de Perú, la información fue obtenida del documento técnico “Análisis de la Situación del Cáncer en el Perú, 2018” que consigna información del Registro de Defunciones del Ministerio de Salud(8). En caso de un subregistro considerable de la mortalidad es posible aproximarse al número de defunciones haciendo uso de metodologías de estimación y corrección del subregistro(9). Para el caso de los países de Latinoamérica puede obtenerse información a partir de los análisis situacionales del cáncer(10,11) o atlas de la mortalidad publicados en algunos países(12).
- Encuestas nacionales demográficas y de salud: La mayoría de países de Latinoamérica disponen de encuestas nacionales que permiten obtener la prevalencia de factores de riesgo modificables para cáncer y otras enfermedades no trasmisibles(13-17). En el caso de Perú la información requerida fue obtenida de la Encuesta Demográfica y de Salud Familiar(13) (ENDES) a cargo del Instituto Nacional de Estadística e Informática (INEI) que recoge datos de consumo cigarrillos, alcohol, frutas y ensalada de verduras, sobrepeso y obesidad. Algunos datos de consumo de alimentos fueron obtenidos de la Encuesta Nacional de Hogares (ENAHO) a cargo también del INEI(18).
- Artículos de investigación: No toda la información acerca de factores de riesgo modificables puede ser obtenida a partir de las encuestas demográficas y de salud por lo que fue necesario recurrir a investigaciones independientes, idealmente de inferencia nacional, con fines de obtener información por ejemplo de la prevalencia de infecciones oncogénicas, exposición pasiva a humo de tabaco, actividad física entre otros(19-21).
- Repositorios de tesis: En algunos casos fue posible obtener información específica de tesis de pre y postgrado(22), principalmente para factores de riesgo poco comunes o de los que existen pocos estudios permitiendo aproximarse a la prevalencia o incidencia.
- Estudio mundial de carga de enfermedad: También puede ser útil información del estudio mundial de carga de enfermedad a cargo del Institute for Health Metrics and Evaluation (IHME) que al momento de la elaboración de este artículo disponía de información de 1990 a 2017.
Riesgo Relativo (RR)
Para identificar los riesgos relativos de cada factor de riesgo modificable fue necesario realizar una búsqueda sistemática (Pregunta PICOT) de artículos en Pubmed, Scopus, EMBASE, COCHRANE, SCIELO y documentos técnicos de la IARC. Fueron considerados en primera instancia metanálisis, en caso de no encontrase se consideró estudios de cohortes u estudios de casos y controles (en ese orden de importancia).(19-21)
Se revisó la literatura disponible tomando en cuenta que para el caso de algunos factores fue necesario diferenciar los RR según sexo y grupos de edad. En caso de existir diferencias en el riesgo según regiones geográficas se prefirió los artículos del país donde se realiza el estudio o de aquellos que consideran estimaciones de países latinoamericanos. Asimismo, se seleccionó en primera instancia estudios de factores de riesgo que controlen el efecto confusor de otras variables a partir de un análisis estadístico multivariado. Para el caso de ciertos factores de riesgo para los que existe poca información del riesgo de exposición (como la contaminación del aire) y/o para los que afectan a una baja fracción de la población (radiaciones ionizantes, exposición a cámaras de bronceado, etc) se valoró su inclusión(19-21)
Para los factores en los que que la búsqueda sistemática no identificó estudios con RR para los factores de riesgo modificables se usó investigaciones que obtuvieron la razón de posibilidades u odds ratio (OR) como una aproximación estadística del RR.
Estimación de la Fracción Atribuible Poblacional
Para el cálculo de la Fracción Atribuible Poblacional (FAP) se utilizó la fórmula planteada por Parkin et al.(23)
Donde p1 es la proporción de la población en el nivel de exposición 1 (y así sucesivamente) y ERR1 es el exceso de riesgo relativo (riesgo relativo - 1) en el nivel de exposición 1 (y así sucesivamente). Se calculó la FAP para la ausencia o disminución de los factores de riesgo; para esto, los ERR se calcularon como el logaritmo natural del recíproco del riesgo relativo, esto es:
Con la finalidad de validar los valores obtenidos para los FAP se empleó un modelo de simulación estadística de Montecarlo haciendo uso del software R Studio V. 3.6.1, de forma que permita el cálculo de los FAP y sus respectivos intervalos de confianza. Este software es de uso libre y se puede correr en Windows, Linux y MacOs. Se adoptó la sintaxis del lenguaje de programación S que fue desarrollado por Bell Laboratories. Para la simulación se tuvo en cuenta la distribución de las prevalencias y riesgos, generando 1000 valores asemejando los valores reales. En la sintaxis para el cálculo de los FAP y sus intervalos de confianza se utilizó funciones donde los valores de los riesgos y las prevalencias fueron los que cambiaron según el FAP a calcular.(20)
El número de casos de cáncer y muertes atribuibles a cada factor de riesgo según sexo se calculó multiplicando el número de casos de cáncer o muertes en cada sexo y grupo de edad por la FAP en ese grupo de edad y sexo sumando los resultados de cada grupo de edad.(20)
Instrumento
Se diseñó una ficha de recolección de datos para registrar la prevalencia de exposición a factores de riesgo para cáncer y RR obtenidos a partir de fuentes secundarias. Dicho instrumento fue sometido a validez de contenido mediante juicio de expertos.
RESULTADOS
Factores de Riesgo modificables
La búsqueda sistemática identificó como factores de riesgo prevenibles en base a un incremento significativo del riesgo de cáncer (Tabla 1) a los siguientes:(24-32)
- Estilos de vida no saludables: Consumo de cigarrillos, exposición pasiva al humo de tabaco, consumo de alcohol, consumo de carnes rojas y procesadas, bajo consumo de frutas y verduras, fibra dietética, inactividad física y exceso de peso corporal.
- Factores ambientales: exposición a la radiación ultravioleta (UV), exposición a radiaciones ionizantes.
- Infecciones oncogénicas: Infección por Helicobacter pylori, virus de la hepatitis B (VHB), virus de la hepatitis C (VHC), virus del herpes humano tipo 8 (VHH-8), virus de la inmunodeficiencia humana (VIH), virus linfotrópico humano de células T tipo 1 (HTLV-1) y virus del papiloma humano (VPH).
Prevalencia de exposición
Luego de la revisión sistemática se encontró que es posible obtener información respecto de factores de riesgo modificables para cáncer en el Perú. La principal fuente de información la constituyen las encuestas poblacionales realizadas por el INEI que permiten capturar información de prevalencia e intervalos de confianza según grupos de edad y sexo con un nivel de inferencia nacional. Las ENDES recogen con precisión factores de riesgo vinculados a estilos de vida no saludables como el consumo de tabaco, consumo de alcohol, bajo consumo de frutas y verduras, sobrepeso y obesidad. Las ENAHO por su parte, recogen datos del consumo de alimentos por parte de los hogares peruanos que permitirían aproximarse al consumo de carnes procesadas y fibra. Esto se muestra en la tabla 2.
Para el caso de las infecciones oncogénicas la principal fuente de información fueron los artículos publicados en revistas indizadas que fueron relevantes para la obtención de datos de la prevalencia del VHB, VHC, HTLV-1 y VHH-8. Si bien es cierto que dichos artículos presentaban información de encuestas poblacionales a un nivel subnacional o en bancos de sangre, sus resultados son consistentes y coinciden con resultados de encuestas de años anteriores o con lo reportado en la literatura internacional por lo que también constituyen una alternativa para aproximarse a la prevalencia de dichas infecciones.
Para el caso de la infección por Helicobacter pylory, la mayoría de los estudios se realizaron en la década de 1990 y sólo se documentó un estudio reciente en dos distritos de Lima; sin embargo, también permitió una aproximación actual de la prevalencia de infección por dicha bacteria. Las estimaciones realizadas por agencias internacionales a partir de diversos estudios bajo modelos de metanálisis también fueron útiles para determinar la prevalencia de algunos oncopatógenos, particularmente del VPH (ICO) y del VIH (UNAIDS). La prevalencia de infecciones oncogénicas en el Perú se muestra en la tabla 3.
No se encontró estudios acerca de la prevalencia de exposición a radiaciones ionizantes y exposición a radiación ultravioleta que sean representativos de la población general de Perú y Latinoamérica por lo que no sería factible su inclusión en estudios de FAP.
Riesgos relativos u odds ratios
La búsqueda sistemática permitió obtener diversos estudios que reportaban la fuerza de asociación de los factores de riesgo según tipo de cáncer a partir de metanálisis; sin embargo, casi todos reportaban el OR en vez del RR. La estimación puntual de los OR e intervalos de confianza al 95% fueron obtenidos a partir de estudios de Colombia, Cuba, Estados Unidos y Perú (ver tabla 4).
Finalmente se ensayó la sintaxis del modelo de simulación estadística para estimar la FAP e intervalos de confianza usando el software R Studio a partir de la prevalencia de exposición y aproximación al RR obtenidos. El modelo mostró ser válido y consistente con los resultados de investigaciones internacionales de FAP encontrándose dentro de los rangos de los estudios publicados.
Tabla 1. Factores asociados con incremento de Riesgo de Cáncer, por Tipo de Cáncer.
| Factor de Riesgo (estudio) | Tipo de Cáncer (CIE10) |
| Estilos de vida no saludables | |
| Tabaquismo (secretan 2009, Benitez 2018 ) | Cavidad oral, faringe (C00-C14); esofago; estomago (C15); Colorectal (C18-C20, C26.0); Higado (C22.0, C22.2-C22.4, C22.7,C22.9); pancreas (C25); cavidad nasal/senos paranasales (C30-C31); laringe (C32); pulmon, traquea bronquial (C33-C34); cuello uterino ( C53); riñon, pelvis renal y ureter ( C64-C66); vejiga (C67); leucemia mieloide aguda ( C92.0; C92.4-C92.5, C94.0, C94.2). |
| Exposición al Humo de cigarrillo (Secretan 2009) | Pulmón, bronquial, traquea (C33-C34; solo entre no fumadores y exfumadores) |
| Exceso de peso corporal(Lauby - Secretan 2009, Milena 2019) | Esófago (C15; solo adenocarcinoma); Estómago (C16; solo cardias); Colorectal (C18-C20, C26.0); Hígado (C22.0, C22.2-C22.4. C22.7), C27.9); Vesícula biliar (C23); Páncreas (C25); Mama (C50; solo cáncer postmenopaúsico); Cuello uterino (C54-C55); Ovario (C56); Riñon, Pelvis renal (C64-C65); Tiroides (C73); Mieloma Múltiple (C90.0,C90.2)< |
| Consumo de Alcohol (Secretan 2009, Benitez 2018, Milena 2019) | Labio, Cavidad Oral, Faringe (C00-C14); Esofago (C15; solo carcinoma de cellula escamosas); Colorectal (C18-C20,C26.0); Hígado (C22.0, C22.2-C22.4, C22.7, C22.9) laringe (C32); Mama (C90) |
| Mala alimentación (WCRF/AICR 2017, Milena 2019) | Mama (C50), Colorectal (C128-C20, C26.0) |
| Inactividad Física(24,26,34) | Colon, excluyendo recto (C18, C26.9) mama (C50; solo cánceres premenopáusicos inversamente asociados con actividad vigorosa, cánceres posmenopáusicos inversamente asociados con todo tipo de actividad física); Cuello uterino (C54-C55) |
| Radiación ultravioleta(35) | Melanoma de la piel (C43) |
| Infecciones | |
| Helicobacter pylori(28,36) | Estómago (C16.1-C16.6) |
| Virus Hepatitis B(31,36) | Hígado (C22.0, C22.2-C22.4, C22.7, C22.9) |
| Virus Hepatitis C(32,36) | Hígado (C22.0, C22.2-C22.4, C22.7, C22.9); Linfoma no Hodgkin (C82-C85. C96.3) |
| Virus Herpes tipo 8(36) | Sarcoma de Kaposi (C46) |
| Virus de Inmunodeficiencia Humana(32,36) | Ano (C21); Sarcoma de Kaposi (C46); Cervix (C53); Linfoma de Hodgkin (C81); Linfoma no Hodgkin (C82-C85, C96.3) |
| Virus del Papiloma Humano(29,36) | Cavidad Oral (C02-C06); Orofaringe, Lengua (C01, C09-C10), Ano (C21), Cervix (C53), Vulva (C51), Vagina (C52), Pene (C60) |
Tabla 2. Fuentes secundarias para la obtención de la prevalencia de factores de riesgo para cáncer relacionados a estilo de vida no saludable en Perú.
| Factor de riesgo | Prevalencia (%) | IC 95% | Fuente | Población de referencia | Link |
| Consumo actual de tabaco | 11,2 | 10,6-11,8 | INEI – ENDES 2018 | Nacional (15 a más años) |
http://iinei.inei.gob.pe/microdatos/ |
| Consumo de tabaco en el último año | 18,9 | 18,2-19,6 | INEI – ENDES 2018 | Nacional (15 a más años) |
http://iinei.inei.gob.pe/microdatos/ |
| Exposición a tabaco de segunda mano en el hogar | 13,6 | 11,3-16,3 | GYTS PERÚ 2014 | Nacional (13 a 15 años) |
|
| Exposición a tabaco de segunda mano en lugares públicos cerrados | 30,8 | 28,2-33,6 | GYTS PERÚ 2014 | Nacional (13 a 15 años) |
|
| Sobrepeso | 37,3 | 36,5-38,2 | INEI – ENDES 2018 | Nacional (15 a más años) | http://iinei.inei.gob.pe/microdatos/ |
| Obesidad | 22,7 | 22,0-23,5 | INEI – ENDES 2018 | Nacional (15 a más años) |
http://iinei.inei.gob.pe/microdatos/ |
| Consumo de alcohol en el último año | 68,9 | 68,2-69,7 | INEI – ENDES 2018 | Nacional (15 a más años) |
http://iinei.inei.gob.pe/microdatos/ |
| Consumo actual de alcohol | 34,5 | 33,6-35,3 | INEI – ENDES 2018 | Nacional (15 a más años) |
http://iinei.inei.gob.pe/microdatos/ |
| Consumo de carnes rojas | 29,0 | ESTUDIO DE MERCADO GFK 2015 | Nacional (18 a más años) |
https://elcomercio.pe/peru/peruanos-consumen-carnes-rojas-anuncio-oms-248193 | |
| Consumo de carnes rojas | 51,8 | 51,0 – 52,7 | INEI – ENAHO 2018 | Nacional (hogares últimos 15 días) |
http://iinei.inei.gob.pe/microdatos/ |
| Consumo per cápita de carne | 6,20 kg (persona/año) | MINAGRI – 2017 | Nacional (18 a más años) |
https://peru21.pe/economia/ministerio-agricultura-buscara-aumentar-consumo-carne-76411 | |
| Consumo de carnes procesadas |
Lima: 59% |
Gráfico 1ª: Patrón de Consumo de Huevos, Carnes, Pescado, Verduras y Frutas en Muestras Poblacionales Urbanas del Nivel del Mar y altura del Perú. 2014-16. |
|||
| Consumo de carnes procesadas | 27,4 | 26,5 – 28.4 | INEI – ENAHO 2018 | Nacional (hogares últimos 15 días) |
http://iinei.inei.gob.pe/microdatos/ |
| Bajo consumo de frutas y verduras | 89,0 | 88,4-89,5 | INEI – ENDES 2018 | Nacional (15 a más años) |
http://iinei.inei.gob.pe/microdatos/ |
| Sedentarismo (actividad física insuficiente) | 75,8 | 74,2-77,3 | Artículo de investigación | Nacional (15 a 69 años) |
Tarqui C. Nutr. Clín. Diet. Hosp. 2017; 37(4):108-115 |
| Consumo de fibra | 5,7 | 5,6 – 5,7 | INEI – ENAHO 2018 | Nacional (hogares últimos 15 días) |
http://iinei.inei.gob.pe/microdatos/ |
| Radiaciones ionizantes | Sin dato | Sin dato | No fuente de datos | --- | --- |
| Radiación ultravioleta | Sin dato | Sin dato | No fuente de datos | --- | --- |
Tabla 3. Fuentes secundarias para la obtención de la prevalencia de infecciones oncogénicas en Perú.
|
Factor de riesgo |
Prevalencia (%) |
IC 95% |
Población de referencia |
Fuente |
|
Infección por Helicobacter pylori |
63,6 |
No reportan intervalos de confianza |
Voluntarios de 2 distritos de Lima |
Pareja Cruz y col. |
|
Infección VHB |
5,0 |
4,1 - 5,9 |
Subnacional (18-29 años) |
Bernabé Ortiz y col. |
|
Infección VHC |
0,8-1,2 |
Estudios en población general y en bancos de sangre |
Rev. Gastroenterol. Perú; 2009; 29-4: 347-54 |
|
|
Infección por VHH-8 |
Argentina: 4,0 |
3,5 - 6,4 |
Donantes de sangre |
J Med Virol. 2004;72(4):661-7. |
|
Infección por VHH- 8 |
Peru 6,6 |
Donantes de sangre |
J Med Virol. 2017 Mar;89(3):518-527. |
|
|
Infección por el VIH |
0,3 |
0,3-0,5 |
Nacional |
ONUSIDA |
|
Infección por HTLV-1 |
3,4 |
3-4 |
Donantes de sangre adultos del Hospital Regional Guillermo Díaz de la Vega (Abancay). |
Ramírez-Soto.Transfus Med. 2018;28(3):263-5. Sánchez-Palacios. Int J Infect Dis 2003;7:132-7. |
Tabla 4. Estimación puntual del OR e intervalos de confianza para factores de riesgo modificables según país y región.
| Factor de exposición / tipo de cáncer | Región | OR | Intervalos de confianza (ic: 95%) |
| Inactividad física | |||
| Cáncer ovárico(24) | 1,34 | 1,14 - 1,57 | |
| Cáncer de cérvix(25) | 0,88 | 0,58 - 1,36 | |
| Exceso de peso corporal | |||
| Cáncer de mama(26) | América (Colombia) | 10,3 | 2,4 - 43,8 |
| Dieta no saludable | |||
| Cáncer de mama(26) | América (Colombia) | 3,1 | 2,6 - 3,8 |
| Consumo de alcohol | |||
| Cáncer de pulmón(27) | América (Cuba) | 2,06 | 0,8 - 5,1 |
| Cáncer de mama(26) | América (Colombia) | 1,3 | 1,0 - 1,6 |
| Consumo de cigarrillo | |||
| Cáncer de pulmón(27) | América (Cuba) | 8,5 | 3 - 23 |
| Cáncer de mama(26) | América (Colombia) | 3,6 | 1,3 - 9,9 |
| Radiación UV | |||
| Cáncer de mama(26) | América (Colombia) | 0,7 | 0,6 - 0,9 |
| Cáncer de piel | América (Ecuador) | 2,4 | 0,99 - 5,73 |
| Infección por helicobacter pylori | |||
| Cáncer gástrico(28) | América (Perú) | 2,36 | 1,36 - 4,04 |
| Infección por VPH | |||
| Cáncer de cérvix(29) | Mundial | 17,47* | 10,45 – 29,22 |
| Infección por VHB | |||
| Cáncer gástrico(30) | US | 1,19 | 1,03 - 1,37 |
| Cáncer de ano(30) | US | 1,66 | 1,17 - 2,33 |
| Cáncer de hígado(30) | US | 10,6 | 9,66 - 11,6 |
| Cáncer de vías intrahepáticas(30) | US | 1,67 | 1,18 - 2,37 |
| Cáncer nasofaríngeo(30) | US | 2,08 | 1,33 - 3,25 |
| Cáncer de próstata(11) | US | 0,81 | 0,73 - 0,91 |
| Infección por VHC | |||
| Cáncer de hígado(31) | US | 31,5 | 29 - 34,3 |
| Cáncer de vías intrahepáticas(31) | US | 3,4 | 2,52 - 4,58 |
| Cáncer de vías extrahepáticas(31) | US | 1,9 | 1,41 - 2,57 |
| Cáncer de páncreas(31) | US | 1,23 | 1,09 - 1,40 |
| Cáncer de ano(31) | US | 1,97 | 1,42 - 2,73 |
| Cáncer de piel(31) | US | 1,53 | 1,15 - 2,04 |
| Cáncer de próstata(31) | US | 0,73 | 0,66 - 0,82 |
| Infección por virus de inmunodeficiencia humana (VIH) | |||
| Cáncer colorectal(31) | US | 1,73 | 1,11 - 2,6 |
| Cáncer de próstata(31) | US | 1,65 | 0,98 - 2,79 |
| Cáncer de mama(31) | US | 1,5 | 1,01 - 2,24 |
DISCUSIÓN
El cáncer constituye un problema de salud pública, particularmente en países de bajos y medianos ingresos en donde las intervenciones de diagnóstico temprano tienen de baja a moderada cobertura y en los que en muchos casos no se prioriza las intervenciones preventivas. Para el caso de estos países, entre los que se encuentran la mayoría de países latinoamericanos, podría alcanzase resultados importantes si se interviniese de forma efectiva y eficiente sobre los factores de riesgo modificables, particularmente sobre las infecciones oncogénicas y los factores de riesgo derivados de estilos de vida no saludables(6,20).
Los estudios de fracción atribuible permiten estimar el porcentaje y número de casos de cáncer atribuibles a factores de riesgo que pueden ser potencialmente evitados lo que permitirá estimar el ahorro en vidas, en gastos de diagnóstico, atención médica, cirugías, medicamentos, rehabilitación, entre otros. Esto a su vez podría convencer a los decisores en salud de la importancia de invertir en la intervención sobre los factores de riesgo modificables lo que su vez generará un retorno económico al estado que puede ser reinvertido para mejorar la salud de la población(4,5,20,37-40). A pesar de ello no se dispone de estudios de FAP para cáncer a nivel de los países latinoamericanos; los principales estudios provienen de Estados Unidos, Canadá, China, Inglaterra y algunos países de Europa oriental con algunas diferencias metodológicas.
La presente investigación muestra que la propuesta metodológica de nuestro “Grupo Multidisciplinario de Investigacion en Cáncer y Medicina del Estilo de Vida”, para evaluar la proporcion de cáncer atribuible a factores modificables, es viable y factible, aplicable al Perú y Latinoamérica, y reune criterios similares a modelos internacionales publicados.
Asimismo, es posible aproximarse a los riesgos relativos a partir de metanálisis que obtienen el RR o se aproximan mediante el OR; sin embargo, debe considerarse que una fracción importante de estudios procede de los Estados Unidos en donde la FAP de factores de riesgo vinculados a estilos de vida no saludable es más alta que en países de Asia y Europa(40). De este modo, de disponerse de metanálisis de factores de riesgo para cáncer de países latinoamericanos podría obtenerse mayor precisión en las estimaciones de la FAP. Resulta evidente que quedan aspectos por investigar de los factores de riesgo para cáncer en Latinoamérica, particularmente los que corresponden a las infecciones oncogénicas que afectan principalmente a países de medianos y bajos ingresos.
Al momento de la elaboración del presente artículo se disponía de poca información de la población de países como el Perú respecto de la prevalencia de exposición a radiaciones ionizantes y radiación ultravioleta por lo que se recomienda no incluirlos en los estudios FAP hasta no disponerse de información de mayor calidad. La baja frecuencia de exposición de la población a radiaciones ionizantes hace que no sea considerada en otros estudios de FAP como el de Feng en China(40) y Poirer en Canadá(39).
Nuestro Grupo Multidisciplinario está trabajando en los resultados definitivos de la incidencia y mortalidad por cáncer atribuible a estos factores modificables, así como estudios de economía de la salud para evaluar el impacto económico en Perú para luego elevarlo a países de Latinoamerica.
CONCLUSIÓN
En conclusión, es factible y viable realizar estudios de FAP en países de Latinoamérica, particularmente en Perú, donde se cuenta con la mayor parte de la información necesaria para su estimación. Se requieren de más estudios respecto de radiación ultravioleta y exposición a radiaciones ionizantes de modo que puedan ser considerados en futuros estudios.
Contribuciones de autoría: Los autores participaron en: JADV en la génesis de la idea, JADV, WCRM, WCH,RE en el diseño del proyecto, JADV,WCRM,WCH,RE,JLC,AGA,RC,MLA,NG en la recolección e interpretación de datos, análisis de resultados, preparación del manuscrito del presente trabajo de investigación.
Financiamiento: Financiado por el fondo de investigacion de la Universidad Ricardo Palma, ACU N° ACU2619-2019.
Conflicto de interés: Los autores declaran no tener conflicto de interés en la publicación de este artículo.
Exoneración de responsabilidad: El presente manuscrito es responsabilidad exclusiva de los autores y no representa una opinión oficial de la Universidad Ricardo Palma, Ministerio de Salud y Universidad Nacional Mayor de San Marcos.
Recibido: 11 de noviembre 2019
Aprobado: 16 de diciembre 2019
Correspondencia: Jhony A. De La Cruz-Vargas
Dirección:INICIB, Facultad de Medicina Humana, Edificio I-208. 2do piso. Avenida Benavides 5440, Surco, Lima-Perú.
Teléfono: 708-0000 / Anexo: 6016.
Correo: jhony.delacruz@urp.edu.pe
REFERENCIAS BIBLIOGRÁFICAS