ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2020 - Universidad Ricardo PalmaDOI 10.25176/RFMH.v20i3.2968
ASOCIACIÓN ENTRE HIPOALBUMINEMIA E
HIPOFOSFATEMIA CON DESNUTRICIÓN EN PACIENTES CON
ENFERMEDAD RENAL
CRÓNICA EN HEMODIÁLISIS
ASSOCIATION BETWEEN HYPOALBUMINEMIA AND HYPOPHOSPHATEMIA WITH MALNUTRITION IN PATIENTS WITH CHRONIC RENAL DISEASE UNDERGOING HEMODIALYSIS.
Edwin Castillo Velarde1,2,a, Gloria Montero Pacora1,a
, Sandra García Llajaruna1,b
1 Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
2 Instituto de Investigación en Ciencias Biomédicas, Universidad Ricardo Palma. Lima, Perú.
a Médico Cirujano, Especialista en Nefrología.
b Médico Residente de Nefrología.
RESUMEN
Introducción: La malnutrición en los pacientes en hemodiálisis es consecuencia de diversos factores carenciales e hipercatabólicos y constituye un factor de riesgo de morbimortalidad.
Objetivo: Determinar la asociación entre hipoalbuminemia e hipofosfatemia con la escala de valoración global subjetiva (VGS) tipo C en pacientes con enfermedad renal crónica en hemodiálisis.
Métodos: Estudio transversal analítico. Se estudiaron pacientes del servicio de hemodiálisis del Hospital Guillermo Almenara. Para la asociación entre variables continuas de malnutrición y los tipos de VGS se utilizó el test de Kruskal-Wallis
y prueba de comparaciones múltiples y para las variables categóricas hipoalbuminemia (≤3,5 g/dL) e hipofosfatemia (
<3 mg/dL) se utilizó el chi cuadrado. Se analizó la asociación con la VGS tipo C. Resultados: Se incluyeron 131 pacientes y la edad mediana fue de 63 años. El 34% presentó hipoalbuminemia, 27% presentó hipofosfatemia y el 14% una VGA tipo C. El 52% (68) de los pacientes presentó alteración de al menos un biomarcador
analizado. Se encontraron diferencias entre VGS y albúmina (p
<0,001) y fósforo (p=0,040). Los pacientes con VGS tipo C tuvieron una media de albumina de 3,1±0,74 y de fósforo de 2,88±1,54 y, tuvieron diferencia significativa en comparación con los de VGS tipo A (p<0,001 y p=0,011, respectivamente). El análisis
de chi cuadrado también demostró asociación significativa entre VGS e hipoalbuminemina (p=0,017) e hipofosfatemia (p=0,050). Conclusión: Existe asociación entre la VGS tipo C e hipoalbuminemia e hipofosfatemia en pacientes con enfermedad renal crónica en hemodiálisis.
Palabras Clave: Hipoalbuminemia, Hipofosfatemia, Desnutrición, Diálisis. (Fuente: DeCS BIREME)
ABSTRACT
Introduction: Malnutrition in hemodialysis patients is a consequence of various deficiency and hypercatabolic factors and constitutes a risk factor for morbidity and mortality.
Objective: To determine the association between hypoalbuminemia and hypophosphatemia with the subjective global assessment scale (VGS) type C in patients with chronic kidney disease on hemodialysis.
Methods: Analytical cross-sectional study. Patients from the hemodialysis service of the Guillermo Almenara Hospital were studied. For the association between continuous variables of malnutrition and VGS types, the Kruskal-Wallis
test and multiple comparisons test were used, and for the categorical variables hypoalbuminemia (≤3.5 g / dL) and hypophosphatemia (
<3 mg / dL) chi square was used. The association with VGS type C was analyzed. Results: 131 patients were included and the median age was 63 years. 34% presented hypoalbuminemia, 27% presented hypophosphatemia and 14% a VGA type C. 52% (68) of the patients presented alteration of at least one biomarker analyzed.
Differences were found between VGS and albumin (p
<0.001) and phosphorus (p=0 .040). Patients with type C VGS had a mean albumin of 3.1 ± 0.74 and phosphorus of 2.88 ± 1.54 and had a significant difference compared to those of type A VGS (p <0.001 and p=0 .011, respectively). Chi square analysis also
showed a significant association between VGS and hypoalbuminemine (p=0 .017) and hypophosphatemia (p=0 .050). Conclusion: There is an association between VGS type C and hypoalbuminemia and hypophosphatemia in patients with chronic kidney disease on hemodialysis.
Keywords: Hypoalbuminemia; Hypophosphatemia; Malnutrition; Dialysis. (Source: MeSH NLM).
Los pacientes que realizan terapia de hemodiálisis presentan un mayor riesgo de muerte y malnutrición. La desnutrición proteico-energética o calórico-proteica constituye un estado patológico con pérdida del tejido muscular y graso. Suele asociarse a síndromes clínicos como el marasmo, en donde la sarcopenia se desarrolla en forma gradual con empeoramiento de las medidas antropométricas; al Kwashiorkor, en donde predomina el hipercatabolismo en el contexto de desnutrición proteica; o puede ser mixto. Si bien en la desnutrición es característica la pérdida de peso, en el paciente en terapia de hemodiálisis puede coexistir la pérdida de tejido muscular con el incremento del agua extracelular, por lo que no constituye un indicador altamente específico. Por otro lado, sí son bien reconocidos, los factores que reducen la ingesta y aumentan la pérdida de nutrientes en diálisis, tales como la anorexia, las dietas restrictivas, la pérdida de 5 a 8 gramos de aminoácidos por sesión de hemodiálisis y la fragilidad oral del anciano edéntulo(1,2,3).
El síndrome de desgaste energético-proteico fue introducido en el 2007 por la Sociedad Internacional de Nutrición Renal y Metabolismo, entendiéndose como un desorden del catabolismo, producto de una alteración metabólica y nutricional de la enfermedad renal crónica (ERC), habiéndose reportado una prevalencia en hemodiálisis entre el 28 y 54%(4). Sus criterios diagnósticos precisan de cumplir al menos uno en tres de cuatro categorías: bioquímicas (bajo nivel de albumina, transtiretina o pre-albúmina, o colesterol), masa corporal reducida (reducción del índice de masa corporal reducido o del tejido graso o pérdida de peso), reducción de la masa muscular y disminución de la ingesta calórica-proteica(5,6). Estos criterios, si bien están afectados en los pacientes con ERC, presentan poca reproducibilidad en nuestro medio, probablemente en relación a análisis no realizados como la transtiretina, no disposición y sesgo de la bioimpedancia para estimar la masa muscular y grasa, por el desuso de las medidas antropométricas y por la no realización de cálculos proteicos dietarios, lo cual precisa de encuestas como el recordatorio de 24 horas, que si bien es realizado por un nutricionista, no se realiza de manera extensiva, por lo que el enfoque propuesto deja de ser práctico. Asimismo, se ha reportado en poblaciones de diálisis, una inadecuada sensibilidad para los criterios diagnósticos(7,8). Sin embargo, la definición de este síndrome de desgaste energético proteico en hemodiálisis permite una mejor comprensión fisiopatológica del proceso de malnutrición vinculado a la inflamación, lo que incluye procesos inespecíficos tales como acidosis metabólica, resistencia a la insulina, incremento del estrés oxidativo, activación de sistema proteolíticos ubiquitina-proteasoma y toxinas urémicas(9-11).
Por ello, para la identificación de la malnutrición en su concepción actual, nos valemos de otras herramientas validadas para la población con enfermedad renal crónica, como la valoración global subjetiva (VGS), que permite asociar con riesgo de mortalidad, tiene amplia aceptación y adecuada reproducibilidad(12). Entre los biomarcadores de malnutrición que permiten una rápida identificación y corresponden al perfil de nuestra población, tenemos a la hipoalbuminemia, la cual además se ha asociado a una menor sobrevida(13,14) y a la hipofosfatemia, que es un marcador que se asocia a la desnutrición y que también se asocia al mayor riesgo de muerte de todas las causas(13,15-18).
El objetivo del estudio fue determinar la asociación entre hipoalbuminemia e hipofosfatemia con la VGS tipo C en pacientes con enfermedad renal crónica en hemodiálisis.
MÉTODOS
Diseño y área de estudio
El diseño del estudio fue transversal, analítico, no experimental. La muestra se obtuvo de los pacientes con ERC en terapia de hemodiálisis cuya población pertenece al servicio de Nefrología del Hospital Guillermo Almenara.
Población y Muestra
El muestreo fue no probabilístico. Se incluyeron pacientes mayores de 18 años, en terapia de hemodiálisis de 3 sesiones/semana. Se excluyeron aquellos con sepsis, gestantes, condición mórbida que no permite la entrevista.
Variables e instrumentos
Las variables clínicas analizadas fueron sexo, edad, etiología de la ERC, tiempo en hemodiálisis, albúmina, fósforo y VGS. El instrumento de recolección de datos se realizó con una ficha estandarizada mediante entrevista con revisión de sus análisis del registro laboratorial. La determinación de albumina fue por colorimetría con verde bromocresol y de fósforo por espectrofotometría con molibdato. Todos los pacientes fueron dializados con membrana de alto flujo, al menos 3 horas 3 veces/semana con agua ultrapura y la concentración de calcio en la solución de diálisis fue de 1,75 mmol/L. Las variables fueron expresadas como media y desviación estándar (DS).
Procedimientos
La VGS es una herramienta para valorar el estado nutricional que evalúa 5 componentes de la historia clínica (cambio de peso, dieta, síntomas gastrointestinales, capacidad funcional y enfermedad en relación con sus requerimientos nutricionales) y 3 componentes del examen físico (pérdida de tejido graso, muscular, alteraciones en el balance de fluidos). Define pacientes bien nutridos (VGS tipo A), y desnutridos (VGS tipo B y C, siendo B moderadamente desnutrido o en riesgo y C severamente desnutrido) (12). Este test ha sido validado en pacientes con enfermedad renal crónica y su detección de malnutrición se asocia a mortalidad en diálisis(19,20). En nuestro medio, la VGS se utilizó en un estudio multicéntrico de la Federación Latinoamericana de Terapia Nutricional para la determinación de malnutrición(21).
En cuanto a los biomarcadores de malnutrición se consideró la categoría de hipoalbuminemia menor o igual a 3,5 g/dL y de hipofostatemia menor a 3 mg/dL. El valor referencial de laboratorio para albúmina en su límite inferior es 3,8 g/dL por colorimetría con verde bromocresol y existen reportes que asocian este valor a desnutrición. El estudio de Kovesdy(14) en su regresión de Cox avala un valor menor o igual de 3,5 g/dL asociado a malnutrición y riesgo independiente de mortalidad. En cuanto al fósforo, se consideró para el análisis asociativo un valor <3 mg/dL en razón al reporte de Kalantar(15) de más 58 mil pacientes, quien estudió la sobrevida de pacientes con desordenes del calcio, fósforo y paratohormona. Un valor menor de 3 mg/dL ajustado a variables del estado nutricional, se asoció a un hazard ratio (HR) de mortalidad mayor a 1 en pacientes en terapia de hemodiálisis.
Análisis Estadístico
Para la asociación entre las variables continuas de malnutrición con distribución no normal se utilizó el test de Kruskall Wallis y prueba de comparaciones múltiples para los resultados con significancia estadística. Para las variables categóricas se utilizó el chi cuadrado, siendo la variable independiente la VGS y las dependientes la albumina y fósforo. Se realizará la evaluación descriptiva de la prevalencia de cada biomarcador en caso alguno de ellos se encuentre presente en valores normales. Se utilizó el software estadístico SPSS 25.0.
Aspectos éticos
El proyecto de investigación fue presentado tanto al comité de investigación del Hospital Guillermo Almenara como al Instituto de Ciencias Biomédicas de la Universidad Ricardo Palma, donde fue aprobado.
RESULTADOS
Se incluyeron un total de 131 pacientes en hemodiálisis. La media de la edad fue de 60 años (DS=±5,9), 55% eran de sexo masculino (72). El 36,6% tuvo diabetes, el 19.8% hipertensión arterial, el 17,6% no filiada, el 5,3% por glomerulonefritis, el 3,8% por uropatía obstructiva y el resto, menos del 3%, por cada causa. La mediana del tiempo en hemodiálisis fue 4,6 años (DS=±6). Las características y variables analizadas se muestran en la tabla 1 .
Tabla 1. Características descriptivas de los pacientes en hemodiálisis estudiados.
|
Parámetros |
Pacientes (n:131) |
|
Edad (años) |
60 (DS=±15,9) |
|
Tiempo en hemodiálisis |
4,6 (DS=±6) |
|
Albumina (mg/dl) |
3,6 (DS=±0,6) |
|
Fósforo (mg/dl) |
3,9 (DS=±2) |
|
Valoración Global Subjetiva A |
38,2% (50) |
|
Valoración Global Subjetiva B |
48,1% (63) |
|
Valoración Global Subjetiva C |
13,7% (18) |
En cuanto a los biomarcadores, el 34% de pacientes presentó hipoalbuminemia, 41% presentó hipofosfatemia, 27% presentó una hipofosfatemia <3 mg/dL y el 14% presentó una valoración global subjetiva tipo C (Figura 1). Se evidenció que el 52% (68) de los pacientes en hemodiálisis presentaron al menos una alteración (hipoalbuminemia, hipofosfatemia o VGS tipo C). Se analizó la media de calcio de 113 pacientes, pero que sí incluyó a los que tenían hipofosfatemia, siendo de 9,04 mg/dL (DS=±0,84). De los pacientes con hipofosfatemia <3 mg/dL, solo el 5% (2 pacientes) tenían calcio>10 mg/dL.
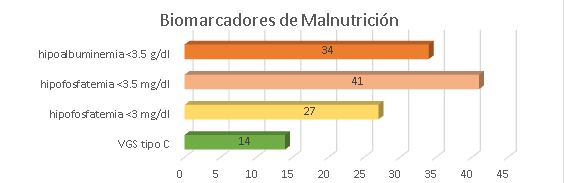
Figura 1. Distribución porcentual de los biomarcadores de malnutrición.
En cuanto al análisis descriptivo y analítico de la valoración global subjetiva con las variables continuas de albúmina y el fósforo, esta tuvo diferencia significativa por Kruskal Wallis como se muestra en la tabla 2, en donde el tiempo en hemodiálisis no estuvo asociado con la VGS. Aquellos pacientes con una valoración global subjetiva tipo C presentaban una media de albumina de 3.1 (DS=±0,74) y una media de fósforo de 2.88 (DS=±1,54).
Tabla 2. Análisis del tiempo (en años) de hemodiálisis, albúmina, y fósforo según niveles de VGS.
|
VGS |
Tiempo HD* |
|
Albúmina |
|
Fósforo |
|
|||
|
Media |
DS |
Valor de p** |
Media |
DS |
Valor de p** |
Media |
DS |
Valor de p** |
|
|
A |
3,95 |
5,79 |
0,635 |
3,90 |
0,48 |
<0,001 |
4,19 |
2,05 |
0,040 |
|
B |
4,32 |
5,45 |
3,60 |
0,48 |
3,94 |
1,91 |
|||
|
C |
7,43 |
8,07 |
3,13 |
0,74 |
2,88 |
1,54 |
|||
Tabla 3. Análisis de la VGS con las categorías de hipoalbuminemia e hipofosfatemia
|
Valoración Global Subjetiva |
Total
|
Valor de p* |
|||
|
A |
B |
C |
|
||
|
Albúmina |
|
|
|
|
|
|
≤ 3,5 mg/dL |
12 (25,5%) |
24 (51,1%) |
11 (23,4%) |
47 |
0,017a |
|
>3.5 mg/dL |
38 (45,2%) |
39 (46,4%) |
7 (8,3%) |
84 |
|
|
Fosfatemia |
A |
B |
C |
|
|
|
<3 mg/dL |
10 (27,8%) |
17 (47,2%) |
9 (25%) |
36 |
0,050b |
|
≥3 mg/dL |
40 (42,1%) |
46 (48,4%) |
9 (9,5%) |
95 |
|
|
Total |
50 (38,2%) |
63 (48,1%) |
18 (13,7%) |
131 |
|
Considerando que la hipoalbuminemia fue la alteración más frecuente, seguida de la hipofosfatemia y luego la VGS tipo C, se describió su frecuencia en el mismo orden, cuando los demás marcadores tenían valores normales. Por ejemplo, cuando había normoalbuminemia, un 30% (n=21) de pacientes presentaba hipofosfatemia y, si había normoalbuminemia y normofosfatemia, un 6% (n=4) tenía una VGS tipo C, como se aprecia en el Figura 2.
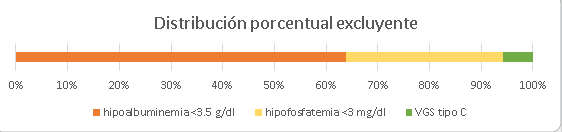
Figura 2. Distribución porcentual de los variables de los pacientes con desnutrición. Se describe el valor de cada marcador de manera excluyente (sin co-asociarse).
DISCUSIÓN
El estado nutricional de los pacientes en terapia de hemodiálisis es un predictor de morbimortalidad por lo que es importante su identificación. Existen factores carenciales sumados al hipercatabolismo que de manera activa y progresiva afectan su condición. La albúmina es un biomarcador ampliamente reconocido y señala un estado carencial energético-proteico que no suple el incremento de la demanda metabólica. Si bien se reconoce por su sensibilidad, es poco especifico, puesto que, la hipoalbuminemia es también reconocido como un reactante de fase aguda negativa, por lo que disminuye en los procesos inflamatorios como sépticos y, por ello, se excluyó esta característica en la muestra. Se utiliza también la pre-albumina como marcador, en razón a su tiempo de vida media corto de 2 a 3 días, en comparación a la albúmina de 20 días por su correlación del estado actual, sin embargo, esta característica es de poca utilidad en la identificación de un proceso activo y crónico en hemodiálisis como la desnutrición(1). La principal dificultad con estos marcadores es su valor predictivo negativo reducido, por lo cual un valor normal no necesariamente excluye la enfermedad. Considerando estos antecedentes, la valoración de malnutrición precisa de biomarcadores complementarios y que sean de uso práctico para poder intervenir precozmente a los pacientes. La selección de hipoalbuminemia ≤3,5 g/dL es importante porque además se asocia al riesgo independiente de mortalidad. Los resultados de este estudio encontraron que fue el biomarcador de desnutrición de mayor prevalencia, encontrándose en el 68% de los pacientes en el contexto de la enfermedad renal crónica en hemodiálisis. En este reporte, el análisis como variable continua tuvo un valor de albumina de 3,1 g/dL en pacientes con VGS tipo C, habiendo sido reportado por Kovesky(14), una asociación como variable continua de 3.6 g/dl de albumina junto a otros biomarcadores de malnutrición (linfocitos y leucocitos) y un valor de 3,2 g/dL al asociarse a tres biomarcadores de malnutrición en pacientes con enfermedad renal crónica.
La hipofosfatemia constituye un biomarcador, referido en la literatura, de menor sensibilidad, puesto que los pacientes en hemodiálisis pueden cursar con hiperfosfatemia, lo que separa a los pacientes en dos grupos, en aquellos que sufren de enfermedad mineral ósea con hiperparatiroidismo e hiperfosfatemia y, que refleja una mayor ingesta proteica y de fosfatos y, por otro lado, aquellos que por el estado carencial proteico cursan con hipofosfatemia. Esto dependerá de la población analizada. En el reporte Dialysis Outcomes and Practice Patterns Study (DOPPS), que analiza pacientes de Estados Unidos, Francia, Alemania, Italia, Japón, España y Reino Unido, la prevalencia de hiperfosfatemia fue del 57,9%(18). En nuestra realidad, en cambio, el reporte nacional(22) de hiperfosfatemia es del 24,2% y la prevalencia de desnutrición en nuestra realidad, nos indica que es un biomarcador a tener en cuenta. Su poca especificidad es otra dificultad, puesto que la hipofosfatemia en hemodiálisis se puede asociar a calcio sérico elevado, que se reporta en el 29,6% de los pacientes en reporte nacional(22) y que puede asociarse a un concentrado de calcio elevado en la solución de diálisis como en el presente estudio, sin embargo, se reportó hipercalcemia solo en el 5% de pacientes con hipofosfatemia. También, la hipofosfatemia puede reducirse por el uso de quelantes de fósforo, pero que normalmente se suspende cuando el paciente presenta hipofosfatemia. Pese a estas consideraciones, en el contexto de una ingesta proteica reducida, se vuelve un biomarcador útil y, además, se asocia a la mortalidad(18). En nuestro reporte, en los pacientes con enfermedad renal crónica la prevalencia de hipofosfatemia fue alta y tuvo asociación con la VGS tipo C. En la práctica clínica, la evaluación de la hipoalbuminemia e hipofosfatemia de manera aislada puede ser malinterpretada y su importancia en malnutrición se establece cuando se identifica parámetros al examen físico de manera subjetiva, tal como se realiza con el test de VGS.
El examen físico y la capacidad funcional, valoradas por medio de la VGS, son características relevantes en la valoración del paciente malnutrido, añadiendo que los pacientes en diálisis tienen una actividad física marcadamente reducida que afecta su trofismo muscular. Se ha reportado que una reducción de la masa muscular y fuerza del paciente en diálisis se asocia con un empeoramiento de la sobrevida en un seguimiento a 5 años con HR 1,93 (95% IC 1,01-3,73)(23). La VGS tipo C, en especial, señala un paciente malnutrido severo, su asociación con los otros biomarcadores es plausible, aunque no necesariamente ocurre si se afecta la sensibilidad de los otros biomarcadores con valores normales(24). Otras herramientas reportadas para valoración del estado nutricional será la bioimpedancia, sin embargo, su dificultad será su valor predictivo positivo, puesto que puede infraestimar la medición del agua extracelular post diálisis hasta en un 30% y, en consecuencia, el cálculo del tejido magro(24). Esta sobreestimación de desnutrición ocurre por el cambio de los electrolitos post diálisis y que puede afectar la estimación de agua extracelular e intracelular; además, su uso no es rutinario y no ha demostrado ser una herramienta indispensable sino complementaria. Los biomarcadores estudiados, por el contrario, permiten una identificación oportuna para una intervención precoz, habiéndose reportado el efecto de la intervención desde la VGS en la reducción de la mortalidad en hemodiálisis(20).
CONCLUSION
La hipoalbuminemia y la hipofosfatemia tuvieron asociación estadísticamente significativa con la VGS tipo C y contribuyen al enfoque de malnutrición sin considerar solo un síndrome carencial.
Contribuciones de autoría: Los autores participaron en la génesis de la idea, diseño de proyecto, recolección e interpretación de datos, análisis de resultados y preparación del manuscrito del presente trabajo de investigación.
Financiamiento: Autofinanciado.
Conflicto de interés: Los autores declaran no tener conflicto de interés en la publicación de este artículo.
Recibido: 01 de mayo 2020
Aprobado: 04 de junio 2020
Correspondencia: Edwin Rolando Castillo Velarde
Dirección: Facultad de Medicina, Universidad Ricardo Palma. Av. Benavides 5440. Santiago de Surco. Lima - Perú
Teléfono: (00511) 3242983
Correo electrónico: edwin.castillo@urp.edu.pe
REFERENCIAS BIBLIOGRÁFICAS
