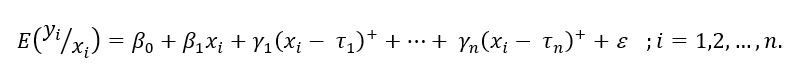ARTÍCULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2021 - Universidad Ricardo PalmaDOI 10.25176/RFMH.v21i1.3592
TENDENCIA DE LA TASA DE MORTALIDAD POR CÁNCER GÁSTRICO EN PERÚ: MODELO DE REGRESIÓN SEGMENTADA DE 1995 A 2013
TREND IN GASTRIC CANCER MORTALITY RATE IN PERU: SEGMENTED REGRESSION MODEL 1995 - 2013
Diego Venegas-Ojeda1, Ysela Dominga Agüero-Palacios2
1 Médico especialista en Oncología. Facultad de Ciencias y Filosofía de la Universidad Peruana Cayetano Heredia, Lima, Perú; Maestría en Bioestadística, Escuela de Postgrado de la Facultad de Ciencias Matemáticas, Universidad Nacional Mayor de San Marcos, Lima, Perú.
2 Magister en Bioestadística. Laboratorio de Series de Tiempo, Facultad de Ciencias Matemáticas, Universidad Nacional Mayor de San Marcos, Lima, Perú.
Objetivo: Analizar las tendencias de la mortalidad por cáncer gástrico en el Perú de 1995 al 2013 y sus diferencias por sexo, grupos etarios, regiones naturales y regiones políticas. Materiales y métodos: Estudio ecológico de series de tiempo realizado sobre la base de 49 690 registros de defunción del Ministerio de Salud, de 1995 al 2013; se calcularon tasas de mortalidad brutas, específicas y estandarizadas por año; según sexo; grupo de edad; regiones política y geográfica, para analizar las tendencias estimando joinpoints y cambios de porcentaje anual (CPA); mediante modelos de regresión segmentada, ajustados utilizando el software Joinpoint Regression Desktop versión 4.5.0.0, Resultados: La tendencia de la tasa de mortalidad estandarizada (TME) por cáncer gástrico en el Perú fue decreciente, bajando de 16,1 x 100 000 hab. en 1995 a 11.4 x 100 000 hab. en el 2013 (CPA: -2,3), observándose tendencias decrecientes por grupos etarios, sexo y en 17 de 25 regiones políticas. Se encontraron diferencias al comparar por subgrupos: un decremento más acelerado en mujeres (CPA -2,5) versus hombres (-2,0) y en grupos etarios (CPA para 75 - 79 años: -2,57 versus CPA para 40 – 44: -1,39); se identificaron tres zonas geográficas con elevada mortalidad: Andes centrales (Huancavelica, Huánuco, Ayacucho, Pasco y Junín), zona norte (Lambayeque, La Libertad y Cajamarca) y costa central (Ica, Callao, Ancash y Lima), además se observaron tendencias crecientes en Huancavelica, Ayacucho y Pasco. En la Costa la mortalidad decrece desde el año 1998; sin embargo, en la Sierra y Selva decrece significativamente a partir del 2009. Conclusiones: La tendencia de la TME por cáncer de estómago en el Perú es decreciente y estadísticamente significativa para el período de 1995 – 2013 (-2,3% anual). Los departamentos con tendencia creciente de la mortalidad son Huancavelica, Ayacucho y Pasco. Se observa mayor reducción de la TME en mujeres en comparación con los hombres.
Palabras Clave: Tendencias, tasa de mortalidad, modelo de regresión segmentada, análisis de regresión, cáncer gástrico, Perú. (fuente: DeCS BIREME).
ABSTRACT
Objective: To analyze the trends in gastric cancer mortality in Peru from 1995 to 2013 and their differences by sex, age groups, natural regions and political regions. Materials and methods: Ecological time-series study based on 49,690 death records from the Ministry of Health, from 1995 to 2013; Crude, specific and standardized mortality rates (SMR) were calculated by year; according to sex; age group; political and geographic regions, to analyze trends by estimating joinpoints and annual percentage changes (CPA); using segmented regression models, adjusted using Joinpoint Regression Desktop software version 4.5.0.0, Results: The SMR trend due to gastric cancer in Peru was decreasing, falling from 16.1 x 100 000 inhabitants. in 1995 to 11.4 x 100 000 inhabitants. in 2013 (CPA: -2.3), observing decreasing trends by age groups, sex and in 17 of 25 political regions. Differences were found when comparing by subgroups: a more accelerated decrease in women (CPA -2.5) versus men (-2.0) and in age groups (CPA for 75 - 79 years: -2.57 versus CPA for 40 - 44: -1.39); Three geographical areas with high mortality were identified: central Andes (Huancavelica, Huánuco, Ayacucho, Pasco and Junín), northern area (Lambayeque, La Libertad and Cajamarca) and central coast (Ica, Callao, Ancash and Lima), in addition trends were observed growing in Huancavelica, Ayacucho and Pasco. On the coast, mortality has decreased since 1998; however, in the Sierra and Selva it decreases significantly as of 2009. Conclusions: The trend of SMR due to gastric cancer in Peru is decreasing and statistically significant for the period 1995 - 2013 (-2.3% per year). The departments with an increasing trend in mortality are Huancavelica, Ayacucho and Pasco. Greater reduction in SMR is observed in women compared to men.
Keywords: Trends, mortality rate, regression analysis, gastric cancer, Peru. (fuente: MeSH NLM).
A nivel mundial, la incidencia y mortalidad de cáncer gástrico se han reducido drásticamente en los últimos 70 años1,2,3. A pesar de ello, es el quinto cáncer más común y la tercera causa de muerte por cáncer. De acuerdo con la Agencia Internacional para la Investigación del Cáncer (IARC) en 2018 se presentaron 1 033 701 casos nuevos de cáncer gástrico (tasa de incidencia 11,1 x 100 000hab.) y 782,685 defunciones por esta enfermedad (tasa de mortalidad de 8,2 x 100 000 hab.)4,5. Aproximadamente 3 de cada 4 casos nuevos y muertes por cáncer gástrico se presentan en países en desarrollo.6.
En el Perú el cáncer ocupa el segundo lugar en mortalidad desde la década de los 907 y la incidencia de cáncer gástrico es de 16,1 x 100 000 hab., una de las más altas del mundo, superado por países asiáticos como Corea del Sur (39,6), Mongolia (33,1), Japón (27,5), China (20,7), Bután (19,4) Kirguistán (18,6) y otros países como Chile (17,8) y Bielorrusia (16,5)4. Además, en el Perú la tasa de incidencia es similar a la tasa de mortalidad, debido a la pobre sobrevida de los pacientes cuando son diagnosticados.8
Las variaciones regionales reflejan diferencias en los hábitos alimentarios, el almacenamiento de alimentos y la disponibilidad de productos frescos, así como la prevalencia de la infección por Helicobacter pylori.9,10 La infección crónica por H. pylori es el factor de riesgo identificado más fuerte para el cáncer de estómago.11
Existen publicaciones que muestran de manera descriptiva una tendencia decreciente en la mortalidad de cáncer gástrico en el Perú aunque en un lapso más corto de tiempo como 10 años (2005 al 2014)12 y 8 años (2008-2015)13 mostrando una reducción en la tasa estandarizada. Existen diferencias al interior del Perú respecto a la mortalidad por cáncer gástrico, las mayores tasas se encuentran en la sierra central y en la costa; las regiones políticas con mayor tasa de mortalidad son Huánuco, Huancavelica y Junín14, que también son regiones con indicadores de pobreza más altos, menos acceso a servicios de salud, menos disponibilidad de agua potable15, en los ámbitos rurales la población drena sus deshechos en el río local y esta agua suele ser la misma que se trata para consumo humano, encontrando baja concentración de cloro; todos estos factores favorecen la diseminación de la infección por H. pylori.8. Aunque también le siguen regiones más urbanizadas como La Libertad y Callao12
El cáncer es una enfermedad de alto costo e impacto social en la población e implica un mayor despliegue de recursos económicos, humanos y de tecnologías que deben ser provistas por los gestores de salud de una manera óptima. Hasta el momento, los reportes de tendencias de las tasas de mortalidad han sido descriptivos, han utilizado análisis de tendencias no paramétricos o utilizando modelos log lineales, por ello la importancia de mejorar el conocimiento epidemiológico al realizar el análisis de las tendencias bajo un modelo de regresión segmentada en períodos largos de tiempo (19 años), de esta manera al estimar puntos de cambio o joinpoints se puede hipotetizar la influencia de variables que se modifican en el tiempo, ya sea por una intervención planificada o fenómenos no intencionales que alteran el entorno.16,17
El objetivo de la presente investigación fue analizar las tendencias de la mortalidad por cáncer gástrico en el Perú aplicando los modelos de regresión segmentada, durante el periodo 1995 – 2013 y sus diferencias por grupos etarios, sexo, región política y región geográfica.
MATERIALES Y MÉTODOS
Tipo de estudio: Se realizó un estudio ecológico de series de tiempo a partir de las tasas estandarizadas de mortalidad por cáncer de estómago.
Población y muestra: La población fue el conjunto de todas las ejecuciones del proceso estocástico (ensemble) constituido por las tasas de defunción anuales estandarizadas por cáncer gástrico en el Perú, durante el periodo 1995 - 2013, la unidad de análisis fue la población del país en cada periodo). La muestra estuvo conformada por las tasas de defunción anuales estandarizadas del periodo mencionado.
Aspectos éticos: Los datos utilizados para la presente investigación son de fuente secundaria y fueron proporcionados de manera anónima por la Oficina General de Estadística e Informática del Ministerio de Salud.18
Recolección y procesamiento de datos: Se seleccionaron los registros con causa básica de muerte codificadas según la Clasificación Internacional de Enfermedades (CIE), utilizando el código C152 de la novena versión (CIE-9) desde 1995 a 1999 y el código C16 de la décima versión (CIE-10), del año 2000 en adelante. El 97.9% de los registros fueron llenados por profesionales de la salud.
La población anual país se obtuvo de las proyecciones censales del Instituto Nacional de Estadística e Informática19, con estos datos se calcularon las tasas brutas y específicas expresada x 100 000 hab. Por sexo, grupos quinquenales de edad (excepto menores de 40 años y de 80 a más años) y regiones geográfica y política. Para calcular las tasas estandarizadas por edad se utilizó como población de referencia la estimada por la Organización Mundial de la Salud- OMS.20
Análisis estadístico: La tendencia temporal de las tasas de mortalidad estandarizadas se analizó mediante un modelo de regresión segmentada, se incorporaron como variables independientes el sexo, la edad, las regiones de procedencia políticas (departamentos) y geográficas (costa, sierra y selva), considerando la pertenencia de la mayoría de la población de una región política a determinada región geográfica.
Para identificar los períodos entre los años 1995 y 2013 en que se produjeron cambios significativos en la tasa de mortalidad estandarizada, se ajustó un modelo de regresión segmentada joinpoint. de la forma:
El modelo se ajustó bajo la hipótesis de la existencia de una evolución lineal del logaritmo natural de las tasas de mortalidad estandarizadas esperadas y errores incorrelacionados.
Para ubicar los joinpoints se seleccionó el método “Grid search” considerando entre 0 y 3 joinpoints. Como medida de resumen se empleó el cambio porcentual anual (CPA) y el Cambio Porcentual Anual Promedio (CPAP).
La evaluación de la bondad del ajuste del modelo y la significancia de los cambios en la tendencia se realizó mediante el Criterio de información bayesiano (BIC) clásico y la prueba paramétrica t de Student para un nivel de significación de 5%.
Para realizar el ajuste del modelo se utilizó el Software Joinpoint Desktop de la versión 4.5.0.0 (Division of Cancer Control and Population Sciences, National Cancer Institute)21
Se elaboró un mapa a partir de las tasas de mortalidad estandarizadas (TME) por cáncer gástrico en el Perú para el año 2013 con las tasas estimadas mediante el modelo de regresión segmentada ajustado y se ordenaron de mayor a menor en 4 grupos tomando como referencia la tasa de mortalidad estandarizada nacional (TMEN) de 11,9 x 100 000 hab.
- - Muy alta: cuando la TME > 150% TMEN,
- - Alta: cuando la TME: 100 - 150% TMEN,
- - Mediana: cuando la TME: 50- 100% TMEN,
- - Baja: cuando la TME< 50% TMEN.
El mapa elaborado a partir de la TMEN suaviza las tasas de mortalidad estandarizadas y permite identificar mejor los territorios vulnerables.
RESULTADOS
Se analizó un total de 49 690 registros de defunción con causa básica de muerte de cáncer gástrico en Perú en el período 1995 – 2013; para el año 1995 la tasa de mortalidad estandarizada era de 16,1 x 100 000 hab. y para el año 2013 decrece a 11,4 x 100 000 hab., observando una tendencia decreciente estadísticamente significativa (p<0,05) y sin puntos de cambio o joinpoints, con una reducción de 2,3% anual (ver Tabla 1).
Tabla 1. Tendencias de las TMEE por cáncer gástrico por sexo en el Perú 1995 – 2013. Análisis de regresión segmentada.
|
Grupo |
TMEE ( x 100 000 hab.) |
CPA |
CPA |
Tendencia |
Periodo |
||
|
|
INICIAL |
FINAL |
|
IC 95% |
Test t |
Valor p |
|
|
Hombres |
18,22 |
20,79 |
6.8 |
[-8,4; 24,6] |
1 |
0.355 |
1995-1997 |
|
20,79 |
14,82 |
-5.1* |
[-8,1; -1,9] |
-3.7 |
0.002 |
1997-2003 |
|
|
14,82 |
16,25 |
0.2 |
[-2,1; 2,5] |
0.2 |
0.851 |
2003-2010 |
|
|
16,25 |
13,25 |
-6.2 |
[-12,2; 0,3] |
-2.2 |
0.1 |
2010-2013 |
|
|
Mujeres |
0,41 |
0,32 |
-2.5* |
[-3,1;-1,9] |
-8.3 |
< 0,001 |
1995-2013 |
|
Total |
16,09 |
11,41 |
-2,3* |
[-2,8; -1,8] |
-8,9 |
< 0,001 |
1995-2013 |
TMEE: Tasa de mortalidad estandarizada por edad, estimada en el modelo
CPA: Cambio de porcentaje anual
*Tendencia estadísticamente significativa
Tendencias de mortalidad estandarizada por sexo
En hombres la tendencia de la mortalidad estandarizada fue cambiante: el modelo de regresión segmentada óptimo mostró 3 joinpoints (BIC:1,72) los cuales ocurren en: 〖〖〖(x〗_i-τ〗_k)〗^+=3 ; τ_1=1997, τ_2=2003 y 〖 τ〗_3=2010; y determinan 4 segmentos: a) período 1995–1997: tendencia creciente (CPA 6,8%), no estadísticamente significativa b) periodo 1997-2003, tendencia decreciente (CPA -5,1%), estadísticamente significativa (valor p<0,05), c) periodo 2003-2010, tendencia levemente creciente (CPA 0,2%) y no estadísticamente significativa y d) período 2010-2013, tendencia decreciente (CPA -6,2%), pero no estadísticamente significativa (ver Tabla 1, figura 1).

Figura 1. Tendencia de la mortalidad por cáncer gástrico comparativo por sexo en el Perú 1995- 2013, modelos de regresión segmentada.
El modelo de regresión segmentada óptimo para la tendencia de mortalidad estandarizada en mujeres fue decreciente y estadísticamente significativo, con una disminución de 2,5% anual y no contiene joinpoints (BIC=2,05). No se observa paralelismo entre hombres y mujeres (valor p =0,05). (Ver figura 1).
Tendencias de mortalidad estandarizada por grupos etarios
Cuando se compara las tendencias de mortalidad estandarizadas según grupos etarios se observa una tendencia decreciente y estadísticamente significativa, detectándose 3 joinpoints; para el grupo de 60 a 64 años en los años 1997, 2007 y 2010 y otros tres; para el grupo de 65 a 69 años en los años 1997, 2003 y 2009. Se observa también que, el CPA decrece a medida que se incrementa el grupo de edad; por ejemplo, para el grupo de 40 – 44 años fue de -1,39% anual, mientras que para el grupo de edad de 75 a 79 años fue de – 2,57% anual (ver Tabla 2).
Tabla 2. Tendencias de las TMEE por cáncer gástrico por grupos de edad en el Perú 1995 – 2013. Análisis de regresión segmentada.
|
Grupo etario |
TMEE ( x 100 000 hab.) |
CPA |
CPA |
Periodo |
|
|
|
Inicial |
Final |
|
IC 95% |
|
|
< 40 años |
0,61 |
0,42 |
-2,07* |
[-3,1 -1,0] |
1995-2013 |
|
40 - 44 años |
0,41 |
0,32 |
-1,39* |
[-2,3-0,4] |
1995-2013 |
|
45 - 49 años |
0,62 |
0,43 |
-2,00* |
[-2,9-1,1] |
1995-2013 |
|
50 - 54 años |
0,94 |
0,65 |
-2,06* |
[-3,0-1,1] |
1995-2013 |
|
55 - 59 años |
1,22 |
0,82 |
-2,19* |
[-2,8-1,6] |
1995-2013 |
|
60 - 64 años |
1,47 |
1,71 |
8,9 |
[-17,2-43,2] |
1995-1997 |
|
1,71 |
1,15 |
-3,7* |
[-6,0-1,4] |
1997-2007 |
|
|
1,15 |
1,41 |
5,1 |
[-18,5-35,6] |
2007-2010 |
|
|
1,41 |
0,89 |
-13,1* |
[-24,1-0,4] |
2010-2013 |
|
|
65 - 69 años |
1,88 |
2,45 |
13,98 |
[ 1,3- 0,2] |
1995-1997 |
|
2,45 |
1,52 |
-7,60* |
[-3,6-0,0] |
1997-2003 |
|
|
1,52 |
1,72 |
2,01 |
[ 0,9- 0,4] |
2003-2009 |
|
|
1,72 |
1,26 |
-7,45* |
[-2,6- 0,0] |
2009-2013 |
|
|
70 - 74 años |
2,52 |
1,63 |
-2,39* |
[-3,1-1,7] |
1995-2013 |
|
75 - 79 años |
2,67 |
1,67 |
-2,57* |
[-3,3-1,9] |
1995-2013 |
|
> 80 años |
4,98 |
3,72 |
-1,60* |
[-2,2-1,0] |
1995-2013 |
|
Total |
18,06 |
11,88 |
-2,3* |
[-2,8 -1,8] |
1995-2013 |
TMEE: Tasa de mortalidad estandarizada por edad, estimada en el modelo
CPA: Cambio de porcentaje anual
*Tendencia estadísticamente significativa
Tasas de mortalidad estandarizada por regiones
La mayor mortalidad por cáncer gástrico en el 2013 se concentra en los andes centrales, donde las regiones de Huancavelica (3,5 veces la TMEN), Huánuco (2,5 veces la TMEN), Ayacucho y Pasco tienen la más alta mortalidad y Junín encabeza las regiones de alta mortalidad. Además, se identifican otras 2 zonas de alta mortalidad: la primera en el norte del país (Lambayeque, La Libertad y Cajamarca) y la segunda en la costa central (Ica, Callao, Ancash) (ver Tabla 3, Figura 2).
Tabla 3. Tendencias de las tasas de mortalidad estandarizada por cáncer gástrico por regiones políticas en el Perú 1995 – 2013. Análisis de regresión segmentada.
|
Región |
TMEE ( x 100 000 hab.) |
CPA |
CPA |
Periodo |
CPAP |
|
|
|
Inicial |
Final |
|
IC 95% |
|
|
|
Amazonas |
10,85 |
21,74 |
8,0* |
[ 0,0, 16,7] |
1995-2004 |
-0,9 |
|
21,74 |
5,47 |
-29,2 |
[-54,3, 9,7] |
2004-2008 |
||
|
5,47 |
9,22 |
11 |
[-10,4, 37,4] |
2008-2013 |
||
|
Ancash |
15,4 |
11,98 |
-1,4 |
[-3,8, -1,1] |
1995-2013 |
-1,4 |
|
Apurímac |
7,72 |
17,24 |
9,3 |
[-1,5, 21,3] |
1995-2004 |
0,6 |
|
17,24 |
8,64 |
-7,4 |
[-16,1, 2,3] |
2004-2013 |
||
|
Arequipa |
12,38 |
8,74 |
-4,8 |
[-10,1, 0,7] |
1995-2002 |
-3,8 |
|
8,74 |
11,35 |
5,4 |
[-7,9, 20,5] |
2002-2007 |
||
|
11,35 |
6,16 |
-9,7* |
[-15,4, -3,5] |
2007-2013 |
||
|
Ayacucho |
10,17 |
19,74 |
3,8* |
[1,3, -6,3] |
1995-2013 |
3,8* |
|
Cajamarca |
15,43 |
22,06 |
4,1 |
[-1,6, 10,0] |
1995-2004 |
-1,7 |
|
22,06 |
12,12 |
-7,2* |
[-11,9, -2,3] |
2004-2013 |
||
|
Callao |
18,05 |
12,46 |
-2,0* |
[-3,5, -0,6] |
1995-2013 |
-2,0* |
|
Cusco |
14,42 |
5,97 |
-4,8 |
[-7,1, -2,4] |
1995-2013 |
-4,8 |
|
Huancavelica |
7,91 |
37,26 |
24,8* |
[9,8, 41,8] |
1995-2002 |
9,7* |
|
37,26 |
41,65 |
1 |
[-3,1, 5,3] |
2002-2013 |
||
|
Huánuco |
33,13 |
44,37 |
2,5 |
[-0,6, 5,6] |
1995-2007 |
-0,7 |
|
44,37 |
29,35 |
-6,7 |
[-13,4,0,7] |
2007-2013 |
||
|
Ica |
22,09 |
13,88 |
-2,6* |
[-4,0, -1,0] |
1995-2013 |
-2,6* |
|
Junín |
24,19 |
29,05 |
3,7 |
[-7,9, 16,9] |
1995-2000 |
-2,9 |
|
29,05 |
18,43 |
-8,7 |
[-22,5,7,6] |
2000-2005 |
||
|
18,43 |
27,73 |
8,5 |
[-6,7,26,2] |
2005-2010 |
||
|
27,73 |
14,21 |
-20 |
[-38,2,3,6] |
2010-2013 |
||
|
La Libertad |
18,41 |
23,13 |
7,9 |
[-9,1, 28,0] |
1995-1998 |
-1,6 |
|
23,13 |
13,8 |
-3,4* |
[-4,6,-2,2] |
1998-2013 |
||
|
Lambayeque |
16,04 |
18,57 |
5 |
[-27,4, 51,9] |
1995-1998 |
-0,7 |
|
18,57 |
2,92 |
-18,6* |
[-26,8,-9,5] |
1998-2007 |
||
|
2,92 |
13,17 |
65,1 |
[-44,8,393,9] |
2007-2010 |
||
|
13,17 |
14,18 |
2,5 |
[-23,7,37,7] |
2010-2013 |
||
|
Lima |
21,54 |
12,96 |
-4,1* |
[-5,5, -2,7] |
1995-2007 |
-3,3 |
|
12,96 |
15,29 |
5,7 |
[-15,2,31,7] |
2007-2010 |
||
|
15,29 |
11,81 |
-8,2 |
[-17,7,2,3] |
2010-2013 |
||
|
Loreto |
13,77 |
3,28 |
-7,7* |
[-10,7, -4,5] |
1995-2013 |
-7,7* |
|
Madre de Dios |
23,22 |
7,84 |
-5,9* |
[-11,5, 0,1] |
1995-2013 |
-5,9* |
|
Moquegua |
15,35 |
5,69 |
-5,4* |
[-8,4, -2,3] |
1995-2013 |
-5,4* |
|
Pasco |
24,55 |
53,97 |
48,3 |
[-17,3,165,8] |
1995-1997 |
-1,3 |
|
53,97 |
26,43 |
-21,2 |
[-55,6,39,9] |
1997-2000 |
||
|
26,43 |
19,23 |
-2,4 |
[-5,3,0,5] |
2000-2013 |
||
|
Piura |
14,87 |
19,32 |
14 |
[-31,7,90,1] |
1995-1997 |
-3,3 |
|
19,32 |
7,26 |
-17,8* |
[-31,9,-0,8] |
1997-2002 |
||
|
7,26 |
8,09 |
1 |
[-2,8,5,0] |
2002-2013 |
||
|
Puno |
10,2 |
4,96 |
-3,9* |
[-5,7, -2,1] |
1995-2013 |
-3,9* |
|
San Martín |
17,46 |
16,81 |
-0,3 |
[-3,3,2,7] |
1995-2006 |
-3,4* |
|
16,81 |
9,42 |
-7,9 |
[-13,0,-2,6] |
2006-2013 |
||
|
Tacna |
10,61 |
11,19 |
0,4 |
[-2,9,3,8] |
1995-2009 |
-4,9 |
|
11,19 |
4,29 |
-21,3 |
[-39,1,1,8] |
2009-2013 |
||
|
Tumbes |
18,45 |
10 |
-3,4* |
[-6,3, -0,3] |
1995-2013 |
-3,4* |
|
Ucayali |
18,22 |
21,84 |
1,3 |
[-2,1, 4,8] |
1995-2009 |
-5,4* |
|
21,84 |
6,73 |
-25,51 |
[-41,2, 5,7] |
2009-2013 |
||
|
Total |
18,06 |
11,88 |
-2,3* |
[-2,8, -1,8] |
1995-2013 |
-2,3* |
TMEE: Tasa de mortalidad estandarizada por edad, estimada en el modelo
CPA: Cambio de porcentaje anual
CPAP: Cambio de porcentaje anual promedio
*Tendencia estadísticamente significativa

Figura 2. Mapa de las tasas de mortalidad estandarizada por cáncer gástrico en el Perú estimadas por el modelo de regresión segmentada para el año 2013.
Tendencias de Mortalidad estandarizada por regiones políticas: Utilizando la interpretación del cambio de porcentaje anual propuesto por SERGAS22 se clasificaron las regiones por su tendencia de mortalidad estandarizada estimada (mediante el modelo de regresión segmentada ajustado) como creciente (CPA ≥1,5%), levemente creciente (0,5% ≤ CPA <1,5%), estable (0,5%< CPA < 0,5%), levemente decreciente (-1,5% < CPA ≤ -0,5%) y decreciente (CPA ≤ -1,5%), para el caso de las regiones donde no se encontraron joinpoint(s) se trabajó con el valor del CPA y para las regiones que tuvieron uno o más joinpoint se trabajó con el Cambio Porcentual Anual Promedio (CPAP).
En el mapa se observa una tendencia creciente en 2 de 25 regiones que son Huancavelica y Ayacucho (CPA:9,7% y 3,8% respectivamente); en la región Apurímac se observa una tendencia levemente creciente (CPA:0,6%); en 5 regiones la tendencia es levemente decreciente: Huánuco (CPA:-0,7%), Lambayeque (CPA:-0,7%), Amazonas (CPA:-0,9%), Pasco (CPA:-1,3%) y Ancash (CPA:-1,4%); en el resto de las 17 de 25 regiones se observa una tendencia decreciente (CPA≤1,5%) (ver Tabla 3, Figura 3).

Figura 3. Mapa de las tendencias de las tasas de mortalidad estandarizadas por cáncer gástrico en el Perú 1995-2013.
En la Tabla 3 se muestran los resultados del ajuste del modelo de regresión segmentada con las tasas de mortalidad estandarizadas estimadas al inicio y al final de cada periodo de tiempo determinado por los joinpoint(s); se presentan los CPA por cada segmento de tiempo estimado por el modelo y para el período completo (CPAP). Se encuentran joinpoint(s) para la tendencia de la mortalidad estandarizadas por cáncer gástrico en el periodo 1995 al 2013 en 15 de las 25 regiones.
Tendencias de Mortalidad estandarizada por regiones naturales
Se observa que la Costa tiene una tendencia creciente hasta 1998 (CPA:1%); luego decreciente hasta el 2003 (CPA: -6,4%) y luego levemente decreciente (CPA: -0,9%). La Sierra muestra una tendencia creciente hasta 1997 (CPA:12,9%); luego se mantiene estacionaria hasta el año 2009 (CPA:0%) en que decrece (CPA: -8,3%). La Selva tiene una tendencia decreciente hasta el año 2009 (CPA: -2,5%) en que se hace más marcada (CPA: -12%).
En el año 1996, la sierra pasa del tercer al segundo lugar y desde el año 1999 ocupa el primer lugar en mortalidad por cáncer gástrico; la costa que ocupaba el primer lugar, desde el año 1999 ocupa el segundo lugar y la selva desde el año 1996 ocupa el tercer lugar .
DISCUSIÓN
Para el año 2012 la tasa estandarizada de mortalidad por cáncer gástrico en países desarrollados era de 9,2 x 100 000 hab. y para países en desarrollo es de 14,4 x 100 000 hab.6. El Perú experimenta en los últimos años una reducción del 2,3% anual, que lo acerca bajo el modelo estudiado a los países desarrollados (11,6 x 100 000 hab.), ocupando en la región de Las Américas el 6° lugar, superado por Guatemala, Ecuador, Honduras, Chile y El Salvador.23
Una investigación de las tasas estandarizadas de mortalidad por cáncer gástrico en el Perú del 2005 al 2014 realizada por Hernández-Vásquez y col., muestra una reducción de 15,49 a 12,13 x 100 000 hab.12. La desventaja de este análisis gráfico es la insuficiencia para estudiar la evolución temporal de series numéricas ya que no permite caracterizar el fenómeno por las distorsiones que presentan los datos anualizados, lo cual es eliminado al utilizar modelos lineales generalizados que permiten realizar un análisis más objetivo. En una serie más larga de 1986 a 2015 sobre la mortalidad de cáncer gástrico en el Perú se muestra una reducción de 40%, con una tasa constante de 2% anual24; sin embargo, esta tendencia fue calculada ajustando modelos log-lineales con distribución Poisson, en estos modelos se utiliza una función enlace canónico y los datos se trabajan agregados, estratificados por grupos etarios y año de defunción. A diferencia de estos estudios nuestro trabajo analiza el logaritmo de las tasas estandarizadas utilizando modelos de regresión lineal por segmentos que tienen la ventaja de realizar un estudio estratificado por subgrupos e identificar cambios bruscos en la tendencia. A diferencia de otros estudios de tendencias realizados en Perú12,13; el modelo de regresión segmentada utilizado en el presente estudio permitió identificar el momento en que se producen cambios significativos en la tendencia observada.
En Latinoamérica, se observa una tendencia decreciente de la mortalidad por cáncer gástrico25, en el Perú esta tendencia decreciente se asemeja a las tendencias observadas en países asiáticos o de Europa oriental26. Se ha documentado también tendencias decrecientes de la mortalidad por cáncer de estómago en regiones con tasas históricamente altas, incluyendo países de Asia (Japón, China y Corea)3, América Latina25 y Europa (Ucrania)3. Los factores que han contribuido a este descenso se atribuyen al aumento de la disponibilidad de productos frescos frutas y verduras, menor dependencia de conservas a la salinidad, y la reducción de la infección crónica por H. pylori debido a un mejor saneamiento y antibióticos10.
En el Perú, la disminución de la mortalidad por este cáncer, según diversos autores, podrían atribuirse a mejoras en las condiciones de vida de la población tales como, el uso de agua segura, disposición de un adecuado saneamiento o sistema de alcantarillado y la refrigeración de alimentos15 que contribuyen a disminuir la transmisibilidad del Helicobacter pylori, más que por los progresos médicos destinados a tratar los casos de cáncer gástrico, puesto que existe una enorme brecha de servicios oncológicos en el país8.
Desde el año 2001, Kaneko y Yoshimura postulan que la disminución en la incidencia de cáncer gástrico de tipo intestinal es el factor que más contribuye a la disminución de la incidencia de cáncer gástrico en todo el mundo27; aunque, Henson y col (2004), señalan que la incidencia de carcinoma gástrico tipo difuso, en particular el tipo de anillo de sello, ha ido en aumento28.
La infección crónica por H. pylori es el factor de riesgo identificado con mayor fuerza de asociación para cáncer de estómago, con aproximadamente el 90% de casos nuevos de cáncer gástrico no cardias en todo el mundo11. Ramirez Ramos y col. (2003) realizaron un estudio de la variación de la prevalencia de infección por H. pylori en el Perú entre los años 1985 y 2002, tomando como referencia la población de una clínica de Lima Metropolitana a la que consideran de nivel socioeconómico medio y alto; encontraron en 1 260 pacientes con gastritis crónica activa una prevalencia de H. pylori que disminuyó de 83,3% a 58,7% (valor p <0,001), siendo más significativa en menores de 30 años; en 178 pacientes con úlcera duodenal disminuyó de 89,5% a 71,9% (valor p=0,004); pero no hubo diferencias estadísticamente signficativas en pacientes con úlcera gástrica o mucosa normal.29. En general, se observa una disminución de la prevalencia de H. pylori en los diferentes estudios peruanos realizados30.
El 52,1% de las defunciones por cáncer gástrico en el Perú; se presentaron en hombres, lo cual es inferior a lo reportado a nivel mundial. Para el año 2012 se estimó que el 64,9% de defunciones por cáncer gástrico se presentaron en hombres y en países pobres fue 66,1%.6. Un estudio reciente acerca de la tendencia de mortalidad por cáncer gástrico en el Perú del 2003 al 2016, que utiliza la prueba no paramétrica clásica de tendencia Mann-Kendall para comprobar si existe una tendencia en las series de tiempo muestra una disminución en la proporción de muertes atribuidas a cáncer gástrico en mayores de 50 años estadísticamente significativa para hombres de 25,7% a 21,8% y para mujeres de 24,4% a 16,44%.31. Otro estudio analizó el tipo histológico de 3568 pacientes con cáncer gástrico registrados en el Sistema Nacional de Vigilancia Epidemiológica del cáncer del Ministerio de Salud entre los años 2009-2010 y se encuentra un 43,2% de tipo no especificado, 33,6% de tipo intestinal (el más relacionado a Helicobácter pylori) y 18,7% de tipo difuso. Se observa una mayor prevalencia del tipo difuso en mujeres 21,6% versus 16% en hombres, y en general un porcentaje más elevado respecto a lo reportado en la literatura, lo que podría explicar porque el cáncer gástrico en el Perú se presenta en una relación casi 1:1 de hombres con mujeres.14
El presente estudio encuentra un incremento de la tasa de mortalidad por cáncer gástrico ajustado por grupo de edad conforme este aumenta (ver Tabla 1), tal como se reporta en la literatura. En el segmento de edad de 40-44 años para la región de las Américas en el año 2012 la tasa era de 3,9 x 100 000 hab. y se incrementa a 64,9 x 100 000 hab. para el grupo de edad de 70-74 años.23
La mayor mortalidad por cáncer gástrico en el Perú; se concentra en los andes centrales, este escenario está constituido por las regiones de Huancavelica, Huánuco, Ayacucho, Pasco y Junín. El segundo escenario de alta mortalidad se encuentra en el norte del país (Lambayeque, La Libertad y Cajamarca), el tercero en la costa central (Ica, Callao, Ancash y Lima) (ver Fihura 2). Piñeros y col (2017) también habían observado este patrón que evidenciaría una correlación positiva entre la altitud y el cáncer gástrico; sin embargo, se ha sugerido que la altitud es un sustituto de factores que podrían agruparse en regiones montañosas; por ejemplo, factores genéticos, bacterianos, dietéticos y ambientales del huésped32. Los estudios locales en Lima informaron una asociación positiva entre la ascendencia étnica y el cáncer de estómago, y un papel predominante para los factores socioeconómicos asociados a la etnia y las disparidades en el acceso a los servicios de salud33.
En el informe del Programa de las Naciones Unidad para el Desarrollo (2013) el Perú alcanzó un IDH de 0,74 y las regiones con más bajo IDH fueron Huancavelica con 0,297; luego Ayacucho con 0,334, Apurímac con 0,344 y Huánuco con 0,37434. Este hallazgo postula la hipótesis que serían las condiciones de pobreza, educación y saneamiento deficientes las que contribuyen a una mayor mortalidad por cáncer gástrico posiblemente debido a una mayor transmisibilidad y cronicidad de la infección por H. pylori; asi como, un menor acceso a los servicios de salud; Bray también lo señala en la publicación de las tendencias globales de cáncer para el periodo 2008-203035.
Respecto al nivel socioecnómico Ramírez Ramos y col (2006) señalan luego de revisar estudios en diversos centros de atención para pacientes de nivel socioeconómico medio y alto que existe una importante disminución de la prevalencia de la infección por H. Pylori (45%) comparado con el 80% observado hace una década29.
Uno de los factores más importantes para la tendencia decreciente de mortalidad por cáncer gástrico en el Perú podría ser la mejora sustantiva en las condiciones de vida que reduce la transmisibilidad de la infección por helicobácter pylori: a) entre los años 2001 al 2014 se incrementó el porcentaje de hogares rurales con agua potable en su vivienda de 35,1 a 61,8%.15, b) Se documenta una reducción de 12,4 puntos porcentuales en el número de viviendas con una mala disposición de excretas del año 2001 al año 2014, siendo más sustantivo a nivel rural donde se redujo de manera significativa de 49,8 a 24%15.
Sin embargo, en el período de 1995 al 2015, a nivel rural la tasa estandarizada de mortalidad reportada por el Ministero de Salud del Perú se incrementó de 18,4 x 100 000 hab. a 30,9 x 100 000 hab.; mientras que en el ámbito urbano se redujo de 32,3 x 100 000 hab. a 17,7 x 100 000 hab.24. Esta migración de la mortalidad por cancer gastrico podria deberse a problemas de acceso oportuno a los servicios de salud, ya que los centros de tratamiento de cáncer todos se encuentran en el ámbito urbano; al igual que el acceso al diagnostico por endoscopía a pesar que no esta muy extendido, se realiza casi integramente en el ámbito urbano.8 En concordancia con lo reportado por Pereira y col., que señalaban que el ámbito rural engloba factores socioeconómicos asociados a la etnia y las disparidades en el acceso a los servicios de salud33.
En el presente estudio tambien se observa cambios en las tendencias de mortalidad por cáncer gástrico por regiones naturales que van en concordancia con la ruralidad, puesto que la sierra y selva concentran las regiones con mas alta ruralidad respecto a al costa; y esto explica porque en el año 1995 la Costa tenía la mas alta mortalidad y al 2013 es la Sierra la de mayor mortalidad, es importante plantear estudios sociosanitarios dirigidos para probar la hipótesis respecto a si la menor migración de los pobladores de las zonas rurales de la sierra, condiciones genéticas, ambientales e inequidades en el acceso a servicios de salud explican la mayor mortalidad por cáncer gástrico.
LIMITACIONES DEL ESTUDIO
Una de las principales limitaciones del estudio es el subregistro de la base de datos de defunciones de hechos vitales del Ministerio de Salud. Otra limitación es el período analizado de 1995 al 2013, es posible que en los años sucesivos existan cambios en las tendencias; pero se requiere un tiempo de varios años para tener los datos finales consistentes y para que puedan ser incorporados en el modelo de regresión segmentada.
CONCLUSIÓN
La tendencia de la mortalidad por cáncer de estómago en el Perú es decreciente y estadísticamente significativa para el período de 1995 – 2013 (-2,3% anual), se observan diferentes comportamientos por sexo, grupos etarios, regiones políticas y geográficas. Se observa mayor reducción de la TME en mujeres en comparación con los hombres. Los departamentos con tendencia creciente de la mortalidad son Huancavelica, Ayacucho y Pasco en los Andes centrales.
Contribuciones de Autoría: DVO ha participado en la concepción y diseño del artículo, la recolección de datos, su redacción y aprobación de la versión final. YDAP ha participado en la concepción, análisis, asesoría, revisión y aprobación de la versión final del artículo.
Financiamiento: La presente investigación fue autofinanciada.
Conflictos de intereses: Los autores declaran no tener ningún conflicto de interés.
Recibido: 15 de novimebre del 2020.
Aprobado: 30 de diciembre del 2020.
Correspondencia: Diego Rolando Venegas Ojeda
Dirección: Av. Joaquín Madrid 200 San Borja, Lima-Perú.
Teléfono: 998118532
Correo: diego.venegas@upch.pe
REFERENCIAS BIBLIOGRÁFICAS