ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2021 - Universidad Ricardo Palma10.25176/RFMH.v21i4.4023
ESTANDARIZACIÓN Y VALIDACIÓN DE UN WESTERN BLOT PARA EL DIAGNÓSTICO DEL VIRUS DE INMUNODEFICIENCIA HUMANA
STANDARDIZATION AND VALIDATION OF A WESTERN BLOT FOR THE DIAGNOSIS OF HUMAN IMMUNODEFICIENCY VIRUS
Eduardo Miranda-Ulloa1,a, Soledad Romero-Ruiz1,b, Bernardina Amorín-Uscata2,c, Kevin Serrano-Segura1,b, Ronal Briceño-Espinoza1,d, Fany Cárdenas-Bustamante1,b
1 Laboratorio de Referencia Nacional Virus de Transmisión Sexual VIH/SIDA, Centro Nacional de
Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Instituto de Medicina Tropical de São Paulo, São Paulo, Brasil.
a Biólogo, magíster en Microbiología
b Biólogo
c Biólogo magíster en Ciencias
d Tecnólogo médico.
RESUMEN
Objetivos: Estandarizar y validar una prueba de western blot para el diagnóstico del virus de inmunodeficiencia humana. Métodos: Se realizó un estudio observacional prospectivo durante el 2017 y 2018. Se estandarizó la prueba de western blot, usando la técnica de electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS PAGE), siendo las tiras blot de nitrocelulosa preparadas con una concentración óptima de antígeno de VIH-1 de 2,71 µg/mm. Se validó el western blot en laboratorio, frente a 400 muestras referentes (300 sueros y 100 plasmas): 200 positivas y 200 negativas a anticuerpos contra VIH-1, siendo la prueba de referencia el Inmunoblot de la marca Fujirebio. Se estimaron los parámetros de rendimiento diagnóstico usando el programa Epidat v3.1 y Excel. Resultados: Se logró identificar ocho bandas importantes del antígeno de VIH-1: p17, p24, p31, p39, gp41, p55, p66 y gp120. De ellas, las que se tomaron como bandas diagnósticas específicas según el Consorcio de normalización de serología para los retrovirus, fueron: p24, p31, gp41 y gp120. La sensibilidad, especificidad, valor predictivo positivo y negativo e índice de validez frente a sueros fueron: 96,7%, 96,0%, 96,0%, 96,6%, 96,3%; y frente a plasmas: 98,0%, 100,0%, 100,0%, 98,0%, 99,0% respectivamente. No se encontraron falsos positivos y negativos, pero si algunos indeterminados. Conclusión: El desarrollo de esta prueba western blot con tecnología propia, presentó similar rendimiento diagnóstico a la prueba de referencia, sin mostrar reacciones cruzadas; siendo útil para la confirmación del VIH.
Palabras Clave: Western blot; VIH; Diagnóstico; Sensibilidad y Especificidad (Fuente: DeCS BIREME).
ABSTRACT
Objectives: To standardize and validate a western blot test for the diagnosis of human immunodeficiency virus. Methods: A prospective observational study was carried out during 2017 and 2018. The western blot test was standardized, using the polyacrylamide gel electrophoresis technique with sodium dodecyl sulfate (SDS PAGE), being the nitrocellulose blot strips prepared with an Optimal HIV-1 antigen concentration of 2.71 µg / mm. The western blot was validated in the laboratory against 400 reference samples (300 sera and 100 plasmas): 200 positive and 200 negatives for antibodies against HIV-1, being the reference test the Immunoblot of the Fujirebio brand. Diagnostic performance parameters were estimated using Epidat v3.1 and Excel. Results: Eight important bands of the HIV-1 antigen were identified: p17, p24, p31, p39, gp41, p55, p66, and gp120. According to the Consortium for the normalization of serology for retroviruse, those that were taken as specific diagnostic bands were: p24, p31, gp41, and gp120. The sensitivity, specificity, positive and negative predictive value and validity index against sera were: 96.7%, 96.0%, 96.0%, 96.6%, 96.3%; and against plasmas: 98.0%, 100.0%, 100.0%, 98.0%, 99.0% respectively. No false positives and negatives were found, but some were undetermined. Conclusion: The development of this western blot test with proprietary technology presented similar diagnostic performance to the reference test, without showing cross-reactions, being useful for confirming HIV.
Keywords: Western Blotting; HIV; Diagnosis; Sensitivity and Specificity (Source: MeSH NLM).
INTRODUCCIÓN
En el Perú, dentro de las estrategias para el abordaje de la infección por el virus de
Inmunodeficiencia humana (VIH) se encuentra la cobertura del diagnóstico (1),
tal es así que se dispone de pruebas serológicas de cribado (ELISA, quimioluminiscencia y pruebas
rápidas) y de confirmación: inmunofluorescencia indirecta (IFI) e inmunoblot (IB) o western blot (WB)
(2,3). La IFI es una prueba con tecnología propia (4), bastante económica y constituye el 95% de las confirmaciones a nivel
nacional, sin embargo cuando el resultado es indeterminado o inespecífico se recurre al IB o WB por
tener superior rendimiento diagnóstico (3).
El IB comercial de la marca Fujirebio INNO-LIA HIV I/II Score (Inmunoensayo en Línea:
sensibilidad 100,0% y especificidad 96.7%) es el kit más usado como prueba de segunda opinión a las
muestras que no resolvió la IFI (5), siendo a la vez aplicada en numerosos
estudios como estándar de oro (6-10), pero su principal desventaja radica en
que sus costos son elevados, aproximadamente 800 dólares para 20 determinaciones (5).
Entre las marcas comerciales disponibles de WB se encuentran MP Diagnostics HIV BLOT 2.2
(sensibilidad: 100,0%; especificidad: 91,9%) (11), Biorad NEW LAV-BLOT I
(sensibilidad: 87,0%; especificidad: 99,5%) (12) y Biokit bioblot HIV-1 Plus
(sensibilidad: 100,0%; especificidad: 91,9%) (13). A pesar de que estas tres
marcas no reportan resultados falsos positivos y negativos (sólo indeterminados), su uso es muy limitado
debido a los precios costosos atribuidos a sus kits (1,000 a 1,200 dólares para 18 determinaciones)
(11-13).
El western blot, inmunoblot o inmunoelectrotransferencia es una prueba útil en la identificación
de anticuerpos contra el VIH; consiste en la separación de los antígenos virales por electroforesis en
geles de poliacrilamida, luego transferidos a una membrana de nitrocelulosa, que será expuesto
posteriormente con los anticuerpos del suero o plasma problema y al entrar en contacto con una
antiinmunoglobulina marcada con una enzima, reaccionarán inmunológicamente dando lugar a un patrón de
bandas, las cuales serán interpretadas bajo alguno de los criterios descritos por los organismos
internacionales (14).
Cabe decir que, en Perú alrededor de 1,200 muestras anuales son resueltas mediante
inmunoblot/western blot (15), cuyos gastos llegan a ser superiores a los
60,000 dólares al año. Por lo tanto, debido a la necesidad de un western blot de bajo costo con
tecnología propia y frente a los elevados precios de los kits comerciales, nos planteamos el siguiente
objetivo: Estandarizar y validar un western blot para el diagnóstico del virus de inmunodeficiencia
humana.
MÉTODOS
Diseño y área de estudio
Estudio observacional prospectivo de estandarización y validación de una prueba diagnóstica realizado durante el 2017 y 2018 en el Instituto Nacional de Salud (INS) de Perú. Bajo este enfoque, el diseño es apropiado para estimar la capacidad de una medida que permita discriminar entre personas con enfermedad y sin enfermedad.
Población y muestra
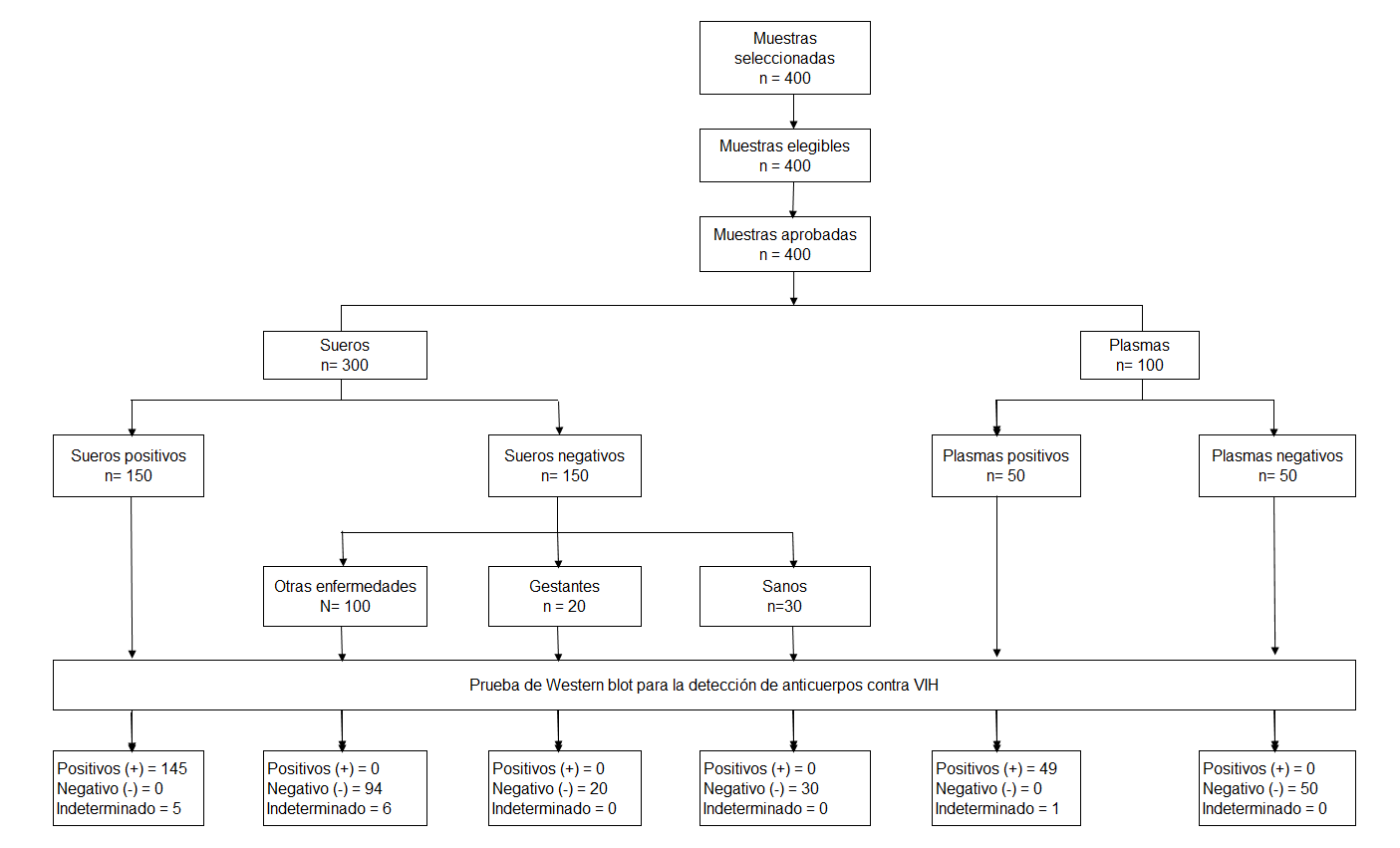
La población estuvo conformada por los sueros y plasmas que pertenecieron a la seroteca y plasmoteca del Laboratorio de Referencia Nacional de VTS-VIH/SIDA del INS durante los años 2016 y 2017. La estimación del tamaño de muestra fue definido por conveniencia, usándose un muestreo no probabilístico, contando con 400 muestras referentes: 150 sueros positivos a VIH-1; 150 sueros negativos a VIH-1 (30 de individuos sanos y 120 de individuos con las siguientes condiciones: veinte con sífilis, veinte de gestantes, veinte con enfermedad reumatoide (ER), veinte con hepatitis B, veinte con HTLV-1, diez con citomegalovirus y diez con dengue); 50 plasmas positivos y 50 plasmas negativos a VIH-1. La prueba de Referencia o Estándar de oro, fue el IB comercial (INNO-LIA™* HIV I/II Score; Fujirebio, Bélgica) (5).
Variables e instrumentos
La estandarización y validación de una prueba diagnóstica, implicó considerar las siguientes
variables: Sensibilidad, Especificidad, Índice de validez, Valor predictivo positivo (VPP), Valor
predictivo negativo (VPN), Índice de Youden y Razón de verosimilitud negativa. Para alcanzar a medir
dichas variables, previamente se realizaron tres etapas:
Optimización en la preparación del antígeno de VIH-1.- Se preparó los cultivos celulares de la
línea H9/HTLV-IIIB infectadas con VIH-1, siguiendo la metodología descrita por Romero-Ruiz et tal
(16). El sobrenadante celular fue lavado y centrifugado tres veces con
solución salina fisiológica (SSF) al 0.9% a 4,400 rpm por 15 minutos entre 2 a 8°C. Luego se re
suspendió el sedimento o pellet con SSF. Para efectuar la lisis viral y celular se usó un sonicador, a 6
periodos de 60 decibeles con 2 minutos por periodo y un minuto de reposo entre periodos manteniendo la
cadena de frío (2 a 8°C).
El producto sonicado fue centrifugado a 1,500 rpm por 10 minutos y su sobrenadante fue
registrado como antígeno de VIH-1. Finalmente, se usó el método de Bradford (17) para cuantificar las proteínas del antígeno de VIH-1.
Estandarización en la preparación de las tiras de Western blot.- esta etapa fue estandarizada
siguiendo la metodología de electroforesis en geles de poliacrilamida con dodecil sulfato de sodio
(SDS-PAGE) (18). Se usó la cámara de electroforesis vertical Mini-Protean
(Bio-rad) para geles (tamaño del gel: 8.3 por 7.3 cm) de 1.0 mm. Se optimizó el porcentaje de acrilamida
para preparar el gel de resolución, estableciéndose dos concentraciones (mixtas) 9% (3,8 cm) y 15% (2
cm). El tratamiento del antígeno, la separación y transferencia electroforética, se realizó siguiendo la
metodología descrita por Miranda et al (19). Finalmente, se estableció la
concentración óptima del antígeno de VIH-1 para preparar las tiras de WB, siendo de 2,71 µg/mm.
Optimización en la reacción Inmunoenzimática de la prueba de Western blot.- el óptimo del
volumen que se estableció en todos los pasos de ésta etapa fue de 1 mL. Las tiras blot fueron incubadas
tres horas en PBS/tween-leche (PBS/0,1M NaCL, 0,05 M Na2 PO4, pH 7,2; Tween 20/0,3% tween 20; leche/5%
de leche) conteniendo los sueros o plasmas del estudio a una dilución 1/40. Seguidamente, las tiras de
nitrocelulosa fueron lavadas cinco veces con PBS/Tween-20 e incubadas por una hora en PBS/tween-leche
conteniendo el conjugado Anti IgG humano ligada a una peroxidasa, a la dilución de 1/1000. Nuevamente se
lavaron las tiras tres veces con PBS/Tween-20 y dos veces con PBS. Las bandas fueron reveladas frente a
una solución de substrato (peróxido de hidrógeno 30% a 1uL/mL y diaminobencidina a 0.5 mg/mL en PBS pH
7.2) y se paró la reacción lavando las tiras con agua destilada.
Procedimientos
Lectura, interpretación y validación de la prueba de Western blot.- para el criterio de positividad, se consideró las directrices del Consorcio para la normalización de las serologías de retrovirus (CRSS) (11-14, 20): POSITIVO: Una banda de p24 o p31 y una banda de ENV (gp41 o gp120). NEGATIVO: Ninguna banda vírica específica presente. INDETERMINADO: Cualquier banda vírica específica presente, pero el patrón no cumple los criterios para positivo. Con estos criterios se validó el WB, realizándose las lecturas e interpretaciones de las 400 muestras referentes incorporadas al estudio.
Análisis estadístico
El análisis estadístico se estimó haciendo uso de una tabla de contingencia, el programa Epidat v3.1 y Excel. Se informó los porcentajes de la Sensibilidad, Especificidad, Índice de validez, Valor predictivo positivo (VPP), Valor predictivo negativo (VPN), Índice de Youden y Razón de verosimilitud negativa, considerando un nivel de confianza de 95% (IC 95%).
Consideraciones éticas
El protocolo del estudio fue aprobado por el Comité Institucional de Ética en Investigación del Instituto Nacional de Salud de Perú con el código: OI-022-14 y con Resolución Directoral N°: 418-2014-DG-OGITT-OPE/INS. Asimismo, la Oficina General de Investigación y Transferencia Tecnológica dio su conformidad al informe final del presente estudio con MEMORANDO N° 027-2019-OGITT/INS.
RESULTADOS
Entre nuestros hallazgos, logramos mostrar ocho bandas importantes, correspondientes a las proteínas víricas de VIH-1: p17, p24, p31, p39, gp41, p55, p66 y gp120. De estas las que fueron tomadas como bandas diagnósticas específicas según el CRSS, fueron: p24, p31, gp41 y gp120 (Figura 1).
Entre otros hallazgos, resaltamos que frente a las muestras de suero se tuvo once resultados indeterminados (5 del panel positivo y 6 del panel negativo) y frente a las muestras de plasmas hubo un indeterminado procedente del panel positivo. Dichos resultados de la prueba de WB, se muestran en el diagrama de flujo de muestras incorporadas al estudio (Figura 2).
Un destaque importante de esta prueba de WB, es que no mostró falsos positivos y negativos. No obstante, sólo algunas muestras de suero tuvieron resultados indeterminados: sífilis (2/20), hepatitis B (2/20), ER (1/20) y HTLV-1 (1/20) (Tabla 1).
Tabla 1. Validación de la prueba de Western blot para la detección de anticuerpos contra VIH usando muestras positivas negativas e interferentes.
| Western Bloth VIH | ||||||
|---|---|---|---|---|---|---|
| Condición | Cantidad | Verdaderos Positivos | Falsos Positivos | Verdaderos Negativos | Falsos Negativos | Indeterminados |
| Sueros | ||||||
| VIH-1 | 150 | 145 | - | 0 | 0 | 5 |
| Sifilis | 20 | - | 0 | 18 | - | 2 |
| Gestantes | 20 | - | 0 | 20 | - | 0 |
| ER* | 20 | - | 0 | 19 | - | 1 |
| Hepatitis B | 20 | - | 0 | 18 | - | 2 |
| HTLV-1 | 20 | - | 0 | 19 | - | 1 |
| CMV** | 10 | - | 0 | 10 | - | 0 |
| Dengue | 10 | - | 0 | 10 | - | 0 |
| Sanos | 30 | - | 0 | 30 | - | 0 |
| Plasmas | ||||||
| VIH-1 | 50 | 49 | - | 0 | 0 | 1 |
| Negativos a VIH-1 | 50 | - | 0 | 50 | - | 0 |
| Total | 400 | 194 | 0 | 194 | - | 12 |
Entre los principales logros, mostramos que los resultados de los parámetros de validación (sensibilidad, especificidad, VPP, VPN e Índice de Validez) para nuestra prueba de WB, fueron superiores a 96,0%; del mismo modo, el índice de Youden con los valores de 0,93 y 0,98, confirma una mínima posibilidad de obtener falsos positivos o falsos negativos; así como una razón de verosimilitud negativa baja de 0,03 y 0,02, que es coherente con los demás resultados (Tabla 2).
Tabla 2. Parámetros de la prueba de Western blot para la detección de anticuerpos contra VIH frente a muestras de sueros y plasmas
| Western Bloth VIH | ||
|---|---|---|
| Parámetros | Suero | Plasma |
| Valor IC (95%) | Valor IC (95%) | |
| Sensibilidad (%) | 96,7 (93,5 - 99,9) | 98,0 (93,1-100,0) |
| Especifidad (%) | 96,0 (92,5 - 99,5) | 100,0 (99,0 - 100,0) |
| Indice de Validez (%) | 96,3 (94,0 - 98,6) | 99,0 (96,6 - 100,0) |
| Valor predictivo +(%) | 96,0 (92,6 - 99,5) | 100,0 (99,0 - 100,0) |
| Valor predictivo -(%) | 96,6 (93,4 - 99,9) | 98,0 (93,3 - 100,0) |
| Indice de Youden | 0,93 (0,88 - 0,97) | 0,98 (0,94 - 1,02) |
| Razón de verosimilitud | 0,03 (0,01 - 0,08) | 0,02 (0,0 - 0,14) |
DISCUSIÓN
La prueba de referencia que usamos en el presente estudio, es la más utilizada en el Perú (2, 3,
6,15) y en otros países (5, 7-10) en el inserto reporta una sensibilidad de 100% y especificidades de:
96.7% (banco de sangre) y 96.1% (muestras clínicas); éste kit tiene incorporado proteínas recombinantes
y péptidos sintéticos del VIH-1 y VIH-2 (5). La sensibilidad y especificidad
de nuestro WB usando proteínas antigénicas de la lisis del VIH-1, fue superior a 96.0%, aun así, no
tuvimos falsos negativos y positivos, lo que nos permite deducir que nuestros resultados para los mismos
parámetros son similares.
Los kits de Western blot NEW LAV BLOT I (Biorad) (12) y bioblot HIV-1
plus (Biokit) (13) empleando el criterio de positividad de la CRSS, reportan
sensibilidades de 99,5% y 94,9% y especificidades de 87.0% y 91,9% respectivamente. A la vez informan
que no tuvieron falsos negativos y positivos, sólo indeterminados (12,13). Asimismo, el kit de Inmunoblot Recom Line HIV-1 & HIV-2 IgG (Mikrogen
diagnostik) (21), reporta una sensibilidad del 100% y especificidades de:
99,3% (banco de sangre), 98,5% (muestras clínicas) y 96,4% (interferentes). Nuestra prueba de WB para
los mismos parámetros, mostró resultados comparables a las tres marcas comerciales descritas de western
blot/Inmunoblot.
Debido a los resultados indeterminados que se obtuvieron, no se logró una sensibilidad del
100.0%; esto podría deberse a que los anticuerpos frente a p24 y p31 disminuyen durante el curso en la
fase SIDA, lo que provoca un desplazamiento de la interpretación de positivo a indeterminado (11); no obstante, desconocemos si las muestras procedieron de pacientes en
esa fase.
Para establecer la especificidad (sueros), los resultados indeterminados representaron el 4,0%
(6/150); cabe decir que, para los cálculos en otros estudios de validación, no consideran a los
indeterminados en el rubro de los falsos positivos (22), siendo así
tendríamos una especificidad global del 100,0%, en las 144 muestras (144/144). En general los (12/400)
indeterminados que obtuvimos (Tabla 1), no afecta la eficiencia diagnóstica de
nuestro WB, ya que la Norma técnica peruana indica realizarles a los indeterminados la prueba de PCR ARN
viral-VIH-1(carga viral) o PCR ADN proviral-VIH-1 (2).
Nuestra prueba estandarizada y validada, siguió un diseño de WB desarrollada para parásitos, el
cual tuvo muy buenos resultados en Perú (19,23-25). Las
diferentes marcas comerciales de
inmunoblot/western blot para VIH usan conjugado que contiene la enzima fosfatasa alcalina, el sustrato
5-Bromo-4-cloro-3- indolil fosfato (BCIP) y como cromógeno el nitro azul de tetrazolio
(5,11-13,21);
mientras que en nuestro WB usamos un conjugado que contiene peroxidasa, el sustrato peróxido de
hidrógeno y como cromógeno la diaminobencidina, similar a estos reactivos fueron usados en el kit de WB
DAVIH-BLOT procedente de Cuba, el cual mostró buen rendimiento diagnóstico frente a muestras de suero,
orina y fluido oral (26).
Además de ello el formato de tamaño de tiras y el volumen a usar es similar a la prueba de
Referencia (5), mientras que las demás marcas comerciales usan tiras blot de
mayor tamaño y en consecuencia requieren el uso del doble de volumen de reactivos. Las condiciones
mencionadas son importantes de resaltar debido a que nuestra metodología, economiza, ya que usa menos
reactivos, a la vez que preparamos nuestro propio antígeno viral, teniendo como ventaja que el INS
cuenta con el Laboratorio de Nivel de Bioseguridad III, siendo donde se realiza el mantenimiento y
desarrollo de los cultivos celulares de la línea H9/HTLV-IIIB infectadas con VIH-1. En consecuencia,
nuestra prueba de WB tendría un costo de hasta diez veces menor al de los kits comerciales.
La prueba de WB fue estandarizada y validada en laboratorio, siendo una limitante del estudio en
completar su validación en campo, con la finalidad de que pueda implementarse a los laboratorios de
referencia del Perú.
CONCLUSIÓN
Los resultados de los parámetros obtenidos en la prueba de WB para la detección de anticuerpos contra VIH, la califican como una prueba de buen rendimiento diagnóstico y la hace útil para la confirmación serológica, En consecuencia, recomendamos su uso en el Laboratorio de Referencia Nacional de Virus de Transmisión Sexual del INS, como un ensayo alternativo a las pruebas confirmatorias comerciales además de reducir los costos de manera significativa en la confirmación del VIH.
Contribuciones de Autoría: Los autores participaron en la concepción y diseño del
proyecto; recolección, análisis e interpretación de los resultados; redacción, revisión crítica
y aprobación de la versión final del artículo.
Financiamiento: el proyecto fue financiado por el fondo concursable del Centro Nacional
de Salud Pública del Instituto Nacional de Salud de Perú.
Conflictos de intereses: los autores declaran no tener conflictos de interés en la
publicación de este artículo.
Recibido: 24 de junio 2021
Aprobado: 14 de julio 2021
Correspondencia: Eduardo Fernando Miranda Ulloa
Dirección: Defensores del Morro 2268, Chorrillos – Lima, Perú.
Teléfono: (051) 977783088
Correo: fernandoul@hotmail.com ; emiranda@ins.gob.pe
REFERENCIAS BIBLIOGRÁFICAS