ARTÍCULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2021 - Universidad Ricardo Palma10.25176/RFMH.v22i1.4129
EL EJERCICIO COMO PROTAGONISTA EN LA PLASTICIDAD MUSCULAR Y EN EL MÚSCULO COMO UN ÓRGANO ENDOCRINO: IMPLICACIONES EN LAS ENFERMEDADES CRÓNICAS
EXERCISE AS A PROTAGONIST IN MUSCLE PLASTICITY AND IN THE MUSCLE AS AN ENDOCRINE ORGAN: IMPLICATIONS IN CHRONIC DISEASES
Amelia Vargas-Pacheco 1, a, Lucy E. Correa-López 2, b
1 Universidad Nacional Federico Villarreal. Lima, Perú
2 Facultad de Medicina Humana, Universidad Ricardo Palma. Lima, Perú
a Especialista en administración de servicios de salud
b Magister en economía
RESUMEN
El músculo esquelético activo y el mantenimiento de la masa muscular son esenciales para la salud, el
bienestar, la prevención y el tratamiento de enfermedades. Recientemente se ha documentado que el
músculo, como órgano endocrino, es capaz de sintetizar mioquinas. Estos péptidos son secretados en
respuesta a las contracciones musculares inducidas por el ejercicio, y son capaces de crear comunicación
molecular con otros tejidos, beneficiando así la salud cardiovascular, metabólica y mental.
La función endocrina del músculo continúa en investigación constante, sin embargo, lo conocido
hasta ahora nos insta a seguir promoviendo la actividad física. Adicionalmente a esto, extender el
conocimiento sobre las mioquinas, es útil para poder prescribir el ejercicio físico de manera
individualizada y a la medida de cada paciente.
Palabras Clave: Plasticidad adaptativa, músculos, citocinas, ejercicio físico, actividad motora, enfermedad crónica (Fuente: DeCS BIREME).
ABSTRACT
The active skeletal muscle and the maintenance of muscle mass are essential for good health,
wellness and disease prevention and treatment. It has recently been documented that the muscle, as an
endocrine organ, is capable of synthesizing myokines. These peptides are secreted in response to
muscular contractions induced by exercise, and can develop molecular communication with other tissues,
improving cardiovascular, metabolic, and mental health.
The endocrine function of a muscle continues to be in a constant investigation; however,
knowledge up to date urges us to continue promoting physical activity. Additionally, the extended
knowledge of myokines is useful to prescribe individualized physical exercise programs to each patient.
Keywords: Adaptive plasticity, muscles, cytokines, physical exercise, motor activity, chronic disease (Source : MeSH - NLM).
INTRODUCCIÓN
El músculo es un tejido dinámico implicado en el movimiento, la postura, la respiración (1), y en la termorregulación corporal (2). Se
considera el órgano más abundante del cuerpo humano (2), ya que representa del
30 al 50% del peso corporal total (3).
Desde los años 450 a.C., se han evidenciado los efectos positivos de la actividad física en la
salud y en la prevención de enfermedades crónicas. Tal y como lo citó el “padre de la medicina,
Hipócrates de Cos: “Caminar es la mejor medicina de un hombre.” y “el deporte es preservador de la
salud”. (4), en este sentido, el ejercicio también puede ser prescrito como
tratamiento para las enfermedades relacionadas con el estilo de vida: enfermedades cardiovasculares,
diabetes tipo 2, trastornos neurodegenerativos y cáncer (5).
Los beneficios del ejercicio para la salud y el bienestar del ser humano se han atribuido a
innumerables mecanismos fisiológicos, sin embargo, en años recientes se ha documentado el rol
trascendental que posee el músculo en estos procesos (6).
En años recientes, se ha identificado el músculo esquelético como un órgano endocrino, ya que es
capaz de sintetizar unas citoquinas llamadas mioquinas, las cuales poseen función autocrina, paracrina y
endocrina (7,8). Gracias al estímulo del ejercicio, estas moléculas proteicas son liberadas al torrente
sanguíneo, permitiendo así la comunicación del músculo no solo consigo mismo, sino también con otros
órganos tales como cerebro, hueso, páncreas, intestino, hígado, tejido adiposo, sistema cardiovascular,
y la piel (5); creando así una conexión fisiológica y única entre el ejercicio
y la regulación del metabolismo (2).
Tomando en cuenta el deterioro progresivo de la fisiología muscular con la edad, el músculo
esquelético activo y el mantenimiento de la masa muscular son esenciales para el cuidado de la salud, la
prevención y el tratamiento de enfermedades (9). Por ello, el presente
artículo busca realizar una revisión bibliográfica actualizada sobre la importancia del ejercicio físico
en la preservación de la masa muscular a lo largo del curso de la vida, tanto para la prevención como
para el tratamiento de las enfermedades crónicas no transmisibles.
METODOLOGÍA
Se realizó una revisión de artículos científicos en los idiomas español e inglés relacionados con el tema de investigación, los cuales fueron recopilados de: PubMed, Elselvier y SciELO. Por otro lado, se tomaron en cuenta ciertos criterios para la adecuada selección de los artículos: que el título del artículo esté seleccionado con el tema de investigación y que tuvieran un máximo de 6 años de antigüedad, es decir, con fecha del 2015 en adelante. Se excluyeron las cartas al editor relacionadas con el tema.
RESULTADOS
De los 37 artículos encontrados, se seleccionaron 35. Uno se descartó por ser publicado antes del 2015 y el otro por ser carta al editor. Las tablas 1 y 2 detallan los resultados y conclusiones más relevantes de los artículos seleccionados según el objetivo del presente estudio.
Tabla 1. Artículos seleccionados referentes al músculo y su plasticidad
| AUTORES | TÍTULO | AÑO | RESULTADOS/CONCLUSIONES | TIPO ARTÍCULO |
|---|---|---|---|---|
| Josep M. Argilés PhD, Nefertiti Campos PhD, José M. Lopez-Pedrosa PhD, Ricardo Rueda MD, PhD, Leocadio Rodriguez-Mañas PhD | Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease | 2016 | El músculo es notablemente plástico. La actividad física, especialmente el ejercicio de resistencia estimula la síntesis proteica y es esencia para el tratamiento de la atrofia muscular. | Artículo de revisión |
| M. S. Brook, D. J. Wilkinson, B. E. Phillips, J. Perez-Schindler, A. Philp, K. Smith1 and P. J. Atherton | Skeletal muscle homeostasis and plasticity in youth and ageing: impact of nutrition and exercise | 2015 | El ejercicio sigue siendo la estrategia terapeutica más eficiente para el tratamiento de la sarcopenia, además incrementa la fuerza muscular y la tasa metabólica basal; optimiza la presión arterial, el perfil lipídico y la sensibilidad a la insulina. | Artículo de revisión |
| Rosanna Piccirillo | Exercise-Induced Myokines With Therapeutic Potential for Muscle Wasting | 2019 | La actividad física es una de las vías en las que el músculo se protege contra las enfermedades secundarias al desgaste muscular. | Artículo de revisión |
| Christoph Hoffmann, Cora Weigert | Skeletal Muscle as an Endocrine Organ: The Role of Myokines in Exercise Adaptations | 2017 | Las mioquinas son cruciales para la adaptación muscular para el incremento de la condición física. | Artículo de revisión |
| Pablo Jorge, Marcos-Pardo, Noelia González-Gálvez, Abraham López-Vivancos, Alejandro Espeso-García, et all. | Sarcopenia, Diet, Physical Activity and Obesity in European Middle-Aged and Older Adults: The LifeAge Study | 2020 | Una baja masa muscular y baja fuerza muscular son criterios para determinar sarcopenia guías europeas. La fuerza muscular es un predictor de mortalidad y discapacidad en adultos mayores. | Artículo de investigación: estudio transversal |
| Jonathan C. Mcleod, Tanner Stokes, Stuart M. Phillips | Resistance Exercise Training as a Primary Countermeasure to Age-Related Chronic Disease | 2019 | Adicionalmente a la condición cardiorrespiratoria, la masa muscular y la fuerza también están asociados con el riesgo de desarrollar enfermedades cardiovasculares y mayor índice de mortalidad. Evidencia presentada destaca que los entrenamientos de resistencia son equivalentes y hasta superiores al ejercicio aeróbico como la primera línea de prevención de las enfermedades crónicas. | Artículo de revisión |
| Sandra Maria Barbalho, Uri Adrian Prync Flato, Ricardo José Tofano, Ricardo de Alvares Goulart , Elen Landgraf Guiguer, Cláudia Rucco P. et al. | Physical Exercise and Myokines: Relationships with Sarcopenia and Cardiovascular Complications | 2020 | La inactividad física y la reducción de la masa muscular conlleva a un aumento en la grasa visceral- culminando en un desequilibrio entre el estado antiinflamatorio y proinflamatorio- incrementando el ciclo vicioso entre sarcopenia, acumulación del tejido adiposo y complicaciones cardiovasculares. | Artículo de revisión |
| José Andrés Rubio del Peral, M. Sonia Gracia Josa. | Ejercicios de resistencia en el tratamiento y prevención de la sarcopenia en ancianos. Revisión sistemática | 2017 | La realización de ejercicios de resistencia es de las pautas más adecuada para prevenir y tratar la sarcopenia,ya sea ese tipo de ejercicio solamente o combinado con entrenamientos aeróbicos, logrando beneficios sobre la masa, fuerza muscular y funcionalidad en las actividades básicas diarias. | Artículo de revisión: revisión sistemática |
| Youngju Choi, Jinkyung Cho, Mi-Hyun No, Jun-Won Heo, Eun-Jeong Cho, Eunwook Chang, Dong-Ho Park, Ju-Hee Kang, Hyo-Bum Kwak | Re-Setting the Circadian Clock Using Exercise against Sarcopenia | 2020 | El ejercicio puede atenuar e incluso revertir la pérdida de la masa y fuerza muscular. | Artículo de revisión |
| Sanna Vikberg, Niklas Sörlén, Lisa Brandén, Jonas Johansson PhD, Anna Nordström MD, PhD, Andreas Hult PhD, Peter Nordström MD, PhD | Effects of Resistance Training on Functional Strength and Muscle Mass in 70-Year-Old Individuals With Pre-sarcopenia: A Randomized Controlled Trial | 2019 | Se demuestra la importancia del incremento progresivo del entrenamiento hasta llegar a ejercicio de alta intensidad. Esto mejora significativamente a la prevención de caídas, fracturas y optimizar la salud en general. | Artículo de investigación |
| Mª Victoria Palop Montoro, Juan Antonio Párraga Montilla, Emilio Lozano Aguilera, Milagros Arteaga Checa | Intervención en la sarcopenia con entrenamiento de resistencia progresiva y suplementos nutricionales proteicos | 2015 | Un total de 147 estudios fueron encontrados los cuales realizaban ejercicio de resistencia, mediante sesiones de 45-60 minutos, 2-3 veces por semana, y 3-4 series de 8 repeticiones, a una intensidad creciente. Este ejercicio produjo un aumento de la masa muscular y la fuerza, así como incremento en la síntesis de proteínas y el tamaño de la fibra muscular. | Artículo de revisión |
| Kelly A. Bowden Davies , Samuel Pickles, Victoria S. Sprung, Graham J. Kemp, Uazman Alam, Daniel R. Moore, Abd A. Tahrani and Daniel J. Cuthbertson | Reduced physical activity in young and older adults: metabolic and musculoskeletal implications | 2019 | La actividad física es vital en la salud musculoesqulética, mantenimiento de la masa ósea y muscular, así como atenuar las consecuencias físicas y metabólicas del envejecimiento. | Artículo de revisión |
| Anna Vainshtein, Marco Sandri | Signaling Pathways That Control Muscle Mass | 2020 | La habilidad de alterar la composición de las fibras musculares a través de los cambios en el estilo de vida ejemplifica la increíble propiedad de plasticidad del músculo. | Artículo de revisión |
| Kedryn K. Baskin, Benjamin R. Winders, Eric N. Olson | Muscle as a ‘‘Mediator’’ of Systemic Metabolism | 2015 | El tipo de fibra muscular que prevalece en el músculo impacta profundamente en el consumo de energía sistémico. | Artículo de revisión |
| Leandro dos Santos, Edilson S. Cyrino, Melissa Antunes, Diana A. Santos, Luís B. Sardinha | Sarcopenia and physical independence in older adults: the independent and synergic role of muscle mass and muscle function | 2017 | Demostró que adultos mayores con pérdida de la masa y fuerza muscular (sarcopenia) tienen más riesgo perder la independencia física después de los 90 años de edad. | Artículo de investigación: estudio transversal |
| Fuente: Elaboración propia. |
Tabla 2. Artículos seleccionados referentes al músculo como órgano endocrino
| AUTORES | TÍTULO | AÑO | RESULTADOS/CONCLUSIONES | TIPO ARTÍCULO |
|---|---|---|---|---|
| Mai Charlotte Krogh Severinsen, Bente Klarlund Pedersen | Muscle–Organ Crosstalk: The Emerging Roles of Myokines | 2020 | Las mioquinas son biomarcadores útiles para monitorizar el tipo y cantidad de ejercicio que se requiere prescribir para las personas con enfermedades crónicas, tales como cáncer, diabetes o enfermedades neurodegenerativas. | Artículo de revisión |
| Mark A. Febbraio | Health Benefits of exercise- more than meets the eye! | 2017 | La comunicación de tejidos durante el ejercicio físico previene enfermedades metabólicas, cáncer, degeneración retiniana y pérdida de la memoria. Se destacan la catepsina B, osteocalcina y BDNF como mensajeros. | Artículo de revisión |
| Luana G. Leal, Magno A. Lopes, Miguel L. Batista Jr. | Physical Exercise-Induced Myokines and Muscle-Adipose Tissue Crosstalk: A Review of Current Knowledge and the Implications for Health and Metabolic Diseases | 2018 | La actividad física es conocida por optimizar la salud metabólica a través de adaptaciones de diversos tejidos, tales como el músculo y el adiposo. | |
| Brian P. Carson | The Potential Role of Contraction-Induced Myokines in the Regulation of Metabolic Function for the Prevention and Treatment of Type 2 Diabetes | 2017 | Ejercicio de resistencia libera concentraciones importantes de IL-6, IL-15, BDNF e irisina, lo que confirma la inclusión de este tipo de ejercicio para los protocolos de prevención y tratamiento de la DM2. | Artículo de revisión |
| Julien Delezie, Christoph Handschin | Endocrine Crosstalk Between Skeletal Muscle and the Brain | 2018 | BDNF y PGC-1α juegan un papel protagonista en la transmisión sináptica, neurogénesis, memoria y en los estados de humor. | Artículo de revisión |
| Jenny Hyosun Kwon , Kyoung Min Moon,* and Kyueng-Whan Min | Exercise-Induced Myokines can Explain the Importance of Physical Activity in the Elderly: An Overview | 2020 | Tanto el ejercicio aeróbico como anaeróbico genera beneficios en el músculo mediante la liberación de mioquinas, las cuales las dividen dependen de la actividad física. Aeróbica: apelina, BAIBA, IL-15, IL-6, irisina, SDF-1, sestrina, SPARC, y VEGF-A. Anaeróbica: BMP-7, decorina, IGF-1, IL-15, IL-6, irisina y VEGF-A. | Artículo de revisión |
| Chen He, Wenzhen He, Jing Hou, Kaixuan Chen, Mei Huang, Mi Yang, Xianghang Luo, Changjun Li | Bone and Muscle Crosstalk in Aging | 2020 | La contracción muscular secreta BDNF para mejorar la capacidad de aprendizaje y la memoria, y la irisina liberada por estimulación del ejercicio promueve la termogénesis y aumenta la masa ósea. | Artículo de revisión |
| Christoph Hoffmann, Cora Weigert | Skeletal Muscle as an Endocrine Organ: The Role of Myokines in Exercise Adaptations | 2017 | Las mioquinas juegan un papel central regulando la interacción de las miofibrillas, células inmunes, fibroblastos y células endoteliales. | Artículo de revisión |
| Svenia Schnyder, Christoph Handschin | Skeletal muscle as an endocrine organ: PGC-1α, myokines and exercise | 2015 | La expresión de IL-6 se correlaciona con la contracción muscular. Promueve la gluconeogenesis y lipólisis en el tejido adiposo. Además contribuye al adecuado uso de los sutratos de energía propiciando la contracción muscular y afectando órganos distales. Se ha declaro a la IL-6 como el "exercise factor" (factor de contracción). | Artículo de revisión |
| Marie Lund Bay, Bente Klarlund Pedersen | Muscle-Organ Crosstalk: Focus on Immunometabolism | 2020 | Estudios intervencionales han demostrado que un número reducido de pasos diarios genera acumulación de tejido adiposo visceral, por lo contrario el ejercicio físico se asocia con una disminución en la grasa visceral. IL-6, irisina y LA "meterolin-like" intervienen en el pardeamiento del tejido adiposo blanco. | Artículo de revisión |
| Chris McGlory, PhD, Mark T. von Allmen, MSc, Tanner Stokes, BSc Robert W. Morton, PhD Amy J. et al. | Failed Recovery of Glycemic Control and Myofibrillar Protein Synthesis With 2 wk of Physical Inactivity in Overweight, Prediabetic Older Adults | 2018 | Se demostró que con solo 2 semanas de inactividad física, puede afectar la glicemia postpandrial, generando la instauración de un fenotipo diabético. Está disminución a la sensibilidad de la insulina es agravado con la edad. | Artículo de investigación |
| Pedro L. Valenzuela, Pedro Carrera-Bastos, Beatriz G. Gálvez, Gema Ruiz-Hurtado, José M. Ordovas, Luis M. Ruilope, Alejandro Lucia | Lifestyle interventions for the prevention and treatment of hypertension | 2020 | Mioquinas brindan beneficios de manera directa e indirecta en fenotipos cardiovasculares, incluyendo los relacionados con la presión arterial (P.A). En particular la irisina se ha demostrado que disminuye la P.A directamente. | Artículo de revisión |
| Rafael A. Casuso, Jesús R. Huertas | Mitochondrial Functionality in Inflammatory Pathology-Modulatory Role of Physical Activity | 2021 | El ejercicio induce adapaciones a nivel mitocondrial que ayudan a combatir infecciones virales. El ejercicio de intensidad moderada eleva los niveles de células inmunes: dato importante para enfrentar la crisis de COVID-19 y futuras pandemias. | Artículo de revisión |
| Jimena Giudice, Joan M. Taylor | Muscle as a paracrine and endocrine organ | 2017 | Irisina disminuye la obesidad mediante el proceso de pardeamiento del tejido adiposo blanco, activa la termogénesis y promueve el gasto de energía. | Artículo de revisión |
| Claire Laurens, Audrey Bergouignan, Cedric Moro | Exercise-Released Myokines in the Control of Energy Metabolism | 2020 | Se destaca el potencial terapéutico de las mioquinas y su importancia en la interacción del músculo con otros órganos. La cantidad de contracciones musculares son directamente proporcionales con los beneficios en salud. | Artículo de revisión |
| Carolina Archundia‑Herrera, Maciste Macias‑Cervantes, Bernardo Ruiz‑Muñoz, Katya Vargas‑Ortiz, Carlos Kornhauser, Victoriano Perez‑Vazquez | Muscle irisin response to aerobic vs HIIT in overweight female adolescents | 2017 | Irisina induce al pardeamiento del tejido adiposo blanco resultando en un incremento en la termogénesis. La expresión de esta proteína en el músculo se incrementa posterior a una sesión de entrenamiento tipo HIIT. | Artículo de investigación: estudio transversal |
| Steven S. Welc and Thomas L. Clanton | The regulation of interleukin-6 implicates skeletal muscle as an integrative stress sensor and endocrine organ | 2017 | IL-6 posee funciones de protección y regeneración en el cuerpo humano, particularmente en los escenarios de estrés agudo. | Artículo de revisión |
| Alejandro Abarca | Ejercicio como tratamiento anti-inflamatorio | 2016 | IL-6 incrementa las concentraciones de ácidos grasos durante el ejercicio por medio de su actividad lipolítica, además puede ayudar en la regulación de la homeostasis de la glucosa al alterar la producción hepática de glucógeno y/o la captura muscular de glucosa. | Revisión bibliográfica |
| Fuente: Elaboración propia. |
DISCUSIÓN
MÚSCULO Y PLASTICIDAD
El músculo es un tejido estructuralmente organizado y funcional, constituyendo la principal reserva de
aminoácidos, albergando aproximadamente el 75% de la proteína corporal (3,8,10).
El tejido muscular es altamente maleable, plástico (3,8), y con una gran capacidad de adaptación y regeneración ante diversos
estímulos tales como ingesta de nutrientes, restricción o aumento de calorías, actividad física,
enfermedades, hormonas, estrés físico y citoquinas. (11)
Es considerable destacar que la alimentación y el ejercicio son claves para la ganancia y la
preservación de la masa muscular. (3,8,12,13) El mantenimiento del músculo a través de la vida, es necesaria para la
salud, el bienestar y para la recuperación de enfermedades. (3) Además,
garantiza la independencia física, mejora la calidad de vida (13) y previene
morbilidades, tales como la resistencia a la insulina (12). Así mismo, se ha
visto que la fuerza muscular es un predictor de mortalidad, discapacidad y fragilidad en las personas
adultas mayores (13,14).
El comportamiento fisiológico normal del envejecimiento ocasiona una disminución de la masa
muscular. (13,14,15). Durante el proceso de
envejecimiento se genera atrofia de las fibras musculares tipo II. Además, hay un recambio de fibras II
a las de tipo I, es decir, de las rápidas a lentas (3).
En condiciones óptimas, el sistema musculoesquelético se mantiene estable durante el curso de la
vida hasta aproximadamente los 50 años, posteriormente la pérdida muscular desciende progresivamente
alrededor de 1% por año. Posterior a los 70 años se incrementa a 1.3% - 2.4% y pasado los 80 años puede
llegar hasta un 5% por año. (13,14,15).
Lo expuesto previamente conceptualiza a lo que se conoce como sarcopenia. La palabra sarcopenia,
se deriva del griego: sarx que significa carne, y penia: pérdida. Se define como un desorden muscular
crónico, degenerativo (8), generalizado, progresivo y asociado con la edad,
que se caracteriza por la disminución de la masa musculoesquelética, la fuerza muscular y su
funcionabilidad (13).
Los mecanismos detrás de la sarcopenia son multifactoriales, involucran factores intrínsecos
como: desequilibrio entre la síntesis proteica y el catabolismo de proteínas, alteraciones hormonales,
inflamación crónica, condiciones neurodegenerativas, factores genéticos, depósitos ectópicos de grasas y
disfunción mitocondrial (12,15,16). Así
también factores exógenos, por ejemplo, las deficiencias nutricionales y la inactividad física. Si bien
es cierto que la sarcopenia es un proceso paralelo a la edad, un mal estilo de vida podría eventualmente
acelerar este proceso (8,12,14).
Un estudio transversal realizado en Portugal con un total de 3493 adultos mayores (1166 hombres,
2327 mujeres) evidenció que una disminución de la masa y fuerza muscular genera 1.65 a 2.2 más de riesgo
de ser físicamente dependiente. (17,18)
Por otro lado, una reducción en la masa y fuerza muscular conlleva a una afectación en la
función locomotora del sistema musculoesquelético, predisponiendo a alteraciones en la glicemia y
niveles de lípidos sanguíneos, particularmente en estados de obesidad (19).
Existe evidencia científica que con tan solo 2 semanas de inactividad física (650- 1000 pasos al
día), como la que sucede en escenarios de reposos absolutos u hospitalizaciones, puede ocasionar cambios
importantes a nivel muscular. Lo que conlleva a la instauración de la resistencia a la insulina y un
riesgo aumentado de desarrollar diabetes mellitus tipo 2, tanto en gente joven como adulta mayor.
(20).
Por consiguiente, la sarcopenia impacta negativamente también a nivel económico, ya que aumenta
los costos al sistema de salud debido agudizaciones o complicaciones de morbilidades, además de un
riesgo mayor de hospitalizaciones (13), considerándose así un problema de
salud pública (8).
EL MÚSCULO COMO ÓRGANO ENDOCRINO
El musculo es altamente vascularizado y posee habilidades para secretar mioquinas (22). Durante la actividad física y el ejercicio, se dan contracciones
repetitivas las cuales generan una adaptación de las células musculares, fortaleciendo sus propiedades
contráctiles y metabólicas. Esta actividad contráctil es la clave para la producción y liberación de
mioquinas (11). Estos péptidos no solo participan en la regulación de la
demanda energética, sino que además aportan beneficios para la salud cardiovascular, metabólica y mental
(23).
Las mioquinas regulan la función y adaptación muscular en la oxidación, hipertrofia y
angiogénesis (7). Además, son los canales de comunicación entre el músculo y
diferentes órganos (23). Dicho sea de paso, dos de las principales
consecuencias positivas de este vínculo molecular entre los tejidos son: a) disminución de la
inflamación sistémica y con esto reducción de la sarcopenia y la acumulación de grasa visceral, y b)
mayor sensibilidad a la insulina (23).
Se han identificado más de 650 mioquinas (5). A continuación, se
mencionarán algunas de las más relevantes y sus implicaciones en las enfermedades crónicas.
Interleucina-6 (IL-6):
Originalmente esta interleucina fue considerada como una citoquina proinflamatoria, sin embargo, en años
recientes estudios han demostrado sus propiedades antiinflamatorias (11,24). La contracción muscular inducida por la actividad física genera un
aumento en la expresión genética y liberación de la IL-6 por el miocito (6,23), contribuyendo a la homeostasis de la glucosa (8). Los niveles plasmáticos de IL-6 pueden incrementarse hasta 100 veces,
dependiendo del volumen, intensidad y densidad del ejercicio físico (6,23).
Algunos de los órganos diana para la IL-6 circulante son el hígado, páncreas y el tejido
adiposo. La IL-6 optimiza la viabilidad de las células β del páncreas, mejora la sensibilidad a la
insulina y favorece la lipólisis en el tejido graso (7,22).
Además, se ha visto que estimula la glucogenólisis hepática, la glucogénesis y la liberación de glucosa
(7,11).
Por otro lado, esta mioquina, mediante una vía alternativa, promueve la activación de
macrófagos, los cuales están involucrados en la protección contra la inflamación y resistencia a la
insulina secundaria a la obesidad (7).
Inmediatamente después de realizar ejercicio físico, la IL-6 liberada, aumenta
significativamente los niveles de IL-10 y del receptor antagonista de interleucina 1 (ILI-ra). Estos
cambios se caracterizan por tener un efecto antiinflamatorio (6,11).
Un dato muy interesante es que, este efecto antiinflamatorio es más evidente en ciertas
condiciones patológicas, especialmente en las cuales las citoquinas inflamatorias y la PCR se encuentran
de 2 a 3 veces por encima de sus niveles basales, tales como: aterosclerosis, diabetes tipo II, obesidad
e insuficiencia cardiaca (6).
En suma, la IL-6 mejora el control glicémico, favorece la pérdida de grasa, suprime el
crecimiento tumoral y colabora en el mantenimiento de la masa muscular (7).
Interleucina 15 (IL-15):
En los seres humanos esta interleucina es capaz de expresarse en varias células y tejidos, incluyendo el
sistema musculoesquelético, células epiteliales, monocitos y células dentríticas (9). Es liberada a nivel muscular principalmente posterior al ejercicio físico
de fuerza y resistencia (2,9).
La IL-15 se ha caracterizado por sus propiedades anabólicas en el músculo esquelético (6,11), su habilidad para inducir hipertrofia se ha demostrado
a través de la reducción en la degradación proteica en sarcopenia y caquexia, destacando así este poder
terapéutico (6,11). Otro dato interesante que reafirma este
concepto, es que los niveles plasmáticos de IL-15 descienden con la edad, estudios reportan que las
personas adultas mayores con sarcopenia tienen niveles significativamente inferiores de esta mioquina
(9).
Paralelamente, se ha visto que la IL-15 inhibe el factor de necrosis tumoral α (TNF-α) en el
músculo durante los estados de caquexia. Aunado a esto, una disminución de esta citoquina se ha asociado
con enfermedades autoinmunes como artritis reumatoidea y leucemia (6).
Miostatina:
Fue la primera mioquina identificada, a pesar de que en su época de descubrimiento no era llamada una
mioquina (7). La función principal de la miostatina es regular negativamente
la masa muscular (7,11). Se puede decir que esta citoquina es
“inversa” comparada con las otras citoquinas musculares, ya que tanto el ejercicio aeróbico, de fuerza
y/o de resistencia, disminuyen considerablemente su expresión en los miocitos (9,11). La ablación de la misma genera hipertrofia muscular, acrecienta la
fuerza muscular y mejora la arquitectura ósea (24).
Pacientes con insuficiencia cardiaca y cáncer poseen niveles altos de esta proteína, lo que
podría eventualmente resultar en caquexia. Sin embargo, durante la actividad física estos niveles
disminuyen, lo que ilustra el beneficio anti catabólico en este tipo de pacientes (6,9). El mismo resultado se observa en los pacientes con
enfermedad renal crónica (9).
La miostatina ha recibido nueva atención debido a su potencial para el tratamiento de síndrome
metabólico, ya que los niveles de esta sustancia se encuentran elevados en pacientes con diabetes tipo 2
y mujeres con obesidad (7).
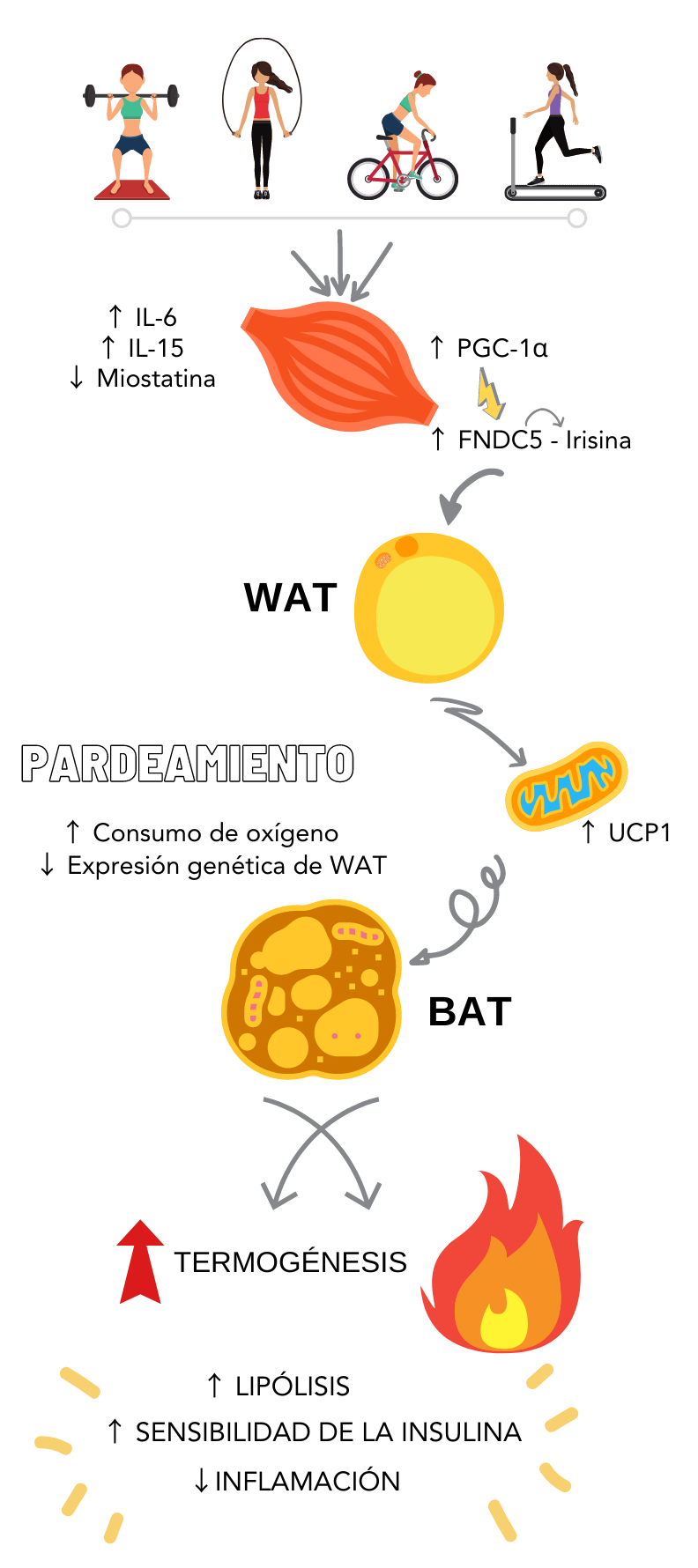
Músculo- tejido adiposo e irisina:
Un tejido que mantiene una estrecha “comunicación” con el músculo, es el adiposo. El tejido adiposo está
constituido por 2 tipos de grasa: la grasa blanca y la grasa parda. La blanca almacena el exceso de
energía y secreta innumerables sustancias proinflamatorias, es decir, en términos generales se podría
decir que es metabólicamente no favorable. En cambio, la grasa parda es beneficiosa (22), ya que tiene la capacidad de regular la termogénesis debido a su alta
concentración de mitocondrias (6), dicho de otra forma, consume la energía
acumulada y por ende se disminuyen los niveles de los triglicéridos (22).
La comunicación músculo- tejido adiposo durante las contracciones musculares provoca:
disminución de la adiposidad, aumento de la termogénesis debido a incrementos en la actividad
adrenérgica, pardeamiento del tejido graso blanco y aumento en la lipolisis. (6,22) Este proceso de
pardeamiento, se da principalmente por la mioquina llamada irisina, la cual se une a un receptor en los
adipocitos, propiciando la modificación fenotípica de la grasa y con ello un aumento en el gasto de
energía. Este efecto termogénico es mediado por la expresión de una proteína desacoplante presente en
las mitocondrias, también conocida como termogenina, o UCP1 (por sus siglas en inglés) (6) La figura 1 resume de manera clara el proceso.
Adicionalmente, se ha reportado que protege la función pancreática, mediante el estímulo de la
proliferación de las células β del páncreas y la protección ante la apoptosis (24). La producción de la irisina es mayor en el músculo cardiaco que en el
esquelético. Sin embargo, el ejercicio aeróbico, favorece su expresión genética, generando un aumento a
nivel plasmático (9).
Por otro lado, se han documentados diversos estudios tratando de demostrar si los niveles de
irisina aumentan más significativamente con entrenamiento aeróbico versus el anaeróbico. Sin embargo,
existen discrepancias entre estas evidencias, lo que se explica por la técnica utilizada para medir los
niveles séricos de irisina. Aún así, hay evidencia científica contundente que ambos tipos de ejercicio
pueden aumentar la irisina circulante (25).
Músculo- cerebro:
La actividad física representa una de las estrategias más efectivas para reducir la prevalencia e
incidencia de depresión, deterioro cognitivo, trastornos neurodegenerativos (1). Paralelamente, tiene un impacto positivo en el estrés y la ansiedad
(5).
El ejercicio influencia el hipocampo más que a cualquier otra estructura anatómica del cerebro
(5), mediante numerosas mioquinas incluidas: catepsina B, irisina, factor
neurotrófico derivado del cerebro (BDNF), factor de crecimiento fibroblástico 21 (FGF-21), la cuales
juegan un papel importante en la interacción músculo-cerebro (22, 26). Las mismas, pueden mediar
funciones neurológicas como: el desarrollo cognitivo, la memoria, la neuroplasticidad, la coordinación
motora, el sueño, el estado de ánimo (26), la capacidad de aprendizaje y la
memoria (24). A su vez, brindan neuroprotección y disminución de la
inflamación cerebral (26).
Uno de los beneficios destacados del ejercicio físico es la inducción central y periférica del
BDNF (26), el cual juega un papel dominante en esta interacción músculo-
cerebro (5). BDNF es un factor de crecimiento que pertenece a la familia de la
neurotrofinas, las cuales velan por la supervivencia neuronal y la plasticidad sináptica (11, 26).
Es importante señalar que pacientes portadores de la enfermedad de Alzheimer, con depresión,
obesidad y diabetes tipo 2, poseen niveles de BDNF séricos reducidos (11).
El factor de crecimiento insulínico tipo 1 (IGF-1), principalmente producido por el hígado, es
capaz de cruzar la barrera hematoencefálica y actuar como mediador de los cambios atribuibles a la
actividad física en la neurogénesis del hipocampo y la expresión del BDNF. La formación y mantenimiento
de las espinas dentríticas a nivel de las neuronas del hipocampo, en condiciones basales, dependen del
BDNF inducido por el PGC-1α (coactivador 1α del receptor activado gamma del proliferador del peroxisoma)
posterior al ejercicio. En el tejido neuronal, el PGC-1α es un potente supresor de las especies de
oxígeno reactivo (ROS), esto explica su efecto neuroprotector (26).
Músculo- cáncer:
Estudios epidemiológicos sugieren que la actividad física realizada en tiempos de ocio reduce el riesgo
de padecer de 13 tipos diferentes de cáncer (5). Personas que son físicamente
activas posterior a su diagnóstico de cáncer de próstata, de colón y de mama tienen un mayor índice de
supervivencia que los sedentarios con el mismo tipo de neoplasias (5).
El ejercicio estimula las células NK (asesinas naturales), las cuales rigen un papel central en
reducir el crecimiento tumoral. Además, las IL-6 y IL-5 regulan la maduración y redistribución de estas
células NK (7).
EJERCICIO FÍSICO: PREVENCIÓN Y TRATAMIENTO
Dado los efectos antiinflamatorios de las mioquinas en respuesta al ejercicio físico, es claro que la
inactividad física conlleva a la inflamación y al aumento los depósitos de tejido adiposo (26).
De hecho, se ha establecido claramente la asociación entre la inactividad física y la grasa
visceral, la cual es más inflamatoria que la subcutánea, conlleva a una inflamación crónica sistémica
que predispone a aterosclerosis, dislipidemia, resistencia a la insulina, neurodegeneración, anemia y
degeneración muscular. Estas patologías a su vez son factores que provocan sedentarismo. La falta de
movimiento genera más inflamación y esto sigue abriendo camino a más enfermedades crónicas,
estableciéndose un ciclo vicioso crónico (5).
Dado lo anterior, es más que claro, que el ejercicio físico ayuda a mejorar la composición
corporal en individuos con sobrepeso u obesidad. (6). Además se disminuye la
grasa visceral, lo que incluye a la grasa pericárdica (5). Es evidente que la
estrategia terapéutica para la sarcopenia sigue siendo el ejercicio físico. Y con ello se obtienen
beneficios adicionales: incremento de la fuerza, aumento de la tasa metabólica basal, diminución la
presión arterial y optimización en los niveles de lípidos sanguíneos. (12)
Es preciso señalar que durante décadas se ha hablado de la importancia del ejercicio aeróbico.
Sin embargo, recientemente se ha demostrado que la actividad física que involucra fuerza y resistencia
puede ser igual de efectivo para la reducción de morbilidades y la optimización de la salud (18).
En vista de lo anterior, diferentes modalidades de ejercicio han sido demostrados para la
disminución de la presión arterial. Estudios respaldan que todo tipo de entrenamiento ya sea aeróbico, o
anaeróbico (resistencia y fuerza), o bien, la combinación de ellos, son igualmente efectivos para
reducir la presión en personas con hipertensión arterial (27).
Profundizando aún más con lo expuesto en el párrafo anterior, y a pesar de que el ejercicio
cadiovascular es el más recetado para este tipo de pacientes, los beneficios del ejercicio de fuerza
como el levantamiento de pesas, o la combinación de ejercicio aeróbico y de resistencia, son similares o
hasta incluso superiores en la disminución de la presión arterial. Se han registrado reducciones de: 8.7
mmHg en ejercicios cardioasculares, 7.2 mmHg en resistencia y 13.5 mmHg en la combinación de ambas
(27).
Hay evidencia respaldando que el ejercicio regular, aún sin una pérdida importante de peso,
desciende los niveles de leptina. Similarmente, el ejercicio agudo intenso reduce los niveles
circulantes de las adipocinas proinflamatorias estrechamente ligadas con la resistencia insulínica y la
obesidad. Por consiguiente, el ejercicio físico brinda beneficios a los individuos con hipertensión
arterial, así como también otras enfermedades crónicas, secundario a los efectos positivos generados por
el aumento en las mioquinas y reducción en las adipocinas durante y posterior al entrenamiento (27).
Por otro lado, la respuesta sistémica ante las mioquinas es mayor después del ejercicio físico
con un mayor grado de rompimiento de fibras como por ejemplo en los entrenamientos de resistencia,
corrida en cuestas hacia abajo y ejercicios excéntricos. De igual manera, se ha visto una elevación
importante en los niveles de mioquinas posterior a un entrenamiento de larga duración y de intensidad
vigorosa y mucho menos pronunciado en la actividad física de moderada intensidad (7).
La actividad física impacta la homeostasis de la glucosa y de los lípidos, alterando la
composición de las fibras musculares. Específicamente los entrenamientos de fuerza y resistencia
favorecen el crecimiento del tejido muscular, y a su vez aumenta la capacidad oxidativa y glicolítica de
las fibras rápidas. Está documentado científicamente que diabéticos con régimen de ejercicio de
resistencia han mejorado su sensibilidad a la insulina. Así mismo, pacientes en estado de obesidad al
ganar masa muscular, incrementan su tasa metabólica basal (28).
En fin, el mejor camino para mantener el sistema musculoesquelético saludable es aumentando y
manteniendo una buena masa muscular mediante el ejercicio físico, y con ello no solo se garantiza
longevidad, sino también calidad de vida (9). Además, la ciencia cada vez es
más reafirma que el ejercicio físico es efectivo no solo como prevención sino también como tratamiento
médico para diferentes enfermedades crónicas (23).
CONCLUSIÓN
La actividad muscular es crucial para la salud y el bienestar físico-mental. Recientemente, con el descubrimiento de las mioquinas, el músculo se ha visto involucrado en el mantenimiento de la homeostasis metabólica y cognitiva. Si la función endocrina del músculo no es lo suficientemente estimulada con el ejercicio físico, la producción de mioquinas necesarias para el funcionamiento óptimo de los órganos no sería la adecuada, generando como consecuencia el desarrollo de enfermedades. El conocimiento sobre las citoquinas liberadas por el músculo en respuesta al ejercicio físico, es de ayuda clave para la prescripción del ejercicio de manera individualizada y a la medida de cada paciente para el tratamiento de enfermedades asociadas con el sedentarismo.
Contribuciones de autoría: Los autores participaron en la génesis de la idea, diseño de
proyecto, recolección e interpretación de datos, análisis de resultados y preparación del
manuscrito del presente trabajo de investigación.
Financiamiento: Autofinanciado.
Conflicto de intereses: Los autores declaran no tener conflicto de interés.
Recibido: 16 de agosto 2021
Aprobado: 22 de noviembre 2021
Correspondencia: Amelia Vargas Pacheco
Dirección: San José, Costa Rica. Hospital La California.
Teléfono: +506 88826960
Correo: doctora.ame@gmail.com
REFERENCIAS
