ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2021 - Universidad Ricardo Palma10.25176/RFMH.v22i1.4333
Exploración de la Relación de la Calidad del Sueño en Pacientes con Retinopatía Diabética, Villahermosa Tabasco.
Exploration of the Relationship of Sleep Quality in Patients with Diabetic Retinopathy, Villahermosa Tabasco.
Tirsa Abisag Espinoza-Anguiano 1,a, GJ Avilés-Rodriguez 2,b,José Ricardo Espinoza-Vargas 3,c.
1.Práctica privada.
2.Universidad Autónoma de Baja California, Ensenada, Baja California Norte México.
3.Servicio de Oftalmología del Centro de Especialidades Médicas Dr. Julian A. Manzur Ocaña ISSET, Villahermosa Tabasco, México.
a. Maestría en salud pública esp. cuidado preventivo.
b. Facultad de Ingeniería, Arquitectura y Diseño. Cuerpo académico de telemática.
c. Cirujano Oftalmólogo.
RESUMEN
Introducción: En las últimas décadas, ha habido una creciente evidencia que sugiere que dormir muy poco o demasiado se asocia con resultados adversos para la salud,incluida la diabetes tipo 2. Existe una estrecha asociación entre la diabetes y la retinopatía diabética (RD), por lo que es razonable suponer que el sueño también puede tener asociaciones con la RD. Objetivo: Explorar la interacción entre la percepción de la calidad del sueño y el grado de retinopatía diabética en pacientes con Diabetes Mellitus tipo 2 atendidos en un servicio de atención oftalmológica de 3er nivel. Resultados: Se encontraron correlaciones significativas en las variables de: Presión Arterial Diastólica y Sistólica (0.429), Triglicéridos y Colesterol Total (0.707), HbA1c y Glicemia (0.561), ESS Score y Edad (0.394), ESS Score y Peso (0.365), Stop Bang y Edad (0.317), Stop Bang y Peso (0.579), Stop Bang y ESS Score (0.452), ISI Score y Stop Bang (0.460). Aunque el tamaño de muestra reducido limitó los resultados en las asocioaciones por subgrupos en el estudio, se puede apreciar una tendencia hacia la elevación del ESS score en el subgrupo de pacientes que reportaron dormir 8 horas o más. Conclusiones: Aunque las tendencias no son estadísticamente significativas, los autores consideran que este hallazgo es congruente con el estado del arte en el tema de sueño y condición metabólica de pacientes diabéticos retinópatas (tendencia elevación de ESS score reportado en el subgrupo de 8 o más horas de sueño), será necesario explorar con más detalle y en una mayor cantidad de pacientes éste fenómeno.
Palabras Clave: Sueño; somnolencia; diabetes mellitus; retinopatía diabética (fuente: DeCS BIREME).
ABSTRACT
Introduction: In recent decades, there has been growing evidence suggesting that too little or too much sleep is associated with adverse health outcomes, including type 2 diabetes. There is a close association between diabetes and diabetic retinopathy (DR), so it is reasonable to assume that sleep may also have associations with DR. Objective: To explore the relationship between the perception of sleep quality and the degree of diabetic retinopathy in patients with type 2 Diabetes Mellitus treated at a 3rd level ophthalmological care service. Results: Significant correlations were found in: diastolic and systolic blood pressure (0.429), triglycerides and total cholesterol (0.707), glycosylated hemoglobin (HbA1c) and glycemia (0.561), Epworth sleepiness scale (ESS Score) and age (0.394) , ESS Score and weight (0.365), extended STOP questionnaire (Stop Bang) and age (0.317), Stop Bang and weight (0.579), Stop Bang and ESS Score (0.452), insomnia severity index (ISI Score) and Stop Bang (0.460). Although the reduced sample size limited the results in the associations by subgroups in the study, a trend towards an elevation of the ESS score can be seen in the subgroup of patients who reported sleeping 8 hours or more. Conclusions: Although the trends are not statistically significant, the authors consider that this finding is congruent with the state of the art on the subject of sleep and metabolic condition of retinopathic diabetic patients (increased trend of ESS score reported in the subgroup of 8 or more hours sleep), it will be necessary to explore this phenomenon in more detail and in a larger number of patients.
Keywords: Sleep, Sleepiness, Diabetes Mellitus, Diabetic Retinopathy (fuente: MeSH NLM).
INTRODUCCIÓN
El sueño es un fenómeno bioconductual que está regulado por procesos circadianos, homeostáticos y neurohormonales (1).De los efectos de la duración del sueño se puede desprender un factor altamente significativo: la percepción del individuo sobre su calidad del sueño, es decir la valoración sobre si el tiempo que durmió produjo un efecto reparador.
La falta de sueño ejerce efectos nocivos en las vías metabólicas, endocrinas e inmunes (1). En las últimas décadas, ha habido una creciente evidencia que sugiere que dormir muy poco y demasiado se asocia con resultados adversos para la salud, incluida la mortalidad total (2,3), enfermedades cardiovasculares, (3,5-7), diabetes tipo 2 (8), hipertensión (3,9), y trastornos respiratorios, obesidad en niños y adultos (10), y mala salud autoevaluada (11).
La incapacidad para mantener un patrón de sueño normal puede implicar más que sentirse cansados al día siguiente, ya que el control metabólico, la producción de glucocorticoides y el control de la glucosa en sangre se ven afectados (12). En los últimos años, se ha demostrado cada vez más que la duración y calidad del sueño subóptimas (secundario a los cambios que exige una sociedad moderna de 24 horas) está significativamente asociado con diabetes mellitus, resistencia a la insulina (RI) y pobre control glicémico (13-15).
Los mecanismos que relacionan la duración del sueño corta o larga con la prevalencia y la gravedad de la RD no se comprenden completamente, aunque se pueden hacer algunas postulaciones. La privación del sueño puede ser perjudicial con respecto a la RD, ya que se ha asociado con un aumento de los niveles de grelina y leptina (que aumenta el hambre y disminuye la saciedad, e inclina el balance energético hacia el exceso (16), así como la resistencia a la insulina y un peor control glucémico (14,15).
Un estado proinflamatorio inducido por la privación del sueño es otra posible explicación, ya que los biomarcadores inflamatorios también se han relacionado con la RD (17,18). Por el contrario, la interrupción del sueño puede ser una consecuencia de la RD. Se demostró que los niveles de melatonina durante la noche estaban alterados (19). Además, la duración prolongada del sueño puede favorecer la hipoxia retiniana, ya que durante la oscuridad los fotorreceptores de bastón consumen grandes cantidades de energía mediante el mantenimiento de corrientes oscuras, lo que aumenta la tensión de oxígeno retiniana (20). Se ha sugerido que la desaturación nocturna de oxígeno puede inducir la expresión del factor de crecimiento del endotelio vascular (21), que se sabe que promueve la RD.
La presente investigación tiene como objetivo explorar la relación entre la percepción de la calidad del sueño y el grado de retinopatía diabética en pacientes con Diabetes Mellitus tipo 2 atendidos en un servicio de atención oftalmológica.
MÉTODOS
Tipo y diseño del estudio
Se realizó un estudio transversal de correlación en un centro oftalmológico especializado en México.
Población y muestra
Se trabajó con pacientes mayores de 18 años con diagnóstico de DM que asisten a la consulta del Servicio de Oftalmología del Centro de Especialidades Médicas Dr. Julian A. Manzur Ocaña ISSET, en la ciudad de Villahermosa, Tabasco, México en el período comprendido de 15 de marzo a 15 de abril del 2021.
Variables e instrumentos
El diagnóstico de diabetes fue definido por una glicemia en ayuno mayor de 126 mg/dl (7,0 mmol/L) (22), autoreporte del diagnóstico, diagnóstico previo en expediente electrónico, uso de medicamentos hipoglucemiantes o insulina.
Con respecto a la evaluación de RD: el exámen oftalmológico incluyó agudeza visual por cada ojo separado usando la cartilla de Snellen de 11 líneas con optotipos de letras (categorizado desde 20/20 a no percepción de luz NPL) (23); biomicroscopía con lámpara de hendidura, presión intraocular con tonómetro integrado(SL-D701 Topcon) y exámen de fondo de ojo bajo dilatación pupilar con revisión de vítreo y retina periférica.
El diagnóstico de RD fue evaluado durante la fondoscopia y se consideró presente o ausente según los criterios y consenso de la Escala Internacional de Severidad de la Retinopatía y del Edema Macular Diabético (24) y que ha sido asumida por la Academia Americana de Oftalmología. Se consideraron los siguientes niveles de severidad:
1. Sin retinopatía aparente (NRD) donde no se encuentran alteraciones clínicamente aunque puede haber hallazgos por angiografía
2. RD no proliferativa leve (RDNPL) donde existen microaneurismas presentes.
3. RD no proliferativa moderada(RDNPM) se agrega cualquier lesión además de los microaneurismas (hemorragias en mancha o flama, exudados algodonosos, edema,tortuosidad de los vasos)
4. RD no proliferativa severa (RDNPS) presenta cualquiera de lo siguiente: Más de 20 hemorragias retinianas en cada uno de los 4 cuadrantes, tortuosidad venosa en 2 o más cuadrantes, anormalidades microvasculares intraretinianas en uno o más cuadrantes.
5. RD proliferativa (RDP) donde se presenta neovascularización y/o hemorragia vítrea o preretiniana.
Previa consulta con el servicio de oftalmología y para fines estadísticos de nuestro estudio se realizó la siguiente recategorización:
Categoría 1: NRD y RDNPL (nula o mínima intervención).
Categoría 2: RDNPM y RDNPS (intervención con láser).
Categoría 3: RDP (intervención quirúrgica y/o con antiangiogénicos).
Con respecto a las entrevistas y cuestionarios relacionados al sueño: se recolectaron en forma directa y verbal por el investigador las variables relacionadas con el sueño aplicando las siguientes encuestas validadas en español.
La escala de somnolencia de Epworth (ESE) es ampliamente utilizada para la evaluación subjetiva de la somnolencia; es útil para evaluar la propensión a quedarse dormido en ocho situaciones, en su mayoría monótonas y algunas más soporíferas que otras. El sujeto responde cada reactivo en una escala de 0-3, donde 0 significa nula probabilidad de quedarse dormido y 3 alta probabilidad. La suma de las calificaciones en cada reactivo proporciona la calificación total, con un rango de 0-24. Una puntuación total menor de 10 es considerada normal, 10-12 como indicativa de somnolencia marginal y por arriba de 12 sugestiva de somnolencia excesiva (25).
El cuestionario STOP consiste en cuatro preguntas que evalúan la presencia de ronquido intenso, somnolencia diurna o fatigabilidad, apneas presentadas durante el sueño e hipertensión arterial. En el modelo extendido, STOP-Bang, se incorporan cuatro parámetros adicionales: edad, género, índice de masa corporal y circunferencia cervical. Las respuestas a las preguntas de ambos cuestionarios fueron diseñadas en un formato simple Si/No y las puntuaciones fluctúan entre 0 y 4 u 8 puntos, respectivamente. Se identifica a los sujetos con riesgo elevado de Síndrome de apnea/hipoapnea obstructiva del sueño (SAHOS) cuando se responden afirmativamente al menos dos (STOP) o tres (STOP-Bang) preguntas (26).
El índice de severidad del insomio (ISI) es un autoinforme que evalúa la percepción del sueño en relación con el desempeño diurno. Comprende cinco reactivos sobre la gravedad del trastorno del inicio del dormir, el mantenimiento del sueño y los problemas para despertar en la mañana, así como la interferencia del funcionamiento diurno y el grado de insatisfacción con el patrón actual de sueño.
En la versión de cada uno de los 5 ítems se evalúa en una escala de 5 puntos que consiste en: “0 = nada; 1 = un poco; 2 = algo; 3 = mucho; 4 = muchísimo”. Con un resultado de 0 a 28.
En el caso de la versión de Sierra JC (27), este instrumento fue desarrollado con el objetivo de crear un cuestionario breve para evaluar la gravedad de los componentes diurno y nocturno del insomnio. Está compuesto por 7 ítems que evalúan la naturaleza, gravedad y el impacto del insomnio. Se responde con una escala tipo LIKERT que va de 0 a 4, teniendo en cuenta el último mes.
Para su corrección se obtiene una puntuación total que oscila entre 0 y 28. Los puntos de corte propuestos de la versión original son:
- 0-7: no insomnio
- 8-14: insomnio por debajo del umbral
-15-21: insomnio clínico de gravedad moderada
-22-28: insomnio clínico grave (18).
Además de los datos recabados en las encuestas se aplicó un cuestionario con los siguientes ítems: edad (en años), género (masculino-femenino), horas de sueño (número de horas),años de evolución de diabetes, nivel de educación (ninguna, primaria, secundaria, preparatoria, universidad), tabaquismo (ausente-presente) uso de insulina (si-no),diagnóstico de hipertensión (si-no y cuantos años de evolución) y tratamiento farmacológico de la misma (si-no),así como procedimientos anteriores por cada ojo.
Con respecto a la evaluación de otros biomarcadores: la presión arterial se midió en mm/hg usando un baumanómetro digital (Omron HEM 6123), peso y altura usando una báscula de pared (Hergom Medical) el índice de masa corporal (IMC) fue determinado usando la fórmula: peso entre la edad en metros cuadrados (kg/m2) y obesidad fue definido como un IMC mayor a 27.5 kg/m2.
Los valores de colesterol total(mg/dl), triglicéridos(mg/dl) y HbA1c (%) fueron tomados de los reportes más recientes del expediente electrónico.
Procedimientos
Se realizó la encuesta en los pacientes durante su atención en consultorio, previa aplicación del consentimiento informado. El examen físico y la evaluación oftalmológica se realizaron durante esta atención. El resto de exámenes fueron recogidos de las historias clínicas. Todos los datos fueron recolectados una vez los participantes hayan dado su consentimiento informado.
Análisis estadístico
Los análisis estadísticos fueron hechos utilizando el lenguaje estadístico R, versión 4.0.3 (28). Las variables categóricas fueron evaluadas con Chi cuadrada y aquellas numéricas con test de Kruskal-Wallis para comparar las características clínicas y demográficas de los participantes entre categorías de interés. Para las variables con diferencias estadísticamente significativas, se realizaron análisis post-hoc usando la prueba de rangos pareados de Wilcoxon. Posteriormente se procedió a realizar análisis de correlación en las variables numéricas por coeficiente de correlación de Pearson y visualizaciones de las distribuciones de los datos por severidad de retinopatía diabética y variables estadísticamente significativas en los pasos previos estratificadas por cantidad de horas de sueño.
Aspectos éticos
Se solicitó el consentimiento informado de cada uno de los participantes para poder ser parte de esta investigación. Se respetaron las convenciones internacionales contenidas en la Declaración de Helsinki.
RESULTADOS
Se incluyeron un total de 50 participantes en el análisis; 2% (n=1) con DM tipo 1, con DM tipo 2 48%(n=49). Segun sexo: 48% (n=24) femeninos y 52%(n=26) masculinos. La edad media n(SD) fue de 58.7 (10.1) años. La edad promedio de duración de la DM fue de 15 años. Peso promedio: 75 kg (16.1) Altura promedio: 1,60 mtr. Las categorías de RD quedaron como sigue: Categoría 1: 24 (48,0%); Categoría 2: 16 (32,0%); Categoría 3: 10 (20,0%) La media de la duración del sueño (DS) fue de 7,94 hrs. El 6%(n=3) 40%(n=20), 54% (n=27) tuvo corta, normal, o larga DS respectivamente; el grado de educación más frecuente fue secundaria 36% (n=18); uso de insulina en 32% (n=16); tabaquismo presente 7,4% (n=2); triglicéridos totales promedio: 257[77.0, 1200 mg/dl] mg/dl. Colesterol total promedio: 209 mg/dl [110,506 mg/dl]. Glicemia promedio 170,5mg/dl [71,474 mg/dl]. Presión arterial sistólica: 131mmHg (19,2mmHg); presión arterial diastólica 78,0mmHg (12,2mmHg ); HbA1c promedio: 8,29% (2,76%) (Tabla 1).
Tabla 1. Características clínicas y demográficas de los participantes de estudio
| Total (N=50) | |
|---|---|
| Edad | |
| Media (SD) | 58.7 (10.1) |
| Mediana [Min, Max] | 58.0 [26.0, 86.0] |
| Género | |
| Femenino | 24 (48.0%) |
| Masculino | 26 (52.0%) |
| Duración de Diabetes | |
| Media (SD) | 15.0 (9.00) |
| Mediana [Min, Max] | 15.0 [1.00, 35.0] |
| Uso de Insulina | |
| Ausente | 34 (68.0%) |
| Presente | 16 (32.0%) |
| Peso | |
| Media (SD) | 75.0 (16.1) |
| Mediana [Min, Max] | 72.3 [49.0, 125] |
| Colesterol | |
| Media (SD) | 209 (65.2) |
| Mediana [Min, Max] | 200 [110, 506] |
| Missing | 5 (10.0%) |
| Triglicéridos | |
| Media (SD) | 257 (194) |
| Mediana [Min, Max] | 199 [77.0, 1200] |
| Missing | 8 (16.0%) |
| HbA1c | |
| Media (SD) | 8.29 (2.76) |
| Mediana [Min, Max] | 7.43 [4.30, 13.5] |
| Missing | 18 (36.0%) |
| Altura en Metros | |
| Media (SD) | 1.60 (0.0864) |
| Mediana [Min, Max] | 1.59 [1.43, 1.80] |
| Grado de Retinopatía | |
| Categoría 1 | 24 (48.0%) |
| Categoría 2 | 16 (32.0%) |
| Categoría 3 | 10 (20.0%) |
| Presión.arterial.SISTÓLICA | |
| Media (SD) | 131 (19.2) |
| Mediana [Min, Max] | 130 [80.0, 180] |
| Presión.arterial.DIASTÓLICA | |
| Media (SD) | 78.0 (12.2) |
| Mediana [Min, Max] | 80.0 [50.0, 110] |
Otros procedimientos previos reportados: Resección de pterigión, cirugía de catarata, aplicación de antiangiogénicos, Yag láser, Argón láser, vitrectomía.
Otras condiciones oculares agregadas encontradas: Glaucoma primario de ángulo abierto, glaucoma neovascular, edema macular, catarata, pterigión.
Otras condiciones no oculares reportadas: hemodiálisis, diálisis peritoneal, cardiopatía y anemia. De los procedimientos previos reportados y otras condiciones oculares agregadas mencionadas no presentaron relevancia estadística en las exploraciones de inicio.
Las características clínicas y demográficas de los participantes en el estudio estratificadas por la duración de sueño se muestran en la Tabla 2.
Tabla 2. Características clínicas y demográficas de los participantes en el estudio estratificadas por la duración de sueño
| < 6h (N=3) | 6 ≤ h < 8 (N=20) | ≥ 8h (N=27) | p-value | |
|---|---|---|---|---|
| Género | ||||
| Femenino | 1 (33.3%) | 12 (60.0%) | 11 (40.7%) | 0.434 |
| Masculino | 2 (66.7%) | 8 (40.0%) | 16 (59.3%) | |
| Edad | ||||
| Media (SD) | 62.0 (10.5) | 59.5 (12.8) | 57.9 (7.70) | 0.806 |
| Mediana [Min, Max] | 63.0 [51.0, 72.0] | 55.5 [26.0, 86.0] | 58.0 [43.0, 74.0] | |
| Horas de sueño | ||||
| Media (SD) | 5.00 (0) | 6.60 (0.503) | 9.26 (1.02) | <0.001 |
| Mediana [Min, Max] | 5.00 [5.00, 5.00] | 7.00 [6.00, 7.00] | 9.00 [8.00, 11.0] | |
| Estudios | ||||
| Preparatoria | 2 (66.7%) | 1 (5.0%) | 6 (22.2%) | 0.208 |
| Secundaria | 1 (33.3%) | 6 (30.0%) | 10 (37.0%) | |
| Ninguna | 0 (0%) | 1 (5.0%) | 0 (0%) | |
| Primaria | 0 (0%) | 6 (30.0%) | 5 (18.5%) | |
| Universidad | 0 (0%) | 6 (30.0%) | 6 (22.2%) | |
| Tabaquismo | ||||
| Ausente | 3 (100%) | 20 (100%) | 25 (92.6%) | 0.576 |
| Presente | 0 (0%) | 0 (0%) | 2 (7.4%) | |
| Duración de Diabetes | ||||
| Media (SD) | 17.0 (6.25) | 13.9 (9.08) | 15.6 (9.36) | 0.829 |
| Mediana [Min, Max] | 15.0 [12.0, 24.0] | 14.5 [1.00, 32.0] | 15.0 [1.00, 35.0] | |
| Uso de Insulina | ||||
| Ausente | 2 (66.7%) | 12 (60.0%) | 20 (74.1%) | 0.72 |
| Presente | 1 (33.3%) | 8 (40.0%) | 7 (25.9%) | |
| Peso | ||||
| Media (SD) | 65.2 (6.53) | 75.2 (14.9) | 76.0 (17.6) | 0.471 |
| Mediana [Min, Max] | 63.0 [60.0, 72.5] | 74.0 [53.0, 116] | 72.0 [49.0, 125] | |
| Glicemia | ||||
| Media (SD) | 143 (57.7) | 174 (77.0) | 190 (89.9) | 0.52 |
| Mediana [Min, Max] | 110 [109, 210] | 161 [71.0, 361] | 191 [87.5, 474] | |
| Colesterol | ||||
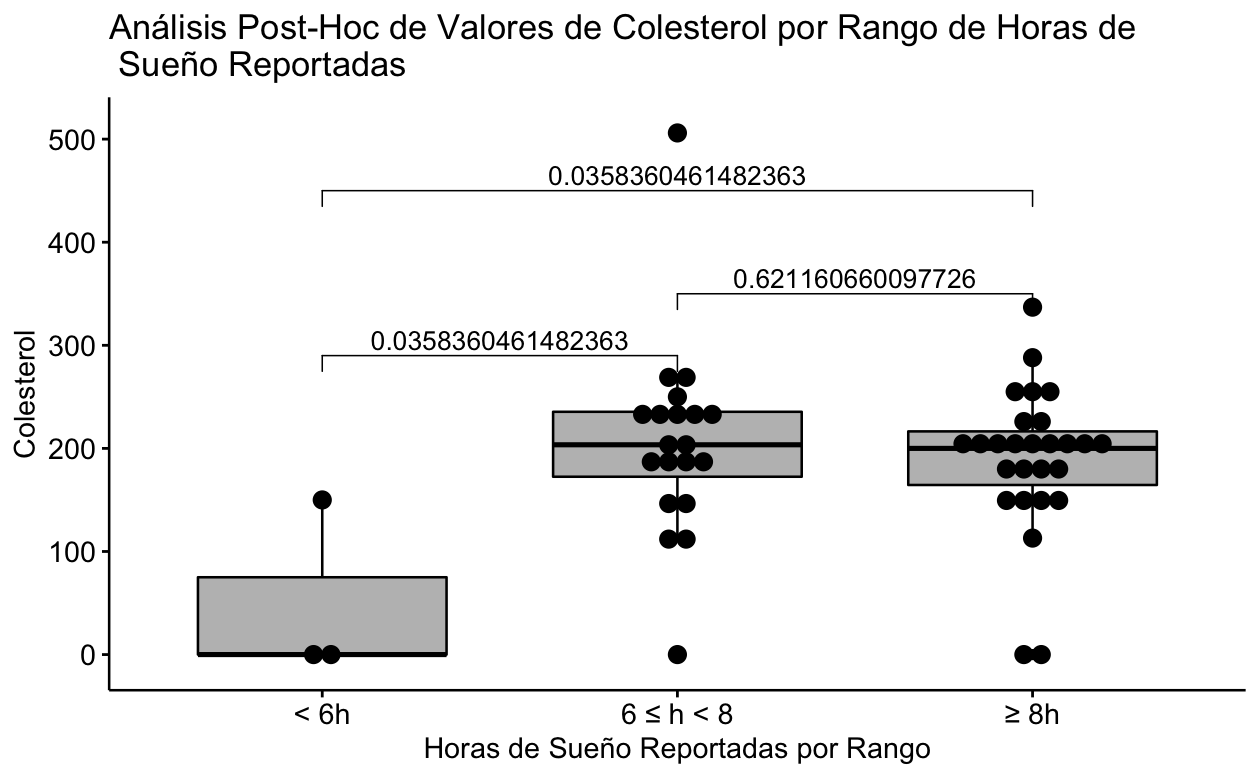
| Media (SD) | 50.0 (86.6) | 206 (95.1) | 190 (71.5) | 0.0482 |
| Mediana [Min, Max] | 0 [0, 150] | 204 [0, 506] | 200 [0, 337] | |
| Triglicéridos | ||||
| Media (SD) | 50.0 (86.6) | 258 (254) | 202 (154) | 0.12 |
| Mediana [Min, Max] | 0 [0, 150] | 184 [0, 1200] | 179 [0, 641] | |
| HbA1c | ||||
| Media (SD) | 4.73 (4.96) | 4.05 (4.54) | 6.30 (4.51) | 0.241 |
| Mediana [Min, Max] | 4.30 [0, 9.90] | 2.50 [0, 11.5] | 6.20 [0, 13.5] |
Se puede observar claramente que la diferencia estadísticamente significativa se debe a que el subgrupo que reportó dormir menos de 6 horas solo contiene 3 pacientes y de éstos solo 1 tiene el valor de Colesterol presente, por lo que la diferencia significativa es espúrea (Fig 1).
Tabla 3. Características de los participantes estratificada por categoría de severidad de retinopatía diabética
| Categoría 1 (N=24) |
Categoría 2 (N=16) |
Categoría 3 (N=10) |
p-value | |
|---|---|---|---|---|
| Género | ||||
| Femenino | 15 (62.5%) | 6 (37.5%) | 3 (30.0%) | 0.166 |
| Masculino | 9 (37.5%) | 10 (62.5%) | 7 (70.0%) | |
| Edad | ||||
| Media (SD) | 57.9 (10.3) | 59.8 (9.70) | 59.1 (10.9) | 0.895 |
| Mediana [Min, Max] | 56.5 [26.0, 76.0] | 59.0 [46.0, 86.0] | 58.5 [43.0, 76.0] | |
| Horas.de.sueño | ||||
| Media (SD) | 8.08 (1.82) | 7.75 (1.65) | 7.90 (1.60) | 0.877 |
| Mediana [Min, Max] | 8.00 [5.00, 11.0] | 7.00 [5.00, 10.0] | 8.50 [5.00, 10.0] | |
| Estudios | ||||
| Preparatoria | 5 (20.8%) | 2 (12.5%) | 2 (20.0%) | 0.504 |
| Primaria | 7 (29.2%) | 3 (18.8%) | 1 (10.0%) | |
| Secundaria | 5 (20.8%) | 8 (50.0%) | 4 (40.0%) | |
| Universidad | 7 (29.2%) | 2 (12.5%) | 3 (30.0%) | |
| Ninguna | 0 (0%) | 1 (6.2%) | 0 (0%) | |
| Tabaquismo | ||||
| Ausente | 23 (95.8%) | 16 (100%) | 9 (90.0%) | 0.691 |
| Presente | 1 (4.2%) | 0 (0%) | 1 (10.0%) | |
| Duración de Diabetes | ||||
| Media (SD) | 11.1 (7.59) | 20.3 (8.41) | 15.9 (9.23) | 0.00917 |
| Mediana [Min, Max] | 8.50 [1.00, 26.0] | 19.0 [3.00, 35.0] | 16.0 [1.00, 35.0] | |
| Uso de Insulina | ||||
| Ausente | 18 (75.0%) | 9 (56.2%) | 7 (70.0%) | 0.527 |
| Presente | 6 (25.0%) | 7 (43.8%) | 3 (30.0%) | |
| Peso | ||||
| Media (SD) | 75.9 (19.0) | 73.8 (13.4) | 74.6 (13.5) | 0.974 |
| Mediana [Min, Max] | 72.0 [49.0, 125] | 73.8 [55.0, 94.0] | 74.5 [56.0, 98.0] | |
| Glicemia | ||||
| Media (SD) | 167 (90.7) | 206 (79.6) | 171 (64.1) | 0.212 |
| Mediana [Min, Max] | 128 [71.0, 474] | 197 [82.0, 364] | 140 [87.5, 257] | |
| Colesterol | ||||
| Media (SD) | 197 (47.3) | 222 (91.5) | 218 (57.6) | 0.392 |
| Mediana [Min, Max] | 200 [110, 337] | 211 [114, 506] | 227 [113, 288] | |
| Missing | 1 (4.2%) | 2 (12.5%) | 2 (20.0%) | |
| Triglicéridos | ||||
| Media (SD) | 217 (133) | 346 (291) | 233 (123) | 0.184 |
| Mediana [Min, Max] | 179 [77.0, 641] | 263 [108, 1200] | 200 [93.0, 413] | |
| Missing | 1 (4.2%) | 4 (25.0%) | 3 (30.0%) | |
| HbA1c | ||||
| Media (SD) | 8.06 (3.18) | 9.44 (2.19) | 6.75 (1.83) | 0.127 |
| Mediana [Min, Max] | 6.25 [4.30, 13.5] | 9.90 [5.50, 12.4] | 6.50 [5.00, 10.1] | |
| Missing | 9 (37.5%) | 5 (31.2%) | 4 (40.0%) | |
| horasRango | ||||
| < 6h | 1 (4.2%) | 1 (6.2%) | 1 (10.0%) | 0.877 |
| 6 ≤ h < 8 | 9 (37.5%) | 8 (50.0%) | 3 (30.0%) | |
| ≥ 8h | 14 (58.3%) | 7 (43.8%) | 6 (60.0%) |
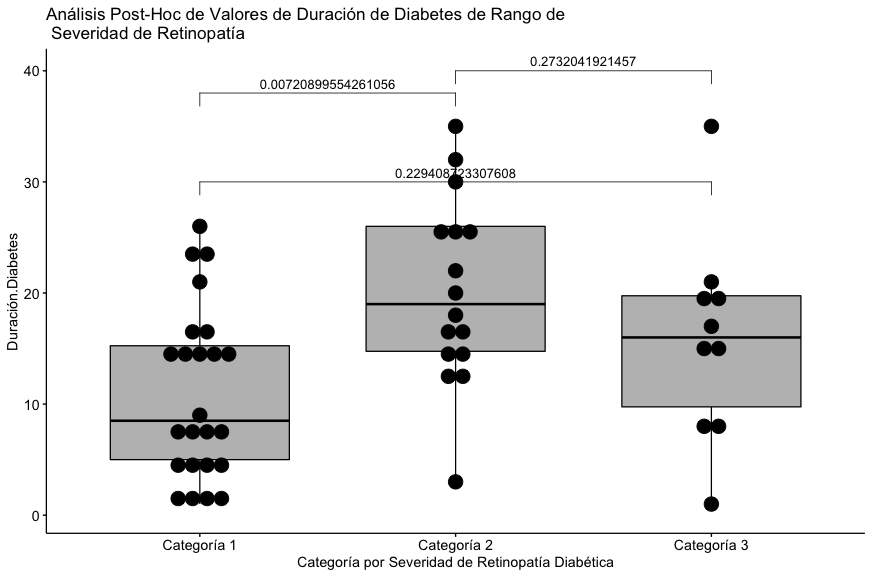
Se puede apreciar que la diferencia estadísticamente significativa se encuentra en el par representado por las categorías 1 y 2 con respecto a duración reportada de la diabetes.
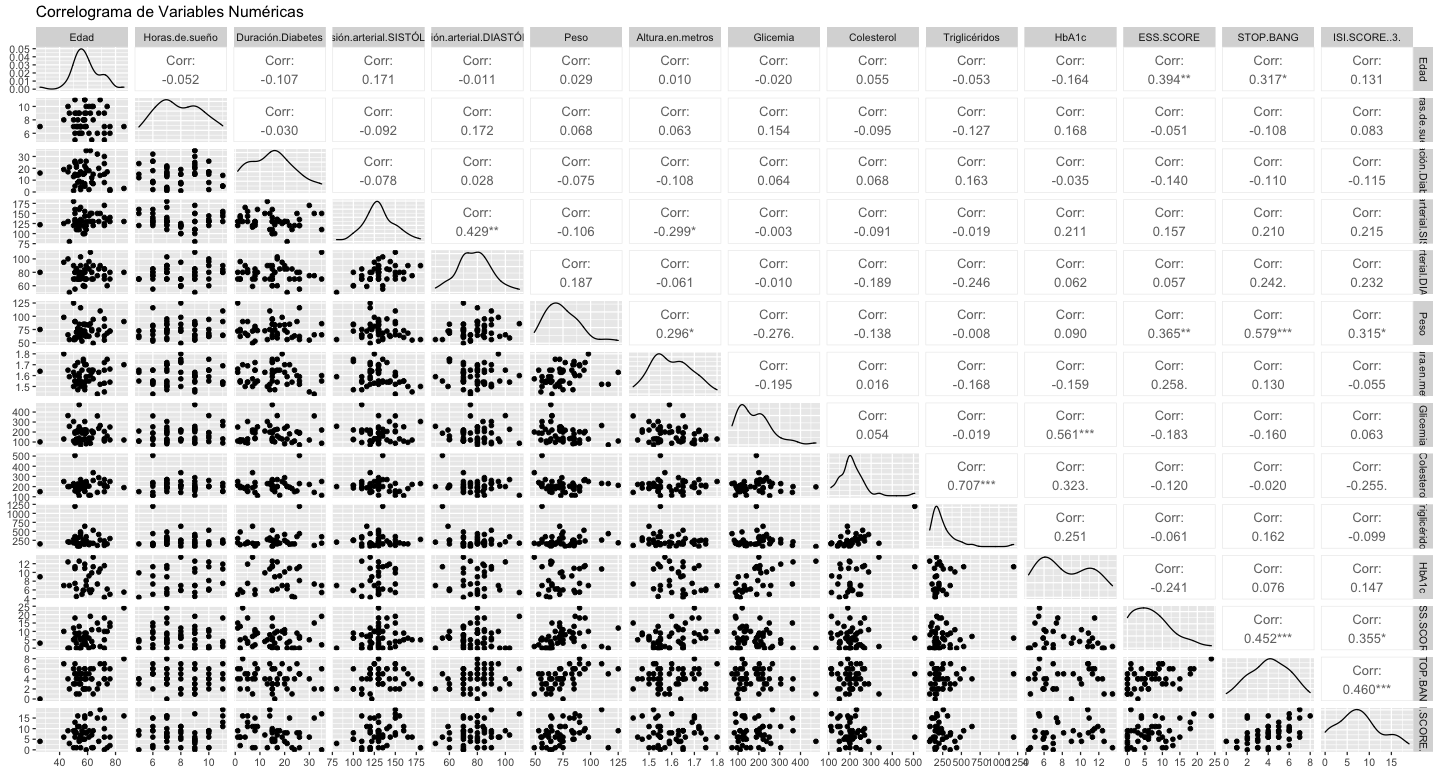
Las correlaciones significativas se mencionan a continuación: Presión Arterial Diastólica y Sistólica (0.429), Triglicéridos y Colesterol Total (0.707), HbA1c y Glicemia (0.561), ESS Score y Edad (0.394), ESS Score y Peso (0.365), Stop Bang y Edad (0.317), Stop Bang y Peso (0.579), Stop Bang y ESS Score (0.452), ISI Score y Stop Bang (0.460) (Fig. 3).
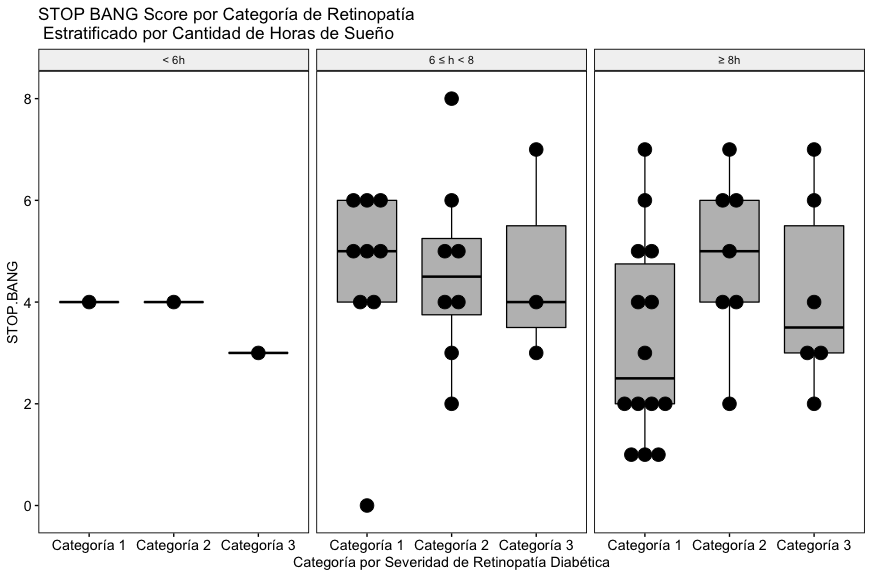
Como se puede apreciar en la Fig. 4A, con los datos incluidos en este estudio no se aprecia una relación entre la severidad de la retinopatía diabética, las horas de sueño reportadas y el score global de Stop Bang.
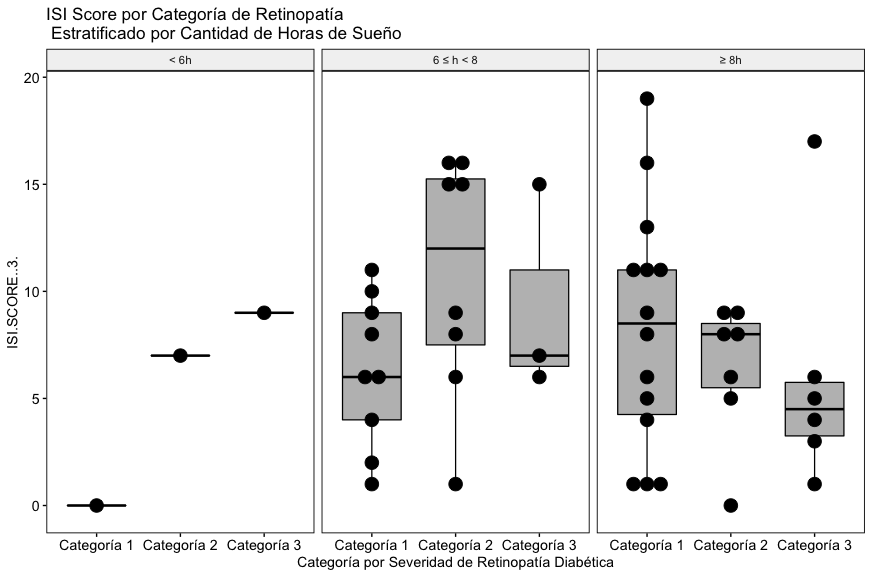
En los resultados, como sucede con el Stop Bang score, con los datos incluidos en este estudio no se aprecia una relación entre la severidad de la retinopatía diabética, las horas de sueño reportadas y el score global ISI (Fig. 4B).
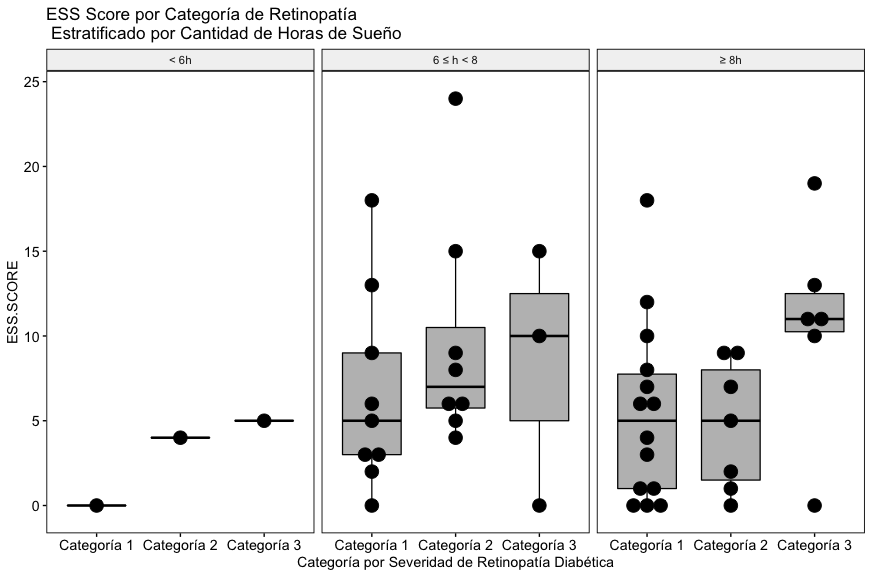
A diferencia de los otros dos scores, en éste caso se puede apreciar una tendencia hacia la elevación del ESS score en el subgrupo de pacientes que reportaron dormir 8 horas o más (Fig. 4C), aunque la tendencia no es estadísticamente significativa, los autores consideran que este hallazgo es congruente con el estado del arte en el tema de sueño y condición metabólica de pacientes diabéticos retinópatas, será necesario explorar con más detalle y en una mayor cantidad de pacientes éste fenómeno.
DISCUSIÓN
Para los fines de nuestro estudio: la calidad y cantidad del sueño, indirectamente evaluada por la somnolencia diurna reportada por los pacientes (Score ESS) muestra una tendencia a elevarse en aquellos que reportaron rangos de sueño fuera de los fisiológicamente apropiados (≥ 8 hrs), podemos también encontrar características de la población consistentes con la realidad clínica estudiada, como las correlaciones directamente proporcionales entre los niveles séricos reportados de triglicéridos y el colesterol total, la HbA1c y glicemias séricas reportadas, el score ESS y edad y peso, el score Stop Bang y edad y peso, el score Stop Bang y el score ESS así como el score ISI y el Stop Bang. A pesar de los hallazgos en estas correlaciones, los resultados numéricos no alcanzan a ser congruentes con ellas, los autores consideran que este fenómeno se debe a lo limitado de la muestra poblacional del estudio. En trabajos futuros se buscará robustecer el tamaño de la población para mejorar el universo de muestra en busca de clarificar los resultados.
Nuestro estudio explora una realidad clínica en pacientes diabéticos retinópatas latinoamericanos consistente con la literatura científica que ha explorado y reportado hallazgos similares en poblaciones de otras regiones geográficas en el mundo. Dado que, hasta el conocimiento que los autores tienen del tema, este es el primer estudio de estas características realizado en una población concreta latinoamericana, llama la atención que las tendencias observadas en los resultados son congruentes con lo reportado por otros autores en otras regiones geográficas mundiales.
Un buen control de la glucosa en sangre y otros factores de riesgo sistémicos como la hipertensión y la hiperlipidemia son el objetivo principal para la prevención de las complicaciones oculares en la diabetes mellitus. Los autores consideran importante integrar la evaluación de la calidad del sueño en el paciente diabético retinópata para robustecer la estrategia de atención, en colaboración con expertos de medicina de estilo de vida.Los datos sugieren que la optimización de la duración y la calidad del sueño debe probarse como una intervención para mejorar el control de la glucosa en pacientes con diabetes tipo 2.
Las limitaciones del estudio radican principalmente en el reducido tamaño de la muestra, lo que podría limitar la potencia estadística para encontrar algunas asociaciones. Sin embargo, dada la naturaleza del estudio, los resultados son de gran importancia. Como trabajo a futuro, los autores proponen aumentar el tamaño de muestra significativamente, así como los subgrupos en la misma representante de los intervalos de horas de sueño reportadas.
CONCLUSIÓN
Aunque las tendencias no son estadísticamente significativas, los autores consideran que este hallazgo es congruente con el estado del arte en el tema de sueño y condición metabólica de pacientes diabéticos retinópatas (tendencia elevación de ESS score reportado en el subgrupo de 8 o más horas de sueño), será necesario explorar con más detalle y en una mayor cantidad de pacientes éste fenómeno.
Agradecimiento
Los autores desean agradecer las facilidades prestadas para la realización de este estudio a los médicos del Servicio de Oftalmología del Centro de Especialidades Médicas Dr. Julian A. Manzur Ocaña ISSET, Villahermosa Tabasco, México.
Dr. José de Jesús Larios Muñoz. Jefe del departamento.
Dr. Daniel Osvaldo Montaño López.
Dr. Carlos Zaldivar Ponce.
Contribuciones de Autoría: Los autores participaron en la génesis de la idea, diseño de proyecto, recolección e interpretación de datos, análisis de resultados y preparación del manuscrito del presente trabajo de investigación.
Financiamiento: Autofinanciado.
Declaración de conflictos de intereses:Los autores reportan no tener conflictos de interés de algún tipo para los fines de este estudio.
Recibido: 26 de octubre de 2021
Aprobado: 7 de diciembre de 2021
Correspondencia: Dra. Tirsa Abisag Espinoza Anguiano.
Dirección: Av. 27 de febrero 1028 Col. Centro Villahermosa Tabasco, México.
Teléfono: 9931312887
Email: tirsa_espinoza @hotmail.com
Referencias