ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2022 - Universidad Ricardo Palma10.25176/RFMH.v22i4.4616
VALORES CRÍTICOS PARA HEMOGRAMAS AUTOMATIZADOS Y FROTIS DE SANGRE PERIFÉRICA
CRITICAL VALUES FOR AUTOMATED HEMOGRAMS AND PERIPHERAL BLOOD SMEARS
Huerto JL1,a, Villaorduña AM1,a
1Servicio de Hematología, Hemoterapia y Banco de Sangre, Hospital Nacional Alberto Sabogal Sologuren, Callao, Perú
aMédico cirujano, especialidad en patología clínica.
RESUMEN
Objetivo:El reporte de valores críticos se considera una práctica necesaria en los laboratorios de patología clínica, pues su comunicación inmediata determina decisiones terapéuticas que pueden salvar vidas. La elección de los valores críticos y el modo en que son reportados debe ser una decisión conjunta entre los especialistas del laboratorio y los profesionales clínicos de cada establecimiento de salud, ya que deben integrarse a la dinámica de los servicios involucrados. Entre los valores críticos que se han escogido para esta revisión hemos incluido parámetros cuantitativos, cuyo procesamiento se ejecuta en analizadores hematológicos automatizados, y hallazgos morfológicos en los frotis de sangre periférica, lo cuales son evaluados por profesionales capacitados.
Palabras Clave: Patología; Sangre; Citología; Laboratorios; Microscopía(fuente: DeCS BIREME).
ABSTRACT
Objective:The report of critical values is considered a necessary practice in clinical pathology laboratories, since its immediate communication determines therapeutic decisions that can save lives. The choice of critical values and the way in which they are reported must be a joint decision between the laboratory specialists and the clinical professionals of each health facility, since they must be integrated into the dynamics of the services involved. Among the critical values that have been chosen for this review, we have included quantitative parameters, whose processing is carried out in automated hematology analyzers, and morphological findings in peripheral blood smears, which are evaluated by trained professionals.
Keywords: Pathology; Blood, Cytology; Laboratories; Microscopy (Source: MeSH NLM).
INTRODUCCIÓN
Los valores críticos, en patología clínica, se definen como resultados que reflejan amenazas inminentes para las vidas de los pacientes, a menos que se administren medidas terapéuticas adecuadas y oportunas (1). Estos resultados suelen alejarse mucho de los límites superiores o inferiores de los rangos “normales”. Por lo tanto, no debe caerse en el error de considerar “crítico” a todo resultado que escape de los valores de referencia, es decir, los valores esperados en individuos sanos (1). La diferencia crucial entre un valor crítico y un valor anormal es que, en el primer caso, el resultado indica un peligro apremiante para la vida del paciente.
Asimismo, debe hacerse una distinción clara entre valores críticos y valores vitales. Estos últimos son “valores que representan un estado fisiopatológico tan diferente del normal como para poner en peligro la vida y para los que se pueden tomar medidas correctivas, pero para los que una acción rápida no es tan crucial (2).” Como vemos, un valor vital es tan importante como un valor crítico, pero la inmediatez de su reporte no es tan decisiva.
En la actualidad, los laboratorios clínicos tienen la responsabilidad prioritaria de determinar y comunicar sus propios valores críticos, definidos según la complejidad de cada servicio, el tipo de usuarios que atiende, los recursos disponibles y el perfil epidemiológico local. La práctica efectiva del reporte de valores críticos implica una disminución en la mortalidad y la morbilidad de los sistemas de salud, así como una reducción en los costos derivados de complicaciones y daños prevenibles (3).
En los laboratorios de hematología, existe una falta de consenso acerca de qué resultados deben considerarse críticos, así como discrepancias en la terminología y los mecanismos de reporte (4). Aunque la selección de valores críticos le compete a cada servicio de patología clínica, consideramos pertinente proponer una lista de resultados (exponiendo, para cada uno, las razones que justifican su selección) que sirva como punto de partida para que otros laboratorios definan o perfeccionen sus propios procesos de reporte de valores críticos.
VALORES CRÍTICOS PARA HEMOGRAMAS AUTOMATIZADOS
Hemoglobina menor a 7 g/dL
Se ha investigado la mortalidad de pacientes post-operados que rechazaron las transfusiones de paquete globular por motivos religiosos. Estos estudios han concluido que los niveles de hemoglobina entre 7 g/dL y 8 g/dL se asocian a un bajo riesgo de mortalidad, mientras que los niveles por debajo de 6 g/dL se asocian a niveles extremadamente altos de mortalidad (5-7). El sangrado (38.5%), la falla respiratoria (35.9%), la falla renal (28.2%), la sepsis (20.5%) y el infarto cardíaco (12.8%) fueron las principales causas de muerte para estos pacientes (6).
Asimismo, la más reciente guía de práctica clínica de la AABB (American Asociation of Blood Banks) recomienda un umbral de hemoglobina de 7 g/dL para indicar transfusión de paquetes globulares en pacientes hemodinámicamente estables (8).
Hemoglobina mayor a 22 g/dL y hematocrito mayor a 65% en neonatos
Un hematocrito mayor a 65% o un nivel de hemoglobina por encima de 22 g/dL definen la policitemia neonatal: una elevación anormal en la masa de eritrocitos circulantes que genera hiperviscosidad sanguínea (9-11). La hiperviscosidad, en el neonato, se asocia con una irrigación disminuida a órganos como el cerebro, el corazón, los pulmones y el intestino. La hipoperfusión resultante puede suscitar condiciones potencialmente letales, como hipoxia sistémica, hipoglicemia, enterocolitis necrotizante, convulsiones y otros síntomas neurológicos (10). Aunque el manejo óptimo para neonatos con policitemia no ha sido estandarizado, la exanguinotransfusión suele estar indicada; sin embargo, esta decisión sigue siendo controversial (10-11).
Hematocrito mayor a 65% en cardiópatas
En pacientes con cardiopatías congénitas cianóticas, la principal complicación hematológica consiste en un incremento en el hematocrito y la concentración de hemoglobina. Estos cambios son secundarios a la producción de eritropoyetina a nivel renal, que, a su vez, es inducida por la hipoxemia (12). La eritropoyetina estimula la producción de hematíes en la médula ósea, provocando una eritrocitosis en sangre periférica. Este aumento en la cantidad de eritrocitos circulantes produce un incremento en la viscosidad sanguínea, la cual puede condicionar estasis y bloqueo de los capilares. Los síntomas de hiperviscosidad suelen aparecer cuando el hematocrito supera un valor de 65% y se relacionan, especialmente, con un aumento progresivo del hematocrito (13). El síndrome de hiperviscosidad, caracterizado por síntomas neurológicos y cardiopulmonares, puede dar origen a complicaciones potencialmente letales, como infarto cardíaco, eventos tromboembólicos e isquemia en múltiples órganos (14).
Conteo de leucocitos mayor a 100 000/uL
Se define como hiperleucocitosis al recuento de leucocitos mayor a 100 000/uL (15-16). Esta condición, en patologías hematológicas como la leucemia mieloide aguda y la leucemia linfoblástica aguda, puede producir un síndrome de leucostasis. El síndrome de leucostasis está caracterizado por síntomas neurológicos y cardiopulmonares y se considera una emergencia hemato-oncológica. En pacientes con leucemia mieloide aguda, particularmente, la leucostasis se asocia con un pobre pronóstico debido a un alto riesgo de mortalidad temprana y a una gran probabilidad de recidiva y muerte a largo plazo (16). Se ha propuesto la citorreducción rápida por leucoféresis como acción terapéutica en pacientes con leucostasis por leucemia aguda; esta medida ha demostrado reducir la mortalidad temprana en pacientes con leucostasis (17-18).
Conteo de leucocitos mayor a 50 000/uL y conteo de neutrófilos mayor a 30 000/uL en neonatos
Se denomina reacción leucemoide a una leucocitosis persistente mayor a 50 000/uL no asociada a leucemia, siendo sus causas principales las infecciones, intoxicaciones, tumores sólidos, hemorragias severas y hemólisis (19-20). En neonatos, la reacción leucemoide se define por un conteo de leucocitos mayor a 50 000/uL o por un conteo de neutrófilos mayor a 30 000/uL y, en pacientes con bajo peso al nacer, se asocia con afecciones potencialmente letales como sepsis neonatal, hemorragia intraventricular y displasia broncopulmonar (21). La mortalidad por sepsis neonatal se ha estimado entre 11% y 19% (22), y se incrementa significativamente en caso de microorganismos multidrogorresistentes (23). Asimismo, en nuestro medio, la mortalidad por hemorragia intraventricular en neonatos de bajo peso se ha calculado en 47.1% (24).
Conteo de neutrófilos menor a 500/uL
La neutropenia febril, condición definida por un conteo de neutrófilos menor a 500/uL en presencia de fiebre (temperatura mayor a 38°C en dos lecturas consecutivas), es una causa significativa de morbilidad y mortalidad en pacientes oncológicos (25). En pacientes oncológicos adultos, la mortalidad intrahospitalaria asociada con neutropenia febril se ha calculado en 9.5%, aunque los porcentajes son significativamente más altos en pacientes con comorbilidades mayores, infecciones fúngicas y sepsis (26). Asimismo, en pacientes adultos que reciben quimioterapia mielosupresora, la neutropenia febril se asocia con una mortalidad 15% más alta que en pacientes sin neutropenia febril (27), pues condiciona una predisposición a infecciones severas por hongos, bacilos gramnegativos y cocos grampositivos (28).
En pacientes pediátricos que reciben quimioterapia mielosupresora, la neutropenia febril se define por un conteo de neutrófilos menor a 500 u/L o menor a 1 000/uL con un declive pronosticado para los próximos dos días (29). En este grupo de pacientes, la mortalidad intrahospitalaria asociada con neutropenia febril se estima en 5% para infecciones por grampositivos, 18% para infecciones por gramnegativos y porcentajes mayores para infecciones fúngicas (30).
Conteo de plaquetas menor a 10 000/uL
Se define como trombocitopenia al recuento de plaquetas menor a 150 000/uL (31,32). Con frecuencia, los pacientes con plaquetas por encima de 50 000/uL no presentan síntomas o hallazgos clínicos; el sangrado ante traumatismos mínimos o sangrado prolongado en caso de heridas suele aparecer con valores por debajo de 30 000/uL y los eventos de sangrado espontáneo, considerado una emergencia hematológica, se presentan con valores por debajo de 10 000/uL (31-32).
Conteo de plaquetas mayor a 1 000 000/uL
Un valor de plaquetas superior a 1 000 000/uL se asocia con síndrome de Von Willebrand adquirido: la deficiencia de multímeros de factor de Von Willebrand provocada por un aumento en la actividad proteolítica de ADAMTS13 (33). El riesgo de hemorragia, por lo tanto, se incrementa en estas trombocitosis extremas. En pacientes con trombocitemia esencial, un valor de plaquetas mayor a 1 000 000/uL, asociado con historia de sangrados menores y un tiempo de enfermedad mayor a 15 años, se considera un factor de alto riesgo para hemorragia (34). Asimismo, se recomienda moderar o restringir el uso de aspirina en pacientes con trombocitemia esencial que alcanzan niveles de plaquetas por encima de 1 000 000/uL (33-34).
Tabla 1. Valores críticos para hemogramas automatizados.
| VALORES CRÍTICOS PARA HEMOGRAMAS AUTOMATIZADOS | ||
|---|---|---|
| PARÁMETRO | VALORES / HALLAZGOS | INTERPRETACIÓN |
| Hemoglobina | < 7 g/dL | Riesgo de muerte en post-operados. Transfusión recomendada, salvo excepciones. |
| > 22 g/dL | Neonatos: Definición de policitemia. Riesgo de hiperviscosidad. | |
| Hematocrito | > 65% | Síntomas de hiperviscosidad en pacientes cardiópatas. Posible indicación de sangría. Neonatos: Definición de policitemia. Riesgo exponencial de hisperviscosidad en policitemia neonatal. Posible indicación de exanguinotransfusión. |
| Leucocitos | > 100 000/uL | Riesgo de muerte por leucostasis. Posible indicación de leucoféresis. |
| > 50 000/uL (neonatos) | Riesgo de muerte en reacción leucemoide neonatal. | |
| Neutrófilos | < 500/uL | Riesgo de muerte asociado a neutropenia febril. |
| > 30 000/uL (neonatos) | Riesgo de muerte en reacción leucemoide neonatal. | |
| Plaquetas | < 10 000/uL | Riesgo de muerte por sangrado espontáneo. |
| > 1 000 000/uL | Deficiencia adquirida de Factor de von Willebrand, riesgo de hemorragia y contraindicación de aspirina. | |
VALORES CRÍTICOS PARA FROTIS DE SANGRE PERIFÉRICA
Esquistocitos
El International Council for Standardization in Haematology (ICSH), que podemos traducir como Comité Internacional de Estandarización en Hematología, señala que un porcentaje de esquistocitos mayor al 1% del total de hematíes, en ausencia de otras anomalías eritrocitarias severas, tiene importancia clínica para el diagnóstico de anemia hemolítica microangiopática (35). Aunque un porcentaje de esquistocitos mayor a 1% también puede observarse en falla renal, hemoglobinopatías y neonatos, en estos casos suele acompañarse por otros cambios morfológicos eritrocitarios (36).
Una de las anemias hemolíticas microangiopáticas más frecuentes en adultos, la púrpura trombocitopénica trombótica (PTT), tiene una mortalidad cercana al 90% en ausencia de tratamiento (37). Con la introducción del recambio plasmático terapéutico (RPT) en la década de 1980, se logró reducir la mortalidad a valores próximos al 20% (38-39). Debido a la muy alta mortalidad de la PTT sin tratamiento, se considera que el RPT está indicado como procedimiento de emergencia en estos pacientes (39).
Blastos
El hallazgo de blastos en sangre periférica, por sí solo, no implica un riesgo inminente para la vida de los pacientes; no obstante, su identificación y descripción morfológica son cruciales para la toma de decisiones terapéuticas y un retraso en su reporte puede predisponer a daños potencialmente graves. Por este motivo, los blastos se ajustan a la definición de “valores vitales”: resultados tan importantes como los valores críticos, pero para los cuales una acción correctiva inmediata no es indispensable (2). Aunque no existe una recomendación estandarizada para el reporte de valores vitales, se ha reconocido la necesidad de incluirlos como una extensión lógica del sistema de valores críticos (40).
La Clasificación de Tumores Hematopoyéticos y de Tejidos Linfoides de la Organización Mundial de la Salud (OMS) establece un valor de 20% de blastos en sangre periférica o médula ósea para definir leucemia aguda (41). Actualmente, sin embargo, sabemos que existe una notable variabilidad intraindividual (el sujeto es comparado contra sí mismo en diferentes momentos) e interindividual (el sujeto es comparado contra otros) para el reconocimiento microscópico y conteo manual de leucocitos (42-43). Debido a ello, es plenamente posible que un conteo de blastos menor a 20% sea “corregido” en una segunda lectura que arroje un porcentaje por encima de este umbral. Por lo tanto, incluso un porcentaje de blastos por debajo de 20% debería ser reportado, en pacientes sin antecedente de leucemia, con la prontitud que corresponde a un valor vital.
Bacterias
Aunque la tinción Wright, empleada en los frotis de sangre periférica, está diseñada para identificar leucocitos, hematíes y otros elementos celulares, también permite observar microorganismos como bacterias y parásitos. La presencia de bacterias en sangre periférica es reconocida como un factor de muy mal pronóstico y elevada mortalidad en pacientes con sepsis (44-45). Se trata de un hallazgo muy inusual, por lo que debe descartarse una posible contaminación de la muestra con bacterias del catéter venoso central (45).
Hemoparásitos
Como en el caso de los blastos, un reporte oportuno de hemoparásitos en sangre periférica es crucial para la toma de decisiones terapéuticas; asimismo, un retraso en su identificación podría dar lugar a complicaciones graves. En nuestro país, por ejemplo, el diagnóstico oportuno de malaria continúa siendo una prioridad de salud pública. La OMS hace hincapié en el diagnóstico y tratamiento precoz de los pacientes con malaria para reducir las tasas de incidencia y mortalidad (46), labor en la cual los laboratorios clínicos desempeñan un papel preponderante. En tal sentido, se ha comprobado una mejora constante, entre 2012 y 2017, en el desempeño para el diagnóstico microscópico de malaria en los laboratorios especializados del país (47). En este contexto, el Dr. Pedro Legua (48) destaca la importancia del diagnóstico oportuno de malaria y subraya la necesidad de identificar correctamente los casos de Plasmodium falciparum.
Promielocitos anómalos
características morfológicas anormales que aparecen típicamente en sangre periférica y médula ósea de pacientes con leucemia promielocítica aguda (LPA). La OMS reconoce dos tipos morfológicos de LPA: la forma “clásica” o hipergranular y la variante microgranular o hipogranular (49). Adicionalmente, se han descrito otros tipos morfológicos con características propias (50).
Aunque la presentación morfológica de la LPA suele ser heterogénea (50), en todos los casos se asocia con una alta mortalidad temprana que se aproxima al 17.5% (51). Esta elevada tasa de mortalidad se relaciona con el fenómeno de coagulación intravascular diseminada (CID), que condiciona eventos de hemorragia y trombosis (52), siendo la primera causa de muerte por LPA la hemorragia intracraneal (53). Por lo anterior, se recomienda iniciar tratamiento lo antes posible en pacientes con sospecha de LPA, incluso antes de que el diagnóstico se confirme por técnicas moleculares o genéticas (53).
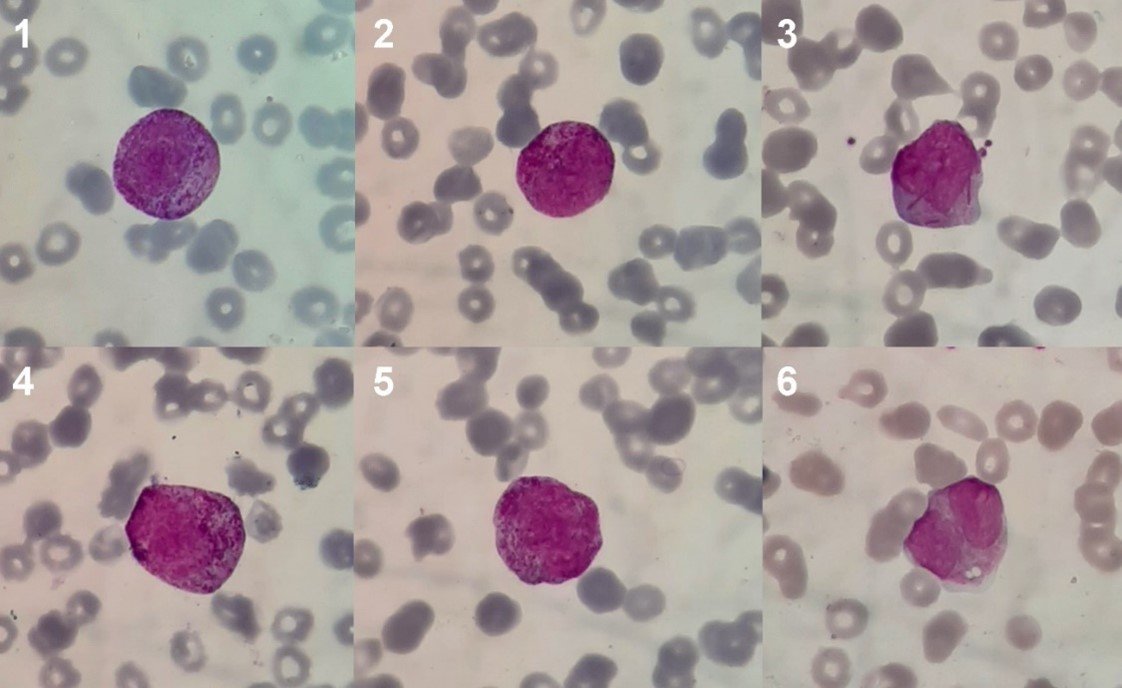
(Aumento: 100x. Coloración: Wright) Microfotografías 1-5: Promielocitos anómalos de tipo morfológico hipergranular. Microfotografía 3: Promielocito hipergranular con múltiples cuerpos de Auer en el citoplasma. Microfotografía 6: Promielocito anómalo de tipo morfológico microgranular o “variante”.
Células plasmáticas
Las células plasmáticas o plasmocitos (Figura 2) son células linfoides de estirpe B que se originan en la médula ósea y cuya función es secretar anticuerpos. Aunque constituyen parte de la población celular normal de la médula ósea, los plasmocitos no suelen encontrarse en la sangre periférica de personas sanas (54). Como veremos, el hallazgo de células plasmáticas en sangre periférica se relaciona, en algunos pacientes, con mal pronóstico y elevada mortalidad.
En pacientes con mieloma múltiple, la presencia de plasmocitos circulantes en sangre periférica se asocia con un pobre curso clínico y escasa sobrevida, así como un incremento en el Sistema de Estadificación Internacional (55). De igual modo, en pacientes con mieloma múltiple, un porcentaje mayor a 5% de células plasmáticas en sangre periférica se considera marcador de enfermedad altamente proliferativa, baja esperanza de vida y pronóstico similar al de la leucemia de células plasmáticas (56). La mortalidad temprana en leucemia de células plasmáticas, aunque ha disminuido durante las últimas décadas, sigue siendo significativamente mayor que en mieloma múltiple (57). Esta entidad se define por un conteo de células plasmáticas mayor al 20% del total de leucocitos en sangre periférica (58) y se considera la neoplasia de plasmocitos más agresiva y con peor pronóstico (59).
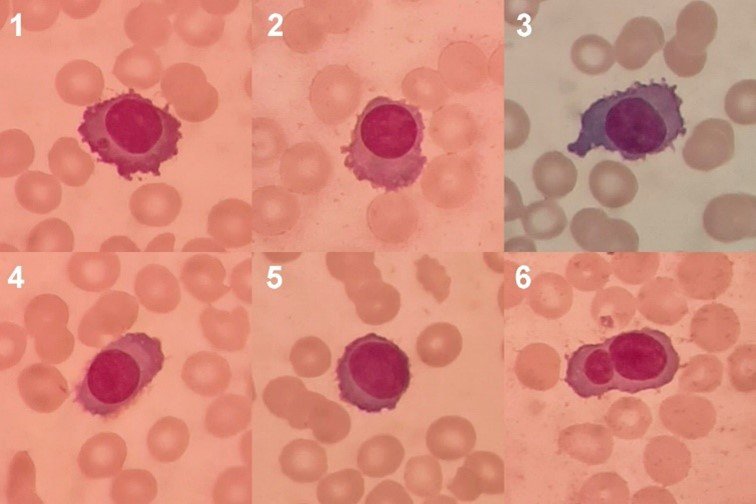
(Aumento: 100x. Coloración: Wright) Microfotografías 1-6: Células plasmáticas con citoplasma intensamente basófilo de borde irregular, prolongaciones citoplasmáticas finas, zona clara perinuclear, núcleo redondo u ovalado de ubicación excéntrica y cromatina cerrada. Microfotografía 1: Se observa una inclusión citoplasmática. Microfotografía 5: Célula plasmática con citoplasma escaso que podría identificarse equivocadamente como un linfocito anómalo. Microfotografía 6: Se observa binucleación.
Tabla 2. Valores críticos para frotis de sangre periférica.
| VALORES CRÍTICOS PARA FROTIS DE SANGRE PERIFÉRICA | ||
|---|---|---|
| PARÁMETRO | VALORES / HALLAZGOS | INTERPRETACIÓN |
| Esquistocitos | > 1% del total de hematíes | Riesgo de muerte por púrpura trombocitopénica trombótica. |
| Blastos | > 20% del total de leucocitos (considerar el reporte de porcentajes inferiores, según correlación clínico-patológica.) | La comunicación inmediata del hallazgo puede evitar daños potencialmente graves. |
| Bacterias | Cualquier cantidad. | Muy mal pronóstico en pacientes con sepsis. |
| Hemoparásitos | Cualquier cantidad en el frotis de sangre periférica. | La comunicación inmediata del hallazgo puede evitar daños potencialmente graves. |
| Promielocitos anómalos | Tipo celular predominante, con escasez de las fases posteriores de maduración granulocítica (mielocito, metamielocito, neutrófilo). Correlación con otros hallazgos en el hemograma y el perfil de coagulación. | Riesgo de muerte por coagulación intravascular diseminada (CID). |
| Células plasmáticas | > 5% del total de leucocitos. | Riesgo de muerte en mieloma múltiple. Un valor por encima del 20% es criterio diagnóstico de leucemia de células plasmáticas, con curso agresivo y mal pronóstico. |
DISCUSIÓN
Una de las consideraciones más importantes para el reporte de valores críticos, en el caso particular del laboratorio de hematología, es que se realice una revisión morfológica correcta y minuciosa en un tiempo prudente. Para la identificación adecuada de algunos elementos celulares y formas anómalas, es imprescindible que un observador experimentado examine los frotis de sangre periférica.
Por ejemplo, en cuanto a la identificación de esquistocitos, el ICSH establece que la morfología es variable (35): deben distinguirse los esquistocitos en medialuna de los drepanocitos (células en hoz) en función del tamaño, que en los esquistocitos siempre es menor que un hematíe; existen esquistocitos con ángulos agudos o “espinas” que lucen como triángulos; las “células en casco”, hematíes dañados con una zona “amputada” reconocible por un borde rectilíneo, se consideran equivalentes de los esquistocitos; los keratocitos, hematíes dañados que aparentan tener un par de “cuernos” separados por un segmento cóncavo, también se consideran equivalentes de los esquistocitos; los microesferocitos, asimismo, deben incluirse en el conteo de esquistocitos, pero solo en presencia de alguna de las formas mencionadas previamente.
La morfología de los promielocitos anómalos de la LPA amerita una mención aparte. Ambos tipos morfológicos mencionados por la OMS, el “típico” o hipergranular y el “variante” o microgranular, presentan características puntuales que diferencian el promielocito anómalo de su contraparte normal (49).
Los promielocitos hipergranulares tienen un citoplasma repleto de gránulos cuyo rango de colores abarca del rosado al purpúreo. Estos gránulos se hallan distribuidos de manera compacta en el citoplasma y, ocasionalmente, se unen o fusionan entre sí (coalescencia); suelen ser comparativamente más grandes que los gránulos de los promielocitos normales y pueden ser tan abundantes que cubren el borde nuclear, oscureciéndolo. Otras veces, los gránulos son muy finos y se ven como una “nube de polvo” en el citoplasma. En muchos casos, los promielocitos anómalos presentan múltiples cuerpos de Auer (inclusiones citoplasmáticas cristalinas de coloración basófila en forma de bastón), los cuales pueden adoptar una distribución en manojo o ramillete. El núcleo del promielocito hipergranular es de tamaño y forma variables, aunque suele ser bilobulado o arriñonado (49-50).
Los promielocitos microgranulares, por el contrario, se caracterizan por una aparente ausencia de gránulos citoplasmáticos y un núcleo que suele ser bilobulado. Sin embargo, no es infrecuente que también se identifique, en la LPA microgranular, un número escaso de promielocitos anómalos con gránulos distinguibles y cuerpos de Auer en ramillete o manojo. Actualmente, sabemos que la aparente carencia de gránulos se debe a que éstos son de tamaño submicroscópico y no pueden apreciarse por microscopía óptica (49-50).
En cuanto a los plasmocitos, por tratarse de células que normalmente no se observan en sangre periférica, debe prestarse atención especial a una correcta identificación morfológica. La célula plasmática normal es ovalada o circular, con citoplasma abundante e intensamente basófilo, una zona clara perinuclear que corresponde al aparato de Golgi, relación núcleo/citoplasma baja y núcleo pequeño, excéntrico, con cromatina cerrada y grumosa. Adicionalmente, en condiciones como el mieloma múltiple, los plasmocitos suelen presentar rasgos atípicos en el tamaño, forma y coloración citoplasmática, distintos tipos de inclusiones, anomalías en el borde nuclear y multinucleación (60).
Por otro lado, cada vez se confiere más importancia a la emisión de comentarios interpretativos en las pruebas de laboratorio; en nuestro país, esta responsabilidad corresponde al médico especialista en patología clínica. Se recomienda, actualmente, que los resultados de laboratorio incluyan una descripción o interpretación de la anomalía, información relevante para el diagnóstico, sugerencias para la ampliación de exámenes e, incluso, una opinión relacionada con el tratamiento (61). La notificación de valores críticos se considera una parte integral del sistema de reportes interpretativos, pues proporciona al clínico información sobre condiciones potencialmente letales y lo insta a tomar medidas terapéuticas rápidas y decisivas.
CONCLUSIONES
El reporte de valores críticos se considera una práctica necesaria en los laboratorios y ha demostrado ser beneficioso en el campo clínico. Para que tengan el impacto deseado, es necesario que se notifiquen con rapidez, que los interprete un profesional capacitado y que conlleven a una pronta toma de decisiones. Asimismo, se recomienda que los valores críticos de cada establecimiento de salud se elijan por consenso entre los profesionales de laboratorio y aquellos que laboran en áreas clínicas.
En el laboratorio de hematología, los valores críticos para hemogramas comprenden una serie de parámetros cuantitativos que, en la mayoría de los casos, son obtenidos directamente del analizador hematológico automatizado; en algunos casos, no obstante, pueden ser corregidos por el profesional de laboratorio mediante un análisis microscópico (conteo de plaquetas, diferencial leucocitario, etc.) o un procedimiento manual (microhematocrito por centrifugación, etc.). En los frotis de sangre periférica, los valores críticos incluyen hallazgos morfológicos anormales que, con frecuencia, requieren la evaluación de profesionales experimentados.
Las recomendaciones propuestas en este artículo pueden servir como base para que otros establecimientos de salud elaboren sus propias listas de valores críticos, considerando que cada servicio de laboratorio debe hacerlo en coordinación con las áreas clínicas interesadas. Asimismo, nuestras recomendaciones pueden emplearse para ampliar las listas de valores críticos en aquellos servicios que ya cuenten con un sistema de notificación para estos resultados.
Contribuciones de Autoría: los autores son los gestores del artículo en su totalidad.
Financiamiento: Autofinanciado.
Conflictos de intereses: Los autores declaran no tener conflicto de interés.
Recibido: 22 de Mayo 2022
Aprobado: 28 de Agosto 2022
Correspondencia: José Luis Huerto.
Dirección: Jr. Colina 1081, Bellavista, Callao. Lima Perú.
Teléfono: 965266908
Email: joluhuag@gmail.com
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS
