ARTÍCULO DE REVISIÓN
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2022 - Universidad Ricardo Palma10.25176/RFMH.v22i2.4730
INTELIGENCIA EN SALUD. UNA ESTRATÉGIA DE ANÁLISIS CRÍTICO PARA LA TOMA DE DECISIONES EN EL ÁREA DE SALUD
INTELLIGENCE IN HEALTH. A CRITICAL ANALYSIS STRATEGY FOR DECISION-MAKING IN THE HEALTH AREA
Franklin Aldecoa Bedoya1,2,a,b, Maritza Placencia Medina3,c
1 Maestría en Medicina, Clínica Internacional San Borja
2 Universidad Peruana de Ciencias Aplicadas – UPC
3 Universidad Nacional Mayor de San Marcos
a Médico Especialista en Oncología Médica.
b Docente de la Facultad de Medicina.
c Doctora en Farmacia y Bioquímica.
RESUMEN
Introducción. El uso de la resonancia magnética preoperatoria (RMP) en pacientes con cáncer de mama es controversial y no existe consenso sobre su beneficio frente a las imágenes estándar. El objetivo de esta revisión, fue evaluar los estudios comparativos de pacientes con cáncer de mama no avanzado, con el uso o no de la RPM. Métodos. Se realizó la búsqueda de artículos médicos publicados desde el 01 de enero del 2000 hasta el 31 de marzo del 2021 en MEDLINE/PUBMED, LILACS y SCIELO y se incluyeron las publicaciones que cumplieron con los criterios de inclusión. Resultados. Hubo 3828 publicaciones, de las cuales 53 cumplieron los criterios de inclusión; se revisaron los artículos seleccionados y se organizaron los resultados en tablas. Hubo 46 estudios retrospectivos y comparativos uni o multicéntricos, tres estudios prospectivos, aleatorizados y controlados y cuatro metaanálisis que incluyeron pacientes con carcinoma ductal o lobular infiltrantes y carcinoma ductal in situ. Los resultados comparativos fueron antagónicos y discutibles, sin embargo, en los estudios más relevantes se demostró que: la RPM retrasa la cirugía; incrementa las mastectomías y las biopsias adicionales; aumenta la detección de enfermedad ipsilateral/contralateral no necesariamente maligna; no se estableció una diferencia significativa en la tasa de recurrencia loco-regional o a distancia. Conclusiones. La RMP en cáncer de mama no avanzado tiene resultados controversiales en relación al tipo de cirugía, reoperaciones y supervivencia libre de progresión, siendo necesario contar con estudios adicionales de tipo prospectivo, multicéntrico, aleatorizado y comparativo que defina claramente su rol y beneficio.
Palabras Clave: Imagen por Resonancia Magnética; Neoplasias de la Mama; Mastectomía Segmentaria; Mastectomía Radical; Reoperación; Recurrencia Local de Neoplasia; Supervivencia sin Enfermedad. (Fuente: DeCS BIREME).
ABSTRACT
Introduction. The use of preoperative magnetic resonance imaging (PMR) in patients with breast cancer is debatable, with little agreement on its usefulness above routine scans. The goal of this study was to assess comparative studies of individuals with non-advanced breast cancer who were treated with or without PMR. Methods. A search was conducted in MEDLINE/PUBMED, LILACS, and SCIELO for medical literature published between January 1, 2000 and March 31, 2021, and publications that satisfied the inclusion criteria were included. Results. There were 3,828 publications, 53 of which matched the inclusion requirements; the papers were examined, and the findings were summarized in tables. There were 46 single or multicenter retrospective and comparative investigations, three prospective, randomized, controlled trials, and four meta-analyses including patients with infiltrating ductal or lobular carcinoma or ductal carcinoma in situ. The comparative results were antagonistic and debatable; however, in the most relevant studies, it was demonstrated that PMR delays surgery; increases mastectomies and additional biopsies; increases detection of ipsilateral/contralateral disease that is not necessarily malignant; and no significant difference in the rate of loco-regional or distant recurrence was established. Conclusion. Conclusions. PMR in non-advanced breast cancer has debatable outcomes in terms of surgery type, reoperations, and progression-free survival, and it is still being studied.
Keywords: Magnetic Resonance Image; Breast Neoplasms; Breast conserving surgery; Radical Mastectomy; Reoperation; Recurrence; Disease-Free Survival. (Source : MeSH - NLM).
INTRODUCCIÓN
La resonancia magnética de mama (RM) con imágenes dinámicas, proporcionan información sobre la
morfología transversal de la lesión, características funcionales, vascularización/perfusión y
permeabilidad; a ello se debe su nomenclatura actual de Imágenes de RM de mama con Realce de Contraste
Dinámico (DCE-MRI)(1-3). La RM de mama ha evolucionado a imágenes de alta
resolución que evalúan múltiples parámetros a diferencia del enfoque inicial convencional, que usó
solamente las secuencias con contraste para evaluar tumores. La interpretación debe hacerse con
radiólogos experimentados en imágenes mamarias, pues como toda tecnología en evolución, la curva de
aprendizaje requiere de un tiempo suficiente, para una mayor de certeza de la información(4).
La sensibilidad de la RM en el carcinoma mamario es del 88 al 100, su especificidad llega al
72(5,6). La RM mamaria está indicada de acuerdo a la European
Society of Breast Imaging en la detección de cáncer de mama en mujeres con alto riesgo, evaluación del
efecto de la quimioterapia neoadyuvante, evaluación de mujeres con implantes mamarios, carcinoma de mama
primario oculto, sospecha de recurrencia local, cuando no se puede realizar biopsia con aguja, en la
resolución de problemas (hallazgos equívocos en la mamografía/ecografía) y en la estadificación
preoperatoria del cáncer de mama recién diagnosticado (ipsilateral y contralateral); sin embargo la
National Comprehensive Cancer Network en su más reciente versión del 2022, coincide con esta guía, en
algunas observaciones: detección de mujeres con un riesgo > 20% de tener un primario de mama en su vida;
agrega al carcinoma oculto de mama, la enfermedad de Paget y el carcinoma lobular invasivo pobremente
definido con otras herramientas; finalmente, la estadificación preoperatoria la pone en categoría 2B
(basados en bajos niveles de evidencia)(7,8).
El uso de imágenes preoperatorias de RM en pacientes con cáncer de mama sigue siendo un tema
controversial y actualmente no hay consenso sobre si confiere beneficio o no, ya que no ha demostrado
ventajas sobre las imágenes estándar. Por ello, necesitamos saber cuál es el beneficio real que alcanzan
las pacientes en relación a la decisión quirúrgica basada en esta herramienta.
MÉTODOS
Criterios de inclusión de los estudios
- Meta-análisis; estudios clínicos prospectivos o retrospectivos, unicéntricos o multicéntricos; estudios clínicos observacionales, retrospectivos, con grupo control, en pacientes con cáncer de mama (invasivo, carcinoma ductal in situ y/o carcinoma lobular o ductal infiltrante), que comparen la RM preoperatoria versus no RM.
- Resultados buscados. Tasas de: tumorectomía o mastectomía, reoperación quirúrgica, recurrencia loco-regional o a distancia, supervivencia libre de enfermedad o progresión y supervivencia global.
Criterios de exclusión de los estudios
- Estudios clínicos que evalúan cáncer de mama con otras histologías diferentes al adenocarcinoma mamario.
- Estudios clínicos que incluyeron pacientes con tratamiento neoadyuvante.
- Estudios clínicos que incluyeron pacientes con metástasis o pacientes con otros cánceres sincrónicos.
- Estudios clínicos anteriores al año 2000.
Localización y selección de los estudios relevantes
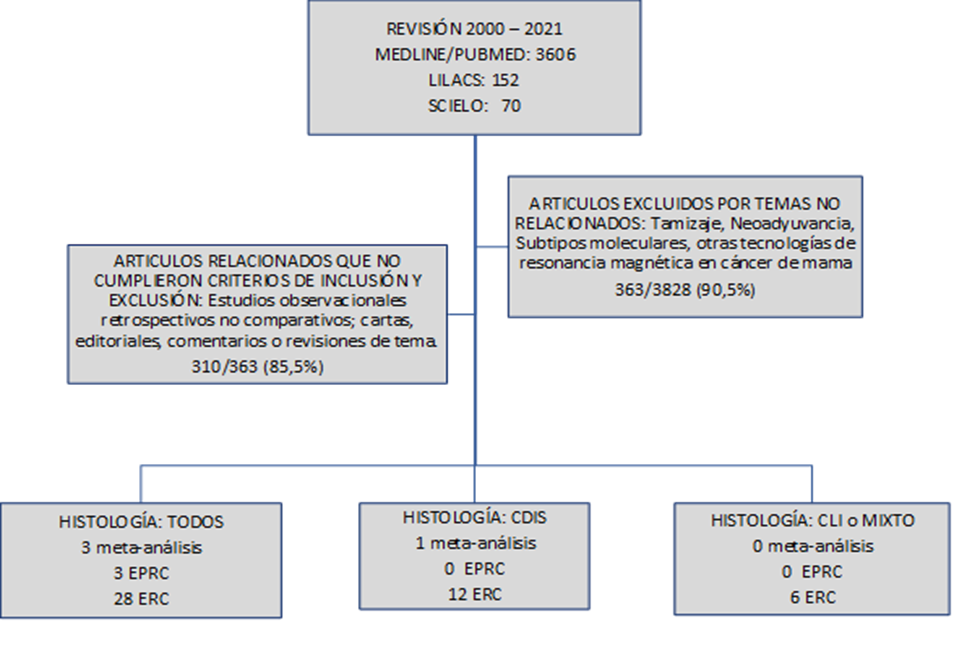
Desde el 01 de enero del 2000 hasta el 31 de marzo del 2021, se realizó la búsqueda con tres diferentes motores de datos: MEDLINE/PUBMED, LILACS y SCIELO. En MEDLINE/PUBMED se buscó todos los artículos médicos que contenían la palabra “Preoperative Magnetic Resonance AND Breast Cancer”; se encontraron 3606. En la plataforma LILACS y en SCIELO se buscó la palabra “Magnetic Resonance AND Breast Cancer” y “Resonancia magnética AND Cáncer de mama” se encontraron 152 y 70 artículos respectivamente. Del total recolectado, se evaluó el cumplimiento de los criterios de inclusión y exclusión y finalmente se seleccionó: 53 artículos para la revisión. La información fue trasladada a tablas diseñadas para ordenar la información en función al resultado buscado.
RESULTADOS
Todos los estudios clínicos presentaron dos grupos de pacientes: un grupo de pacientes con RM preoperatoria (RMP) y otro grupo de pacientes con cáncer de mama que solo usó mamografía y ecografía mamaria, pero no RM (noRMP).
- Cáncer de mama (Todos los tipos histológicos)
- Cáncer de mama temprano [Carcinoma ductal in situ (CDIS)]
- Cáncer de mama temprano (Carcinoma lobular o ducto-lobular)
Estudios retrospectivos y comparativos
La tabla 1 muestra los estudios retrospectivos, comparativos, entre los grupos RMP y noRMP. Fisher publicó que la tasa de recurrencia fue de 1/86 (1,2%) versus 9/133 (6,8%) y se detectó carcinoma contralateral en 2/121 (1,7%) versus 9/225 (4%), ambos estadísticamente significativos(9). Contrariamente, Solin no encontró diferencias significativas en la tasa de recurrencia loco-regional, supervivencia global, supervivencia sin enfermedad metastásica, ni en la presencia de cáncer de mama contralateral en los grupos RMP versus noRMP(10).
Angarita en Canadá y Grady en EEUU, encontraron diferencias significativas en el número de nuevos tumores hallados en pacientes RMP vs. noRMP(11,12). Otros estudios demostraron un aumento significativo de la tasa de mastectomías iniciales y finales versus las cirugías conservadoras (BCS), en los grupos con RMP(11-19), sin embargo, otras investigaciones demostraron lo contrario(20-26). Dos estudios encontraron una significativa menor frecuencia de márgenes positivos y tasa de reoperaciones en las pacientes con RMP versus noRMP(27,28). Otros estudios no encontraron diferencias significativas(13,30).
Yi en Corea del Sur, encontró que las pacientes con RMP tuvieron mejor supervivencia libre de recurrencia loco-regional ipsilateral, que aquellas noRMP(31). Hill en Estados Unidos encontró en un análisis univariado, que la recurrencia loco-regional fue de menor en pacientes sometidas a RMP versus noRMP, con un seguimiento promedio de 8 años, sin embargo, el análisis multivariado demostró que la RMP no estaba asociada a la recurrencia loco-regional(32). Como contraparte, estudios de largo plazo como el de Ryu, Zeng y Gervais con un seguimiento >5 y 10 años, no demostraron diferencia significativa en la supervivencia libre de recurrencia loco-regional en los grupos con y sin RM preoperatoria(33-35). Finalmente, Onega analizó una base de datos multicéntrica (The Breast Cancer Surveillance Consortium) y demostró que la mortalidad específica y ajustada por cáncer de mama no fue significativa entre ambos grupos de comparación(36)
Meta análisis de la RM en cáncer de mama multifocal/multicéntrico
En el 2008 se publicó un meta-análisis cuyos resultados mostraron que la RM detectaba enfermedad adicional en el 16% de las mujeres con cáncer de mama, el valor pronóstico predictivo fue del 66% y la relación de positivos verdaderos/falsos positivos fue de 1,91; la conversión desde una escisión local amplia a una mastectomía fue del 8,1%, demostrándose que la RM en este contexto, provocaba una mayor extensión de la cirugía, en un grupo importante de mujeres(37).
Meta análisis y estudios prospectivos y randomizados de la RM en cáncer de mama
El primer estudio clínico prospectivo, aleatorizado, controlado y multicéntrico fue publicado en el 2010; fueron enrolados 1623 pacientes con cáncer de mama en 45 centros hospitalarios del Reino Unido. El estudio COMICE comparó RMP (n=816), versus noRMP (n=807). Se demostró que el uso de RM no se asoció de forma significativa con una reducción de la tasa de reoperación(38).
Posteriormente el Estudio MONET, con 211 pacientes en el grupo noRMP y 207 pacientes en el grupo RMP, demostró que la cirugía conservadora (BCS) fue similar en ambos grupos (68% versus 66%); Las reoperaciones por márgenes positivos después de BCS fue significativamente mayor en el grupo con RMP versus el grupo control(39).
Un meta-análisis publicado por Houssami y colaboradores en el 2013, encontró una tasa de mastectomía inicial significativa del 16,4% versus 8,1%; no hubo diferencia en la tasa de reoperación después de BCS y mastectomía general en los grupos noRMP y RMP correspondientemente(40).
El año 2014 el Estudio POMB, que incluyó a 440 pacientes con cáncer de mama menores de 56 años, en Suecia, asignó aleatoriamente un grupo a RMP (n=220) y otro noRMP (n=220). El grupo con RMP tuvo una mayor tasa de BCS que el grupo control, sin embargo, hubo cambio en la decisión de mastectomía en 23/153 pacientes (15%). La tasa de reoperación fue significativamente menor en el grupo de RMP: 11/220 (5%) versus 33/220 (15%) en el control(41).
Un nuevo metaanálisis de Houssami en el 2014 con 3169 pacientes, demostró que la supervivencia libre de recurrencia local a ocho años fue similar en pacientes con RMP (97%) versus noRMP (95%); la supervivencia libre de recurrencia a distancia a ocho años tampoco difirió entre los grupos (89% versus 93%)(42).
Otro metaanálisis publicado el 2017 por Houssami y colaboradores, incluyó 19 estudios: tres estudios prospectivos, controlados y randomizados (COMICE, MONET y POMB) y el resto fueron estudios retrospectivos, comparativos; se incluyó 85.975 pacientes con y sin RMP. El uso de RM se asoció a mayor tasa de mastectomía [OR: 1,39 (1,23; 1,57)]; no hubo evidencia de incremento de las tasas de reoperación o márgenes positivos; el grupo con RM tuvo más probabilidades de recibir mastectomía profiláctica contralateral [OR: 1,91 (1,25; 2,91)](43).
El 2015 fue publicado un meta-análisis con 3252 pacientes con diagnóstico de carcinoma ductal in situ (1077 con RMP y 2175 noRMP); el grupo con RMP tuvo mayor probabilidad de tener una mastectomía inicial (OR ajustado: 1,76,). No hubo diferencias significativas en la proporción de mujeres con reoperación después de BCS(44).
En la tabla 2, se ha organizado los diferentes estudios retrospectivos que evalúan CDIS en el contexto del uso o no de la RM. La sensibilidad de la RM permite la detección de un mayor número de tumores por lo cual Petrillo detectó 19.7% DCIS adicionales en contraposición a las imágenes convencionales, sin embargo, también hubo un 11,6% de falsos negativos(45). Lam evidenció 30% de biopsias entre las pacientes que usaron RM vs 7% en aquellas que no, asimismo, el número de cirugías fue significativamente mayor(46). Los resultados son bastante controversiales, ya que otros investigadores encontraron una mayor proporción de mastectomías entre las pacientes que usaron RMP en relación al grupo que solo usó imágenes convencionales(47-49); sin embargo, Davis demostró en un estudio similar, que no había diferencia significativa en ambos grupos(50-52).
Kropcho el año 2011, no encontró diferencias significativas en el hallazgo de márgenes positivos después de cirugía por CDIS, entre los grupos con RMP y sin ella (24,7% vs 30,7%); sí hubo diferencia en la tasa de reoperación entre ambos grupos (17,7% vs 4,1%)(53). Yoon el 2020 encontró una tasa de reoperación menor en el grupo que tuvo RMP [OR: 0,33 (IC 95% 0,12-0,92)](54). Contrariamente a estos autores, Allen y So, no encontraron diferencias significativas en las tasas de reoperación en el CDIS en estos dos grupos de pacientes con y sin uso de RM(55,56).
La tabla 3 muestra los estudios retrospectivos, comparativos, realizados en el contexto del cáncer de mama de tipo lobular o mixto, es decir de histología ductal y lobular (ducto-lobular), entre pacientes que tuvieron RMP y aquellas noRMP. La tasa de mastectomía entre ambos grupos no demostró diferencia estadística en cuatro ensayos clínicos realizados(57-60). A pesar de ello, existe una tendencia a una mayor tasa de reoperaciones en los estudios clínicos de Mann y Ha en el grupo con RMP [OR: 3,29 (IC 95% 1,22–8,85)(57) y (OR: 0.140)(60) y una tendencia a ser mayor en la publicación de Moloney (38,0% vs 23,4%)(61).
Finalmente, Ha el 2019, en un estudio unicéntrico, después de un seguimiento de 9 años, encontró que la tasa de recurrencia loco-regional por cáncer de mama con componentes lobulares o mixto, no fue significativa y la supervivencia global tampoco entre RMP versus noRMP(62).
DISCUSION
La mayoría de las neoplasias malignas de mama son adenocarcinomas, que constituyen más del 95% de los
cánceres de mama y se clasifican como in situ o invasivos. En el carcinoma in situ, las células están
restringidas dentro del sistema lobulillar-ductal mamario, mientras que en el carcinoma invasivo las
células se diseminan más allá de esa estructura. Por tanto, se ha considerado para esta revisión
sistemática, los carcinomas invasivos (tanto ductal como lobular o mixto) y el carcinoma ductal in situ,
pero no, carcinoma lobular in situ, ya que es considerado un precursor no obligado del carcinoma de
mama(63,64).
En un grupo mayoritario de estos estudios, las pacientes con RMP fueron más jóvenes y tuvieron
mayor densidad mamaria. Las mujeres premenopáusicas tienen más probabilidades de tener fenotipos
agresivos de tumores de mama, y también mamas más densas que aquellas postmenopaúsicas(65). Estos sesgos pueden alterar los resultados de los estudios y generar
conclusiones controversiales.
La multifocalidad/multicentricidad del cáncer de mama, evaluados en exámenes patológicos
minuciosos de las mamas extirpadas, tiene un rango entre 20% y 60%(66,67). La RM mamaria, mejoró la sensibilidad para evidenciar tumores no
detectados por otros medios; las primeras publicaciones de la RM en cáncer de mama se basaron en
estudios observacionales. En este contexto, Kuhl publicó el 2007 que “la RM de mama había demostrado ser
muy importante en la estadificación local del cáncer de mama, permitiendo obtener mayor precisión del
tamaño y la extensión tumoral, detectar la enfermedad multifocal, multicéntrica o contralateral,
extensiones intraductales, haciendo la cirugía más precisa y evitando operaciones innecesarias, por lo
cual debería usarse en el estudio de todas las pacientes que se someten a un tratamiento de conservación
en el cáncer de mama”(68).
Un metaanálisis del año 2014, con 22 estudios y 67.557 pacientes, encontró enfermedad multifocal
en el 9,5% de los casos; el análisis multivariado mostró menor supervivencia global (HR: 1,65) y
tendencia a una peor supervivencia libre de enfermedad (HR: 1,96) que la enfermedad única, sin embargo,
cuando se excluyeron los estudios con heterogeneidad significativa, no hubo diferencia significativa en
la supervivencia global(69). Yerushalmi encontró que la tasa acumulativa a 10
años para recurrencia local, en cáncer de mama unifocal o multifocal/multicéntrico, tratadas con
mastectomía (887 pacientes) versus BCS (300 pacientes), fue de 6,5% (58/887) frente al 5,7% (17/300)
respectivamente(70). Un metaanálisis posterior que incluyó este último
estudio, concluyó que las publicaciones elegidas para la revisión sistemática fueron históricas, de
moderada calidad, con escaso poder estadístico, seguimiento limitado y con sesgos de selección que
favorecieron la BCS en lugar de la mastectomía en pacientes de bajo riesgo(71).
Muchos cirujanos fueron más agresivos en la enfermedad multifocal/ multicéntrica, lo cual
resultó en mayor número de mastectomías en los estudios retrospectivos y comparativos que evaluamos en
las tablas 1-3, en pacientes con RMP. BCS y mastectomía han demostrado una
supervivencia global similar
comprobados por dos estudios con un seguimiento de 20 años(72,73), una percepción, sin evidencia científica sólida, ha llevado a pensar que
la mastectomía podría ser relevante en la enfermedad multifocal/multicéntrica. No obstante, la
mastectomía está basada claramente en una decisión, pero no establece de modo categórico el beneficio a
mediano o largo plazo para la paciente. A ello hay que agregar que muchas de estas pacientes son
sometidas a tratamientos complementarios adyuvantes cuyos efectos no son medidos.
Los márgenes positivos y reoperación complementaria posterior a una BCS, se basaron en criterios
de “margen suficiente” para evitar la recurrencia, y cada institución creó sus propios parámetros para
realizar una reoperación. El año 2014, el National Surgical Adjuvant Breast Project, consideró que, si
el margen de resección estaba libre de células cancerosas a nivel microscópico era suficiente para
evitar la reoperación; hubo diferentes interpretaciones que condujeron a un exceso de reoperaciones
(entre 25% y 40%), no encontrándose enfermedad patológica en cerca del 50% de ellas(74). El 2016, la mayoría de instituciones académicas apoyaron la “no
presencia de tumor en la tinta” como la definición de margen negativo, así se consiguió disminuir de 22%
a 14% la tasa de reoperaciones(75). De ello se deduce, que las diferentes
publicaciones mostradas en las tablas 1-3, que evaluaron los márgenes positivos y
la tasa de reoperación
(obviamente interrelacionados), tuvieron sus resultados sobre una base no estandarizada y por ende
difícilmente comparativos entre sí, aun así, la tendencia fue una mayor tasa de reoperaciones en las
pacientes que no tuvieron RMP, a ello se suma, que tampoco se evaluó como influenció el tratamiento
complementario que recibieron post cirugía.
Probablemente, los resultados que mejor reflejan las ventajas de tener o no una RMP en cáncer de
mama temprano son: tasa de recurrencia loco-regional o a distancia, la supervivencia libre de enfermedad
o de recurrencia local o a distancia y finalmente la supervivencia global. Varios estudios han
investigado las tasas de recurrencia ipsilateral en pacientes con cáncer de mama temprano con BCS
asociados al uso de tratamiento adyuvante, en el cáncer invasivo ductal, lobular o mixto, con tasas de
recurrencia a 10 años que van entre 2,6% y 6,2%(76) y en carcinoma ductal in
situ, con tasas de recurrencia anual entre 1,22% y 1,65%(77). Estudios
randomizados, controlados, multicéntricos que compararon tumorectomía sola versus tumorectomía más
radioterapia, han demostrado que el riesgo de recurrencia local está significativamente reducido hasta
en un 70% en un período de 10 años(78). En los estudios retrospectivos y
comparativos de esta revisión se encontró resultados antagónicos que no permiten evaluar el verdadero
peso diferencial entre el uso o no de la RMP, en cáncer de mama temprano.
Respecto a los estudios prospectivos, randomizados y controlados, el primero en realizarse fue
el estudio COMICE(38) el cual no encontró que la densidad mamaria influyera
en la tasa de reoperación en forma significativa; un año después, el Estudio MONET(39) en pacientes con lesiones no palpables de mama, halló que la tasa
reoperación era significativamente mayor en las pacientes con RMP. Finalmente, el Estudio POMB(40) que fue diseñado específicamente para pacientes menores de 56 años,
encontró que la RMP resultó en una menor probabilidad de requerir una reoperación. Sin embargo, estos
resultados no están midiendo la injerencia de los tratamientos posteriores a la cirugía que han
demostrado disminuir significativamente las tasas de recurrencia a largo plazo. El hecho de que ni el
estudio COMICE ni el estudio MONET mostraran ningún beneficio para la RMP fue inesperado, sin embargo,
Kestelman(79) sostiene que ambos estudios tuvieron una serie de limitaciones
metodológicas: inexperiencia del uso de la RM tanto a nivel de radiólogos como los propios cirujanos,
bajas tasas de reoperación sin una explicación congruente, inexperiencia en la toma de biopsias guiadas
por RM, entre otros.
En relación a los meta-análisis, el primero de ellos realizado por Housami(37) en el 2008 demostró que la RM detectó enfermedad adicional en 16% de las
mujeres con cáncer de mama, sin embargo, la relación de positivos verdaderos/falsos positivos fue de
2:1, es decir, de cada tres mujeres diagnosticadas y biopsiadas a través de la RMP, una era falso
positivo; la conversión a mastectomía fue del 8,1%; fue uno de los primeros estudios en poner en duda la
utilidad de la RMP. El mismo autor publicó 2 metaanálisis más(41,43) demostrando que el uso de RMP se asoció a una mayor tasa de mastectomía,
mas no de reoperación. Existen críticas a estos metaanálisis sobre la base que se incluyó sólo tres
ensayos aleatorios y hubo serias deficiencias metodológicas(80).
La ubicación intraluminal del CDIS puede generar dudas respecto a los verdaderos límites del
tumor, que permitan una cirugía conservadora, por ello se pensó que la RM podría ser de ayuda como
herramienta preoperatoria. Un metaanálisis(45) en pacientes con CDIS demostró
que la RMP no mejora el control de los márgenes positivos, ni la tasa de reoperación. En uno de los
pocos estudios que evaluaron la recurrencia loco-regional, Pilewskie(51) en
2321 pacientes con CDIS y tumorectomía demostró que la RM no tuvo un impacto significativo en la
recurrencia a 5 años.
El cáncer de mama de histología lobulillar invasivo es conocido por estar asociado con una mayor
dificultad en la definición de la extensión del tumor mamario, lo que hace difícil la detección
temprana; a ello se suma su propensión a diseminarse a tejidos vecinos y a veces a distancia por lo cual
algunos médicos lo perciben como tumores con pobres resultados, a pesar que la mayoría es
hormono-dependiente(81). Muchos investigadores consideran la RMP mamaria una
herramienta potencial para la planificación de la cirugía de conservación de la mama, en esta variedad
histológica. La publicación que hizo Ha(62) el año 2019, con un seguimiento
de 9 años, desnudó esta posición cuando encontró que la recurrencia loco-regional por cáncer de mama con
componente lobular o mixto, no era significativa en los grupos con y sin RM preoperatoria.
Las indicaciones de la RM en cáncer de mama son claras y precisas; el uso rutinario en la
evaluación preoperatoria del cáncer de mama temprano no tiene niveles altos de evidencia que demuestren
que mejora la planeación y ejecución quirúrgica o que reduce el número de cirugías, o lo que es más
importante, que reduce la recurrencia local o a distancia o mejora la supervivencia en el largo
plazo(82).
CDIS: Carcinoma Ductal in Situ
CLI: Carcinoma Lobular Invasivo
EPRC: Estudio Prospectivo, Randomizado y Controlado
ERC: Estudio Retrospectivo y Comparativo uni o multicéntrico.
Tabla 1. Estudios Observacionales, retrospectivos uni o multicentricos, comparativos (RM vs no-RM preoperatoria) en cáncer temprano de mama Invasivo y ductal in situ
| Autor/Año | Edad media (RM+ vs RM-) | N | RM % | D Tratamiento Quirúrgico | Mastectomia (RM+ vs RM-) | Margen positivo (RM+ vs RM-) | Reoperación (RM+ vs RM-) | Recurrencia RLR o RD (RM+ vs RM-) | Otros (RM+ vs RM-) | Observaciones |
|---|---|---|---|---|---|---|---|---|---|---|
| Fischer (Alemania) 2004 | 57,1 vs 55,2 | 346 | 121 (35%) | 87 (38,7%) vs 35 (28,9%) | RLR 6,8% vs 1,2% (p<0,001) | Carcinoma contralateral 4,0% vs 1,7% (p<0,001) | Seguimiento medio > 40 meses | |||
| Solin (USA) 2008 | 53,0 vs 56,0 (p=0,026) | 756 | 215 (28%) | RLR 3% vs 4% (p=0,51) | SG (86% v 87%, p=0,51). Metastasis (89% vs 92%, p=0,16), | Seguimiento: 8 años | ||||
| Pengel (Países bajos) 2008 | 56,1 vs 59,6 (p=0,02). | 349 | 173 (49,5%) | CCM a Mx 16/173 (9,2%) | 13,8% vs 19,4% (p=0,17) | Seguimiento medio 54,1 meses | ||||
| Bleicher (USA) 2009 | 52,5 vs 59,0 (p<0,001) | 577 | 130 (22,5%) | OR 1,80 (CI 95% 1,08–3,00, p=0,024) | 13,8% vs 21,6% (p=0,20) | Tiempo hasta cirugia 56,9 vs 38,1 días (p=0,010) | Pacientes con RM+ fueron más jóvenes (52,5 vs 59,0 años p<0,001), | |||
| Angarita (Canada) 2010 | 54,6 vs 64,4 (p< 0,0001) | 147 | 71 (48%) | Inicial 12% vs. final 26% | Tiempo hasta tratamiento. 36,0 vs 32,3 días (p=0,15). | |||||
| Weber (USA) 2012 | 53,6 vs 59,5 (p=0,001) | 313 | 120 (38%) | 47 (39,2%) vs 65 (33,7%) vs p=0,67 | Mx 10 (8,3%) vs 16 (8,3%) p= 0,92 | > Densidad mamaria MR+ (22,3% vs 68,4% p=0,001). | ||||
| Grady (USA) 2012 | 63,5 (31-99) | 184 | 79 (43%) | Cirugía adicional 11% vs 26% (p=0,04) | ||||||
| Wang (USA) 2013 | Por grupos | 36277 | 2554 (7%) | (37,4% vs 31,7%) p<0,0001 | Base de datos SEER-Medicare | |||||
| Obdeijn (Países Bajos) 2013 | 54,0 vs 55,2 (p=0,32) | 123 | 123 (100%) | 42 (34.1%). Mx: (29 , 23.6%). | 15,8% vs 29,3% p<0,01 | 18,9% vs 37,4% p<0,01. | Grupo histórico (control) | |||
| Petrillo (Italia) 2013 | 34,8 vs 34,7 (p=0.570) | 246 | 122 (50 %) | 437% vs 53% (p=0.011) | Pacientes menores de 40 años | |||||
| Killelea (USA) 2013 | 53 vs 60 (p<0,001) | 628 | 369 (59%) | 23% vs 26% p=NS; | Mx bilateral: 20% vs 12% <0,005 | |||||
| Sung (USA) 2014 | 52,0 vs 55,0 | 348 | 174 (50%) | 29% vs 45% p=0,02 | LRR (p=0,33) SLE (p=0,73) |
> densidad mamaria (28% vs 6%, p < 0,0001) | Tiempo medio seguimiento después de tto fue de 8 años | |||
| Fancellu (Italia) 2014 | 53,9 vs 56,4 (p=0,10) | 237 | 109 (46%) | 18/109 (16,5%) | 13,7% vs 7,0% (p<0,05) | 4,1% vs 8,6% (p=0,9) | Tamaño tumoral > RM+ 16,8& vs 13,9 mm (p <0,001). | |||
| Fortune-Greeley (USA) 2014 | Por grupos | 20332 | 2471 (12,2%) | OR: 1,33 (IC 95% 1,19–1,48) | Base de datos SEER-Medicare | |||||
| Parsyan (Canadá) 2015 | 55,3 vs 66,3 (p<0.001) | 765 | 307 | 20,5% vs 17,2%, (p=0,254) | 7,5% vs 8,7% (p=0,54) | Pacientes > 30 años | ||||
| Arnaout (Canadá) 2015 | Por grupos | 53,015 | 7824 (14,8%) | [OR: 1,73 (IC 95% 1,62-1,85)] | Mastectomia contralateral [OR:1,48 (IC 95% 1,23-1,77) | Base de datos de salud de Ontario, Canada | ||||
| Patel (USA) 2015 | 51,7 vs 51,7 (p=0,978) | 250 | 154 (62%) | 79 (51,3%) vs 39 (40,6%) p=0,100 | [OR = 4,33; (CI 95% 2,01-9,35; p < 0.001)] | |||||
| Yi (Corea del Sur) 2015 | 48,5 (20-89) | 742 | 371 (50%) | [HR: 0,15; IC 95% (0,07-0,32)]* | [HR: 0,03; IC 95% (0,04-0,21)] (p<0,001)** | *Supervivencia libre de RLR ipsilateral
** SLR mama contralateral |
||||
| Ozanne (USA) 2016 | Por grupos | 55997 | 9055 (16,2%) | 37,1% [OR: 1,04 (IC 95% 0,.98-1,11)] | [OR: 0,96 (IC 95% 0,89 - 1,03) | Base de datos SEER-Medicare | ||||
| Lai (Taiwan) 2016 | 52,2 vs 52,7 (p=0,31) | 1468 | 735 (50,1%) | 5,0% vs 9,0% (p<0,01). | 11,7% vs 3,2% (p<0,01) | |||||
| Gervais (Canada) 2016 | 56,8 (25-92 ) | 470 | 27 (5.8%) | 10 años: 1,6% vs 4,2% (p=0,37) | Seguimiento medio 97 meses | |||||
| Ryu (Corea del Sur) 2016 | 48,9 vs 50,5 (p=0,098) | 954 | 743 (77,8%) | SLRLC (p=0,938), SLE (p=0,507) | SG (p=0,655). | Seguimiento medio 64.5 meses MR+ ; 78.5 meses MR- | ||||
| Brück (Finlandia) 2017 | 61,0 vs 61,0 (p=0,617) | 100 | 50 (50%) | 10/50 (20%) | 6/50(12%) vs 2/50 (4%) (p=0,140) | 14% vs 24% (p=0,202) | Biopsias 14/50 (28%) 7/14 (50%) fueron malignos | Mayores de 35 anos. Estadío I | ||
| Hill (USA) 2017 | 60,0 vs 59,0 (p=0,12) | 1396 | 664 (47,6%) | 4,0% vs. 8,0% a 8 años (p=0,04)* | RM no asociado RLR [RR: 0,77 (0,45–1,28)]** | * Análisis univariado **Análisis multivariado |
||||
| Onega (USA) 2017 | Por grupos | 13097 | 2217 (16,9%) | 39,8% [OR: 1,32 (IC 95% 1,16-1,50)] | Mastectomia contralateral [OR: 1,32 (IC 95% 1,05-1,65)] | The Breast Cancer Surveillance Consortium (BCSC) | ||||
| Wang (USA) 2018 | Por grupos | 24379 | 4691 (19,2%) | 3,2 vs 4,1*[AHR: 0,92; IC 95% (0,70-1,19)] | Mortalidad 5,3 vs 8,7* [AHR: 0,89 (IC 95% 0,73-1,08)] | Base de datos SEER-Medicare *Por 1000 personas-año |
||||
| Onega (USA) 2018 | Por grupos | 4454 | 917 (20,6%) | Mortalidad* [HR: 0,90 (IC 95% 0,72-1,12) | *Específica y ajustada por cáncer de mama | |||||
| Zeng (USA) 2020 | 43,4 vs 43,6 (p=0,62) | 512 | 65% | 7.9 vs. 8.2%, p = 0.88 | RD 6.4 vs. 6.6%, p = 0.92 | Edad ≤ 50 Seguimiento 5.8 anos | ||||
| RM: Resonancia Magnética; D: Variación; RLR: Recurrencia Loco-Regional; RD: Recurencia a distancia; SG: Supervivencia Global; CCM: Cirugía Conservadora de mama o Tumorectomía; OR: Odds Ratio; Mx: Mastectomía; NS: No Significativo; SLRLC: Supervivencia Libre deRecurrencia Loco-Regional; SRL: Supervivencia libre de recurrencia; SLE: Supervivencia Libre de Enfermedad; HR: Hazard Ratio; AHR: Hazard Ratio Ajustado; IC 95%: Intervalo de confianza al 95%. | ||||||||||
Tabla 2. Estudios Observacionales, retrospectivos uni o multicentricos, comparativos (RM vs no-RM preoperatoria) en cáncer de mama ductal in situ
| Autor/Año | Edad media (RM+ vs RM-) | N | RM % | D Tratamiento Quirúrgico | Mastectomia (RM+ vs RM-) | Margen positivo (RM+ vs RM-) | Reoperación (RM+ vs RM-) | Recurrencia RLR o RD (RM+ vs RM-) | Otros (RM+ vs RM-) | Observaciones |
|---|---|---|---|---|---|---|---|---|---|---|
| Allen (USA) 2010 | 60,5 vs 64,4 | 99 | 64 (64,6%) | 20,3% vs 25.7% p=0,62 | 21,2% vs 30,8% p=0,41 | 21,2% vs 30.8% p=0,41 | ||||
| Itakura (USA) 2011 | 50,0 vs 59,0 (p<0,001) | 149 | 38 (25,5%) | 45% vs 14%, p<0,001 | MR+ tuvieron DCIS m+ás grandes (1,6 vs 1,0 cm; p=0,007) | |||||
| Kropcho (USA) 2011 | 55,0 vs 62,0 (p<0,001). | 158 | 60 (38%) | 17,7% vs 4,1% (p=0,004) | 24,7% vs 30,7% p = 0,414 | |||||
| Davis (USA) 2012 | ND | 218 | 154 (71%) | 8,9% vs 7,8% p=NS | 34% vs 39% p=NS | |||||
| Pilewskie (USA) 2013 | 53,0 vs 60,0 (p<0,0001) | 352 | 217 (61,2%) | 34,6 vs 27,4% p=0,20 | 14,3% vs 20,0% (p=0,19). | |||||
| Petrillo (Italia) 2017 | 63,3 vs 51,4 (p<0,001) | 362 | 117 (32,3%) | RM+ 19,7% DCIS adicionales y 11.6% de falsos negativos. | ||||||
| So (USA) 2017 | 56,4 vs 63,6 (p<0,001) | 176 | 97 (55,1%) | 28,9% vs 26,6% p=0,87). | ||||||
| Keymeulen (P. Bajos) 2019 | 50,0–74,0 (84,7%), | 10173 | 2382 (22,9%) | [OR: 2,11 (IC 95% 1,91-2,33)] | [OR: 0,99 (IC 95% 0,85-1,16)] | Mx secundaria [OR: 1,17 (IC 95% 1,00-1,37)] | *Registo Cáncer de Holanda < 75 anos | |||
| Lam (USA) 2019 | 55,7 vs 53,8 (p=0,29) | 373 | 332 (89%) | Biopsia 30% vs. 7% p=0,002; N° cirugías 1,2 vs 1,5 p<0,001 | ||||||
| Balleyguier (Francia) 2019 | 56,0 vs 58,0 | 352 | 178 (50,6)% | 18% vs 17% (p=0,93] | [OR: 0,68 (IC 95% 0,41-1,1; p=0,13)] | |||||
| Shin (Corea del Sur) 2019 | 54,0 vs 49,0 (p=0,001) | 541 | 430 (79,5%) | 3% (Apropiado 54%) | [OR: 0,39 (IC 95% 0,16-0,93 p=0,03) | [OR: 0,33 (IC 95% 0,12-0,92 p=0,03) | ||||
| Lamb (USA) 2020 | 60,2 vs 50,6 (p<0,001) | 963 | 236 (24,5%) | 34,3% vs 19,4% p<0,001 | 36,0% vs 37,4%p=0,85 | |||||
| RM: Resonancia Magnética; D: Variación; RLR: Recurrencia Loco-Regional; RD: Recurencia a distancia; OR: Odds Ratio; Mx: Mastectomía; NS: No Significativo. | ||||||||||
Tabla 3. Estudios Observacionales, retrospectivos uni o multicentricos, comparativos (RM vs no-RM preoperatoria) en cáncer temprano de mama lobular o mixto
| Autor/Año | Edad media (RM+ vs RM-) | N | RM % | D Tratamiento Quirúrgico | Mastectomia (RM+ vs RM-) | Margen positivo (RM+ vs RM-) | Reoperación (RM+ vs RM-) | Recurrencia RLR o RD (RM+ vs RM-) | Otros (RM+ vs RM-) | Observaciones |
|---|---|---|---|---|---|---|---|---|---|---|
| Mann (Países bajos) 2010 | 56 vs 61 (p=0,001) | 267 | 99 (37%) | 48% vs 59% p=0,098 | [OR: 3,29 (IC 95% 1,22–8,85). | |||||
| Heil (Alemania) 2011 | 57,8 vs 63,6 p=0,003 | 178 | 92 (52%) | 38% vs 30% p=0,119 | Cirugía bilateral 14 vs 3 patientes; p=0,002). | |||||
| Sinclair (Escocia) 2016 | ND | 138 | 59 (42,8%) |
40.70% | 32% vs 30% p=0,71 | |||||
| Ha (Corea del Sur) 2018 | 49,9 vs 51,5 p=0,035 |
603 | 369 (61,2%) | 25,5% | Mx inicial (OR: 0,876; p=0,528) | 39.3% vs 65.5% | (OR: 0.140; P<0.001) | Mx final (OR: 0,744; p=0,151) | ||
| Ha (Corea del Sur) 2019 | 48,6 vs 50,6 p=0,036) | 287 | 120 (41,8%) | RLR (HR:1,204; p=0,796) | SG (HR: 0,485; p=0,231) | |||||
| Moloney (Irlanda) 2020 | 56,4 vs 65,6 (p<0,001). | 218 | 70 (32.1%) | 38,0% vs 23,4% (p=0,057). | ||||||
| RM: Resonancia Magnética; D: Variación; RLR: Recurrencia Loco-Regional; RD: Recurencia a distancia; SG: Supervivencia Global; OR: Odds Ratio; Mx: Mastectomía; NS: No Significativo; HR: Hazard Ratio. | ||||||||||
CONCLUSIONES
No existe hasta el momento una clara evidencia del beneficio de la RM preoperatoria en las pacientes con cáncer de mama loco-regional; los estudios de investigación que han evaluado la tasa de mastectomías versus tumorectomías, la tasa de reoperación, la recurrencia loco-regional y la supervivencia libre de progresión tienen resultados controversiales. Es necesario estudios adicionales de tipo prospectivo, multicéntricos, aleatorizados, comparativos y bien diseñados que definan mejor el rol de la RM preoperatoria en cáncer de mama locorregional.
Contribuciones de autoría: Los autores declaramos que el estudio presentado es original,
no existen responsabilidad de tipo ético, ni confidencialidad de datos. No se ha precisado de
consentimiento informado ni derecho de privacidad.
Financiamiento: Autofinanciado.
Conflicto de intereses: Los autores declaran no tener conflicto de interés.
Recibido: 14 de enero 2022
Aprobado: 5 de marzo 2022
Correspondencia: Franklin Aldecoa Bedoya
Dirección: Calle Mariel 190 Dpto 403 Urbanización Chacarilla del Estanque. Surco. Lima-Perú.
Teléfono: +51 938 159 635
Correo: franklin.aldecoa@yahoo.com
REFERENCIAS
