CASO CLÍNICO
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2022 - Universidad Ricardo Palma10.25176/RFMH.v22i4.5046
DISMINUCIÓN DE HIPOGLICEMIA ASINTOMÁTICA EN UNA PACIENTE CON DIABETES MELLITUS TIPO 1 LUEGO DEL MONITOREO CONTINUO DE GLUCOSA: HERRAMIENTAS PARA EL EMPODERAMIENTO.
DECREASING HYPOGLYCEMIA UNAWARENESS IN A PATIENT WITH TYPE 1 DIABETES MELLITUS AFTER CONTINUOUS GLUCOSE MONITORING: TOOLS FOR SELF-CARE.
Sonia Helen Perez-Cavero1,5,a, Helard Manrique-Hurtado2,4,a, Julio Leey-Casella3,a
1Hospital María Auxiliadora, Lima, Perú.
2Clínica Delgado, Lima, Perú.
3Universidad de Florida. Gainesville, Florida, USA
4Universidad Peruana Cayetano Heredia. Lima, Perú
5Universidad Científica del Sur. Lima, Perú
aMédico de la especialidad de Endocrinólogía
RESUMEN
La diabetes mellitus es un problema de salud que ocasiona complicaciones tempranas y tardías. El monitoreo continuo de glucosa (MCG) se ha convertido en la principal herramienta tecnológica para el control glicémico en tiempo real y evitar las potenciales complicaciones. Sin embargo, su uso no se ha extendido en países de medianos y bajos ingresos. Se presenta la experiencia en el manejo de una paciente adulta con diabetes tipo 1 con hipoglicemias asintomáticas recurrentes en quien el uso del MCG en tiempo real permitió reducir los episodios de hipoglicemias y optimizar la insulino terapia. La aplicación del MCG sumado al uso de insulinas análogas y educación en el manejo de la enfermedad resultó en un mejor control metabólico. El MCG, especialmente incorporando un sistema de alarma, es una herramienta útil a considerar en pacientes con hipoglicemia frecuente para minimizar el riesgo de complicaciones a futuro.
Palabras Clave: Diabetes mellitus tipo 1; Tecnología; Automonitorización de la glucosa sanguínea; Hipoglucemia. (fuente: DeCS BIREME).
ABSTRACT
Diabetes mellitus is a public health problem that causes early and late complications. Continuous glucose monitoring (CGM) has become the main technological tool for real-time glycemic control and has the potential to prevent complications. However, its use has not spread in low- and middle-income countries. We present the experience in the management of a patient with type 1 diabetes with hypoglycemia unawareness in whom the use of real-time CGM achieved both: less hypoglycemic episodes and optimization of insulin regimen. The benefit of real-time CGM in addition to the use of analog insulins and diabetes education resulted in better metabolic control. CGM is a useful tool to consider in patients with hypoglycemia unawareness and to minimize the risk of complications in the future.
Keywords: Diabetes mellitus type 1; Technology; Education; Blood Glucose Self-Monitoring; Hypoglycemia. (Source: MeSH NLM).
INTRODUCCIÓN
La diabetes mellitus tipo 1 (DM1) representa entre el 5 al 10% de todos los casos de diabetes y es una condición donde las células beta son destruidas por un fenómeno autoinmune. La prevalencia e incidencia de DM1 es de aproximadamente 5,6 y 15 casos por cada 100,000 habitantes respectivamente a nivel mundial (1), siendo alarmante el número de nuevos casos en niños y jóvenes durante la pandemia por COVID-19 (2).
En el Perú, la incidencia es baja aproximadamente un caso por cada 100,000 habitantes en menores de 15 años (3), pero en aumento. Recientemente el Instituto Nacional de Salud del Niño en el Perú reportó mayor cantidad de nuevos casos por año entre 2011 al 2018 (4). Los pacientes con DM1 tienen mayor dificultad para alcanzar las metas de hemoglobina glucosilada (HbA1c) y poder así disminuir las complicaciones. El miedo a la hipoglicemia y la pobre adherencia al tratamiento en estos pacientes afecta en gran medida el buen control glucémico. Paralelamente, las hipoglicemias aumentan la mortalidad y riesgo cardiovascular (5).
El automonitoreo es fundamental para el control de DM1; sin embargo, el costo de la glucometría por punción digital y la incomodidad y el dolor de la misma limitan su uso. En países desarrollados el uso del monitoreo continuo de glucosa (MCG) se ha convertido en la principal herramienta tecnológica para el control glucémico en tiempo real. En el Perú, existe un reporte previo del uso de MCG en un adulto (6) y un estudio retrospectivo de 28 pacientes entre niños y adultos (7).
En el presente reporte, describimos el caso de una paciente con DM1 con mal control metabólico e hipoglicemias recurrentes en quien el uso del MCG en tiempo real permitió reducir los episodios de hipoglicemias, mejorar calidad de vida y llegar a la dosis adecuada de insulina.
DESCRIPCIÓN DEL CASO CLÍNICO
En la primera visita, la paciente es evaluada por teleconsulta debido al confinamiento por la pandemia COVID-19. Se medía la glucosa capilar 1 o 2 veces al día, 50-70% de veces con un valor menor de 70 mg/dl, varios de los episodios eran asintomáticos. Ella sufría de episodios de hipoglucemia casi diarios ya sea de día y/o noche, con síntomas documentados hasta aproximadamente 35mg/dl de glucosa capilar, algunos de ellos eran hipoglucemias severas nocturnas que requerían la asistencia de otro miembro familiar con glucosa que llegaron hasta 23 mg/dl.
Tiene el antecedente de una fractura de brazo por hipoglicemia severa con pérdida de conciencia. Su talla es de 163cm y peso 49 Kg (IMC 18,4 Kg/m2), usualmente el índice de masa corporal es menor a 20 Kg/m2, usaba insulina NPH y Regular con una total de dosis diaria de insulina (TDD) 1 a 1,2 UI/KG (ver tabla 1). Los exámenes auxiliares evidenciaron los siguientes resultados: HbA1c 8,1%, péptido C <0.01 nmol/L, colesterol total: 197 mg/dl, lipoproteína de alta densidad (HDL) 56 mg/dl, lipoproteína de baja densidad (LDL) 138 mg/dl, triglicéridos: 65mg/dl, hormona tiroestimulante (TSH): 1,52 mUI/L, creatinina 1,44 mg/dl y una microalbuminuria de 1,4mg/L.
A los 6 días de la teleconsulta, se le colocaó un sensor de MCG Free Style Libre 2. Dada la dosis elevada de insulina diaria y la alta frecuencia de hipoglicemia, se realiza el cambio a análogos de insulina de acuerdo con el peso: glargina 18 UI/día y lispro 4/7/5 UI antes del desayuno, almuerzo y cena respectivamente, a la vez que se le brinda educación y asesoría nutricional (ver tabla 2). Siguiendo las instrucciones del fabricante, se aplicó el sensor sobre la piel del aspecto externo del brazo. Así mismo se le proporcionó el escanner Libre 2 y se le instruyó a que escanee el sensor MCG al menos cada 8 horas durante los 14 días que dura el sensor. La paciente enviaba diariamente información de dosis de insulina y fotos de sus alimentos. Se coordinaba con ella la corrección de las dosis de insulina y se le reforzaba la precisión del conteo de carbohidratos. Adicionalmente, durante las 2 semanas de uso del MCG la paciente hizo sus propios ajustes mínimos de las dosis de insulina basal y preprandial, empoderándola en la educación y manejo de su diabetes.
Tabla 1. Datos antropométricos y bioquímicos durante el seguimiento.
| Inicio | A los 4 meses | |
|---|---|---|
| IMC (peso/m2) | 18,44 | 18,06 |
| Peso (Kg) | 49,0 | 48,0 |
| HbA1C (%) | 8,1 | 7,3 |
| Hemoglobina (g/dl) | - | 13,4 |
| Ácido úrico (mg/dl) | - | 3,2 |
| Colesterol total (mg/dL) | 197 | 162 |
| Colesterol HDL (mg/dL) | 56 | 46,6 |
| Colesterol LDL (mg/dL) | 138 | 104,9 |
| Triglicéridos (mg/dL) | 65 | 63,8 |
| Creatinina (mg/dL) | 1,44 | 0,94 |
| TGP o Alanina Animotransferasa (mUI/mL) | - | 19 |
| Microalbuminuria 24 horas (mg/L) | 1,4 | - |
| Péptido C (nmol/L) | <0,01 | - |
| TSH (mUI/L) | 1,52 | - |
El informe del primer MCG obtuvo un tiempo en rango de 70 a 180 mg/dl en 66% (la configuración de alarmas de hipoglicemias fue a partir de 70 mg/dl), una glucosa promedio de 134 mg/dl, una variabilidad de glucosa del 46,2% y 26 eventos de glucosa baja con un promedio de duración de 120 minutos (Figura 1). La dosis de insulina basal fue de 18 UI/día e insulina preprandial repartida finalmente en 2/2/2 UI en promedio (Tabla 2).
Tabla 2. Dosis Diaria de insulina y Datos del Monitor Continuo de Glucosa.
| Antes del uso del CGM | 1er MCG | 2do MCG | ||
|---|---|---|---|---|
| Dosis diaria de insulina (UI) | 1,04 - 1.2 UI/Kg/día | 0,57 UI/Kg/día | 0,62 UI/Kg/día | |
| Insulina basal (UI) | NPH 25 y 20 UI | Glargina U-100 18 UI | Glargina U-100 21 UI | |
| Insulina preprandial (UI) | Regular -/10/- UI | Lispro 2/2-3/2 UI | Lispro ~3/3/3 UI | |
| Glucosa promedio (mg/dl) | 134 | 137 | ||
| Variabilidad de la glucosa (%Desviación estándar/promedio) | 46,2% | 45,6% | ||
| Indicador de gestión de Glucosa (GMI) o HbA1c estimada | 6,5% | 6,6% | ||
| Tiempo en Rango 70-180 mg/dl | 66% | 70% | ||
| Tiempo entre 54 y 69 mg/dl | 12% | 8% | ||
| Tiempo por debajo de 54 mg/dl | 2% | 2% | ||
| Tiempo por encima de 180mg/dl | 14% | 13% | ||
| Tiempo por encima de 250mg/dl | 6% | 7% | ||
| Eventos de glucosa baja | 26 | 18 | ||
| Duración promedio del episodio hipoglicémico (minutos) | 120 | 117 | ||
| Duración total de hipoglicemia en 14 días | 3120 minutos 52 horas o 3.8 horas/día | 2106 minutos 35.1 horas o 2.5 horas/dia | ||
| Cambios del tratamiento | Antes del sensor | Dosis Diaria de insulina (UI) | 0,69 UI/Kg/día | 0,58 UI/Kg/día |
| Insulina basal (UI) | Glargina U-100 18 UI | Glargina U-100 18 UI | ||
| Insulina preprandial (UI) | Lispro 5/7/4 UI | Lispro 2-4/2-4/2 UI | ||
| Después del sensor | Dosis Diaria de insulina (UI) | 0,57 UI/Kg/día | 0,62 UI/Kg/día | |
| Insulina basal (UI) | Glargina U-100 18 UI | Glargina U-100 21 UI | ||
| Insulina preprandial (UI) | Lispro 4/2-4/2 UI | Lispro ~3/3/3 UI | ||
En el seguimiento ambulatorio a los cuatro meses, ella manifestó mejor control del automonitoreo de glucosas, con glucometría capilar 4 veces al día, y menor número de hipoglicemias. Se decidió instalar otro MCG por dos semanas, con una configuración de alarma a partir de 80mg/dl para prevenir de manera más temprana los episodios de hipoglicemias. Se registró un valor de glucosa promedio de 137 mg/dl, un rango objetivo al 70%, una variabilidad de glucosa del 46,6% y 18 eventos de glucosa baja con un promedio de duración de 117 minutos (Ver Figura 1). Los exámenes de laboratorio control mostraron los siguientes resultados: HbA1C: 7,3%, colesterol total 162 mg/dl, HDL 46,4mg/dl, LDL 104,9 mg/dl, triglicéridos 63,8mg/dl, creatinina 0,4 mg/dl, TGP o Alanina Aminotransferasa 19 mUI/mL.
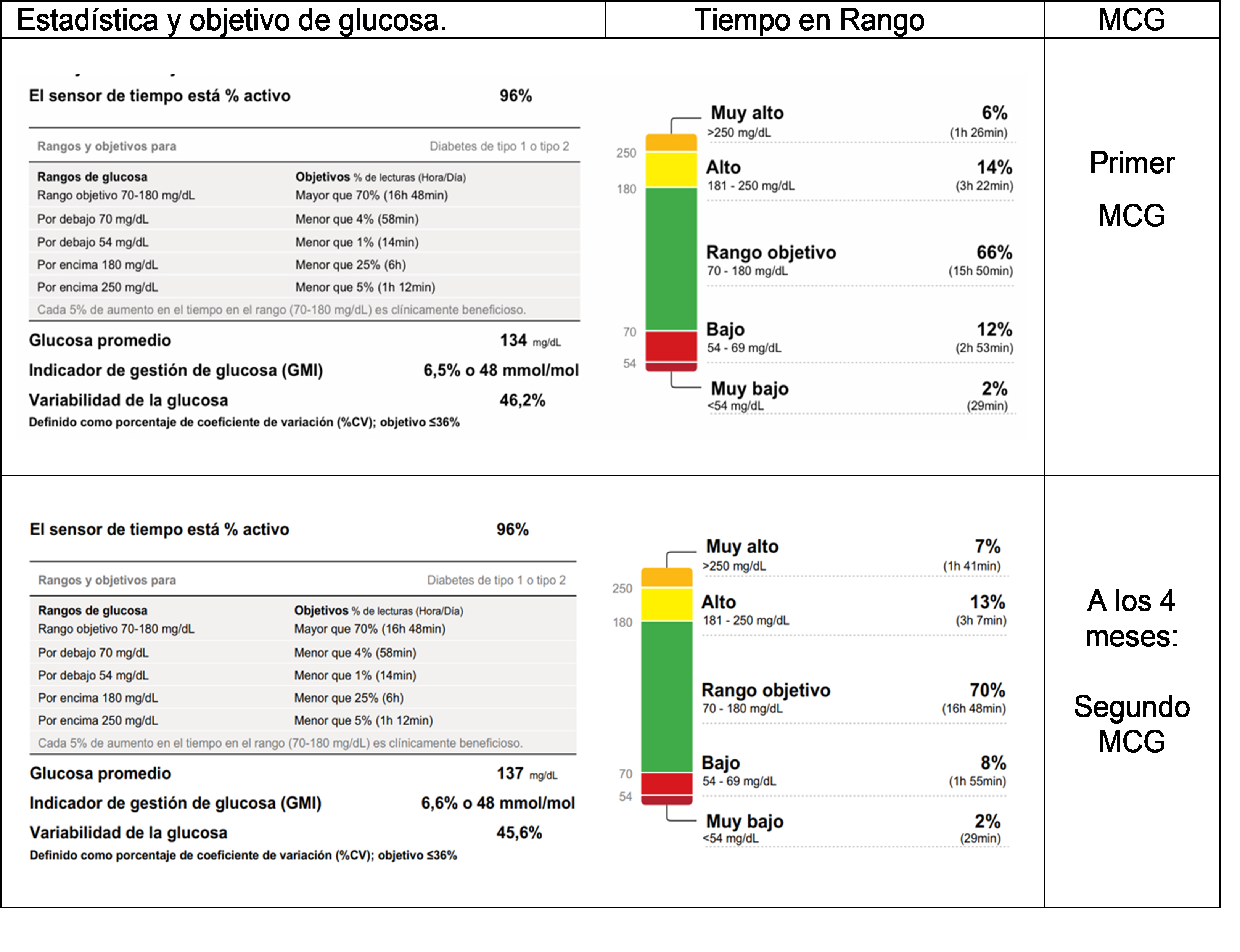
* MCG: Monitor continuo de Glucosa FreeStyle Libre 2.
La dosis a los cuatro meses de insulina basal con insulina glargina fue de 21 UI/día e insulina lispro 3/3/3 UI/día. Paciente refiere menos hipoglicemias y mejor calidad de vida, además de comprender mejor el efecto de la cantidad de carbohidratos lo que le permite tener más control sobre la enfermedad.
DISCUSIÓN
La hipoglicemia causa alteraciones cognitivas y está asociada a mortalidad en 4-10% de pacientes con DM1 habiéndose descrito casos de pacientes que mueren durante el sueño luego de periodos largos de hipoglicemia asintomáticos (9,10). En el presente reporte, nuestra paciente disminuyó el número de eventos hipoglicémicos entre el primer y el segundo MCG de 24 a 18 episodios respectivamente. Aunque el promedio de duración fue similar (120 minutos versus 117 minutos), el tiempo total de hipoglicemia en los 14 días que duró cada MCG bajó de 3120 minutos (3,8 horas diarias) en el primer MCG a 2106 minutos (2,5 horas diarias) en el segundo MCG. A mayor frecuencia de hipoglicemia, hay mayor hiperglicemia reactiva por el miedo al episodio hipoglicémico (9). Recientemente, las guías internacionales además de la hemoglobina glicosilada recomiendan metas basadas en el MCG como el mayor tiempo en rango, menor tiempo en hipoglicemia y menor variabilidad glucémica para mitigar complicaciones a largo plazo (11).
En el caso de nuestra paciente, ella reportó una disminución de los episodios de hipoglicemia con el cambio a análogos de insulina. Esto sugiere que, con el régimen anterior de NPH y regular con el cual tenía mayor dosis diaria de insulina, la exposición a hipoglicemia diaria probablemente era aún peor. El uso del MCG en tiempo real le permitió a la paciente comprender mejor el impacto de la ingesta de carbohidratos y su relación con las dosis de insulina.
La disponibilidad de alarmas de hipoglicemia en el MCG es de especial utilidad en pacientes con historia de hipoglicemias asintomáticas como en nuestra paciente. Muchos de los episodios de hipoglicemia son nocturnos y la alarma acorta el tiempo de exposición a hipoglicemia, como se observó en una paciente en edad pediátrica que no reaccionaba a la hipoglicemia cuando utilizó un MCG sin alerta de hipoglicemia, pero si lo hizo cuando cambió a un MCG con alertas que le ayudó a reducir la duración de hipoglicemia (12).
De especial interés es la falta de reacción de la paciente a la alerta de hipoglicemias del MCG como se observa en el gráfico 2. En el panel superior se observan 20 escaneos (círculos blancos), dos de ellos con hipoglicemia alrededor de las 3 PM. Las 15 horas previas no hubo hipoglicemia. Se observa que el nivel de glucosa sube a los 20 minutos de haberse detectado la hipoglicemia. Al día siguiente la paciente tuvo un episodio de 2 horas de hipoglicemia entre las 2:20 y 4:40 AM. Ella escaneó el MCG a las 4:30 que arrojó un valor de 52 y a los pocos minutos su nivel de glucosa empezó a subir indicando ingesta de carbohidratos. Sin embargo, en la tarde del mismo día ella tuvo un episodio prolongado de hipoglicemia entre la 1pm y 5:30pm. La paciente realizó varios escaneos aproximadamente 1 por hora, varios de ellos correspondientes a hipoglicemia, pero el nivel de glucosa se mantuvo casi al mismo nivel sugiriendo que no hubo ingesta de carbohidratos hasta las 5:30pm, cuando desarrolló hiperglicemia reactiva marcada, mayor de 300 mg/dl por varias horas, sugiriendo una ingesta excesiva de carbohidratos.
Se sabe que la hipoglicemia afecta de manera transitoria y a veces permanente la función cognitiva (13), es posible que los episodios de hipoglicemia frecuentes sobre todo el de ese mismo día hayan afectado la capacidad de tomar decisiones de la paciente predisponiéndola a desarrollar más hipoglicemia ese mismo día por la tarde.

Figura 2: Muestra del Registro Diario de Niveles de Glucosa.
En un reporte previo, se describió el caso de una paciente de 29 años con DM1 de larga duración que utilizó un MCG ciego (Lizarzaburu). El MCG ciego no muestra al paciente el nivel de glucosa en tiempo real sino al final del periodo de uso (6 a 14 días después), en el caso mencionado, el MCG mostró un tiempo en rango objetivo del 17% e hiperglicemias persistentes, se menciona que hubo falta de adherencia al control nutricional y actividad física; controles posteriores al tercer y quinto año mostraron paulatinamente menos hiperglicemias, mejor control glucémico (HbA1c) y con poca evidencia de hipoglicemias, sin embargo alcanzó un IMC mayor que al inicio.
A nuestro entender, el presente reporte es el primer caso peruano de mejora de hipoglicemia severa y disminución de frecuencia de hipoglicemias asintomáticas con el uso de MCG en DM1. La paciente además de visualizar su nivel de glucosa tuvo un seguimiento médico y nutricional bastante cercano lo que potenció la educación nutricional y empoderamiento. Esa mejoría continuó a los 4 meses de seguimiento cuando incluso incrementó el tiempo en rango objetivo de 66% durante el primer MCG hasta el 70% en el segundo MCG, además de una reducción clínicamente significativa de 1.3 horas diarias de hipoglicemia.
En nuestro medio, un estudio piloto de 28 pacientes en población pediátrica y adulta mostró que el uso del MCG, aunque fue por un periodo corto de tiempo fue beneficioso ya sea en diabetes tipo 1 (predominantemente niños) o diabetes tipo 2 (predominantemente adultos). En ese estudio, aquellos que usaron el MCG sistema Libre 14 días con escaneo, pero sin alarma de hipoglicemia, hubo una correlación entre el número de escaneos y tiempo en rango 70-180 mg/dl, mientras que los adultos que usaron el monitor ciego no hubo retroalimentación conductual de la ingesta de carbohidratos al ser el paciente “ciego” al nivel de glucosa (7).
A 100 años del descubrimiento de la insulina, los pacientes con diabetes han empoderado su tratamiento de la diabetes gracias a insulinas más estables y predecibles en su absorción (análogos) y la tecnología del MCG que permite un acercamiento a la terapia ideal del paciente con DM1. En conclusión, El MCG, especialmente incorporando un sistema de alarma, es una herramienta útil a considerar en los pacientes con diabetes e hipoglicemia asintomática ya que permite una optimización de la terapia del esquema de insulinización, empoderamiento del paciente con la ingesta de carbohidratos y el uso de insulinas y una disminución clínicamente significativa en la frecuencia y duración total de hipoglicemia.
Contribuciones de Autoría: SPC, contribuyó en la conceptualización, la recolección de datos, diseño de la metodología, análisis de los datos, redacción del borrador inicial , revisión crítica del artículo, redacción y aprobación de la versión final.
HMH contribuyó en la conceptualización, diseño de la metodología, análisis de los datos, gestionó las actividades de la investigación, redacción y aprobación de la versión final.
JLC contribuyó en la conceptualización, diseño de la metodología, análisis de los datos, gestionó las actividades de la investigación y financiamiento y suministró los recursos para la investigación (Los sensores y escáneres fueron donación del Dr. Leey), redacción y revisión de la versión final.
Financiamiento: Autofinanciado.
Conflictos de intereses: Los autores declaran no tener conflicto de interés.
Recibido: 18 de julio 2022
Aprobado: 14 de octubre 2022
Correspondencia: Sonia H. Pérez Cavero.
Dirección: Jirón San Carlos 711, Surquillo.
Teléfono: (+51) 980516282
Email: sonia.perezcavero7@gmail.com
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS
