ARTICULO DE REVISIÓN
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2022 - Universidad Ricardo Palma10.25176/RFMH.v22i4.5053
EFECTIVIDAD DEL AYUNO INTERMITENTE SOBRE MARCADORES BIOQUÍMICOS Y ANTROPOMÉTRICOS EN ADULTOS OBESOS CON RIESGO CARDIOVASCULAR. UNA REVISIÓN SISTEMÁTICA.
EFFECTIVENESS OF INTERMITTENT FASTING ON BIOCHEMICAL AND ANTHROPOMETRIC MARKERS IN OBESE ADULTS WITH CARDIOVASCULAR RISK. A SYSTEMATIC REVIEW
Francisca Osses-Carrasco1,a, Francisca Gómez-Zúñiga1,a, Miguel Ángel
López-Espinoza1,b
1Carrera de Nutrición y Dietética, Facultad de Salud, Universidad Santo Tomás. Talca, Chile.
a
Licenciatura en Nutrición y Dietética
bNutricionista, Magíster en Salud Pública, Doctorando en Ciencias de la Salud
RESUMEN
Introducción: La obesidad es un problema presente en casi todas las sociedades, lo que ha conllevado a buscar distintos métodos para combatirla. Uno de ellos es el ayuno intermitente (AI), caracterizado por periodos sin ingesta (16 a 24 hr), ingesta calórica limitada o nula, combinada con ventanas de alimentación normal. Objetivo: Determinar la efectividad del ayuno intermitente sobre los marcadores bioquímicos y antropométricos en adultos obesos. Materiales y Métodos. Métodos: Se planteó una revisión sistemática que postuló estudiar ensayos clínicos enmascarados o abiertos de intervenciones de AI, comparado con grupo control. Las variables de respuesta fueron: presión arterial sistólica y diastólica, colesterol total, LDL, HDL y triglicéridos, glicemia, masa grasa, peso, circunferencia de cintura, IMC y frecuencia cardiaca. La búsqueda e identificación de los estudios fue enmascarada. Se evaluaron los riesgos de sesgo de la colaboración Cochrane. Se sometieron a meta-análisis (efecto aleatorio), con R 4.0.0. Resultados: Se incluyeron 6 estudios, de 10-48 semanas de intervención con ayuno en días alternos y alimentación con restricción de tiempo, reportándose algunos cambios estadísticamente significativos para distintas variables (especificar). Conclusión: El ayuno intermitente podría intervenir en la disminución del riesgo cardiovascular por mejoría en IMC y parámetros bioquímicos.
Palabras Clave: Ayuno intermitente; Obesidad; Revisión sistemática; Metabolismo lipídico; Composición corporal; Presión arterial (Fuente: DECS-BIREME).
ABSTRACT
Introduction: Obesity is a problem present in almost all societies, which has led to the search for different methods to combat it. One of them is intermittent fasting (IF), characterized by periods without eating (16 to 24 hours), limited or no caloric intake, combined with normal eating windows. Objective: To determine the effectiveness of intermittent fasting on biochemical and anthropometric markers in obese adults. Methods: A systematic review was proposed that postulated to study blinded or open clinical trials of IA interventions, compared with a control group. The response variables were: systolic and diastolic blood pressure, total cholesterol, LDL, HDL and triglycerides, blood glucose, fat mass, weight, waist circumference, BMI and heart rate. The search and identification of studies was masked. The risks of bias for the Cochrane collaboration were assessed. They underwent meta-analysis (random effect), with R 4.0.0. Results: Six studies were included, involving 10-48 weeks of intervention with alternate-day fasting and time-restricted feeding, reporting some statistically significant changes for different variables. Conclusion: Intermittent fasting could intervene in the reduction of cardiovascular risk due to improvement in BMI and biochemical parameters.
Keywords: Intermittent fasting; Obesity; Systematic review; Lipid metabolism; Body composition; Blood pressure (Source: MESH–NLM).
INTRODUCCIÓN
A nivel mundial, durante las últimas dos décadas la obesidad se ha considerado un problema de salud pública mundial (1,2). Se caracterizada por un aumento de la grasa corporal, con un IMC igual o superior a 30 kg/m2 (3), asociado a múltiples factores bien descritos como: nivel socioeconómico (4), años de estudios (5), ambientes obesogénicos (6), calidad de los alimentos (1), cultura (1), raza (7), sexo (3), genética (8), alteración del sueño (9), consumo de fármacos (10,11), estrés (12), alteraciones hormonales (4), comer frente a pantallas (13) y sedentarismo (14).
La obesidad es un problema frecuente en países con distintas realidades. Según la Organización para la Cooperación y el Desarrollo Económico (OCDE) del 2017 (15,16), destacan: Estados Unidos (40%), Chile (34,4%), México (33,3%), Nueva Zelanda (32,2%), Hungría (30%), Turquía (28,8%), Portugal (28,7%), Canadá (28,1%) y Australia (27,9%).
El peso corporal está controlado por múltiples órganos, hormonas y vías metabólicas, como también factores ambientales. El modelo de balance energético dominante (MBE) y los alimentos procesados de alta densidad calórica explican el aumento de grasas (17). De la mano se observa una serie de comorbilidades como hipertensión arterial, resistencia a la insulina y diabetes, hipercolesterolemia, entre otros (18).
La base del manejo de la obesidad es el control del balance energético al disminuir la ingesta y aumentar el gasto energético (19). A esto se le ha sumado otro tipo de abordajes como dietas de ayuno intermitente, patrones de alimentación donde el individuo pasa un periodo de tiempo con poca o ninguna ingesta de energía, versus periodos intermedios de ingesta normal de alimentos (20). Existen variantes como el ayuno completo en días alternos: ingesta de alimentos en 1 día y luego ayuno al día siguiente (21); ayuno en días alternos: consumo entre el 20-25% del gasto energético total en días de ayuno (22); la alimentación con restricción de tiempo: comidas con cierto valor energético durante la “ventana de alimentos” (20); y por último el ayuno religioso (23).
Según Johnstone (24), se considera que el ayuno intermitente es menos restrictivo en comparación con los métodos tradicionales de restricción de calorías. La variación más popular y utilizada es 16:8, es decir un ayuno de 16 horas y una ventana nutricional de 8 horas (23).
Este tipo de estrategias permite cambios positivos en pacientes con obesidad y comorbilidades, manteniendo el peso corporal promedio, teniendo efectos positivos en el control glucémico, por la disminución de los niveles de insulina (24), según estudios realizados con animales y humanos (20). Aun cuando puede ser una estrategia dietética futura potencialmente interesante para la longevidad (23), sin embargo es incipiente su estudio y no queda claro su efecto en el largo plazo de esta estrategia nutricional.
Por lo tanto, nuestro estudio pretende determinar la efectividad del ayuno intermitente sobre los marcadores bioquímicos y antropométricos en adultos obesos.
MÉTODOS
Diseño y área de estudio
Revisión sistemática de ensayos clínicos basados en los ítems Preferred reporting Items for Systematic reviews an Meta-Analyses (PRISMA) (25).
Población y muestra
Se recopilaron ensayos clínicos aleatorizados (simples o por bloques balanceados), que hayan ocultado la
secuencia de la aleatorización, con o sin enmascaramiento. Los pacientes de ambos sexos que fueron
estudiados, están en un rango de edad entre los 18 a 65 años, con obesidad (IMC ≥ 30 kg/m2), también se
aceptaron pacientes con comorbilidades cardiovasculares (por ejemplo: síndrome metabólico). Las
intervenciones que se estudiaron son: ayuno en días alternos (ADF): consumo del 20 al 25% del gasto
energético total en los días de ayuno programados y alimentación normal por 24 hr; La alimentación con
restricción de tiempo: ayuno en un tiempo determinado, con ventana de alimentación.
El grupo de comparación debe estar caracterizó por el consumo de una dieta habitual. El tiempo de intervención fue
de al menos 10 semanas. Se consideraron las siguientes variables de respuesta: presión arterial
sistólica y diastólica (mmHg), colesterol total, LDL, HDL, triglicéridos, glicemia (mg/dl), IMC (kg/m2),
porcentaje de masa grasa, peso (kg), circunferencia de cintura (cm) y frecuencia cardiaca (lpm). En el
caso que la unidad de medida de los indicadores bioquímicos anteriormente señalados descritos con
mmol/L, se transformaron con factores de conversión (26).
Variables e instrumentos
Se desarrollaron estrategias de búsqueda entre junio y julio del año 2021. Las palabras claves que se utilizaron fueron extraídas de Medical Subject Heading (Mesh) y del lenguaje especíco del tema (palabras de uso libre). Todas las palabras claves fueron aplicadas en PubMed, Cochrane Library y ProQuest.
Las palabras claves fueron ingresadas a todas las bases dedatossegúnelacrónimoPICO(paciente, intervención, comparación y Outcome). En pacientes: “Adult”[Mesh],“Man”[Mesh],“Woman”[Mesh], “Obesity”[Mesh](unidasconelbooleanoOR).En intervención:“completefasting”,“alternatedays”, “scheduledfasting”,“foodwindow”,“religiousfast”, “IntermittentFasting”[Mesh],“Caloric Restriction”[Mesh],“Food”[Mesh],“TimeRestricted Feeding”[Mesh],“EnergyMetabolism”[Mesh].En comparación: “conventional diet”, control. En Outcome: “systolic blood pressure”, “diastolic blood pressure”, “fat mass percentage”, “lean mass percentage”, “biochemical parameters”,“Cholesterol”[Mesh],“Lipoproteins, LDL”[Mesh],“Lipoproteins,IDL”[Mesh],“Lipoproteins, VLDL”[Mesh],“Lipoproteins,HDL”[Mesh], “Triglycerides”[Mesh],“BloodGlucose”[Mesh],“Blood Pressure”[Mesh],“Systolic”[Mesh],“Diastolic”[Mesh], “FatMass”[Mesh],“BodyComposition”[Mesh],“Waist Circumference”[Mesh],“Fast”[Mesh],“Body Weight”[Mesh], “Vascular Diseases”[Mesh], “Metabolic Syndrome”[Mesh],“WeightLoss”[Mesh].Seusóel booleanoORparaunirlaspalabrasclavesque representan cada término del acrónimo PICO, mientras que se usó AND para intersectarlos.
Además, se revisó sitio Clinicaltrials.org para conocer el estado de avance de algún ensayo clínico no publicado. No se aplicaron restricciones de antigüedad ni idioma.
Procedimientos
Dos revisoras previamente enmascaradas y entrenadas identificaron si los títulos de los ensayos clínicos contenían información asociado a la pregunta de investigación y criterios de elegibilidad. Cada una de las revisoras clasificaron los ensayos clínicos como: “incluido”, “excluido” y “dudoso”. Una vez abiertos los resultados, se evaluaron potenciales inconsistencias que fueron resueltos mediante consenso con un tercer revisor. Luego, los artículos disponibles fueron sometidos a lectura completa por las mismas dos revisoras previamente enmascaradas, con el objetivo de clasificar los estudios como “incluido” o “excluido”. Los disensos fueron resueltos por consenso con un tercer revisor.
Las mismas dos revisoras previamente identificadas, de manera enmascarada extrajeron de los artículos incluidos: autor y año de publicación; población; características de la intervención; grupo control; principales resultados. Se aplicó la pauta CONSORT (27) para facilitar la lectura crítica y extracción de la información requerida.
Cada investigadora de forma individual evaluaron los cinco riesgos de sesgo según los dominios sugeridos por la Colaboración Cochrane (28). Cada revisora calificó por cada riesgo de sesgo una de las 3 alternativas siguientes: “bajo”, “alto” o “no claro”. Una vez abierto los resultados se evaluaron el grado de concordancia de las respuestas y en caso de desacuerdo, un tercer investigador colaboró para llegar a una respuesta consensuada. Para este trabajo se aplicó el programa Rev. Manager 5.3 (29).
Análisis estadístico:
Los ensayos clínicos con homogeneidad se sometieron a meta-análisis para obtener diferencias de medias ponderada, con sus respectivos intervalos de confianza del 95%. Se aplicó el efecto de método aleatorio (se asume una variabilidad intra e inter–estudios). El grado de heterogeneidad se midió con I2 y prueba Q de Cochran, con p <0,10. Se aplicó el paquete Metafor (30) en R, versión 4.0.0. (31).
RESULTADOS
Búsqueda de resultados:
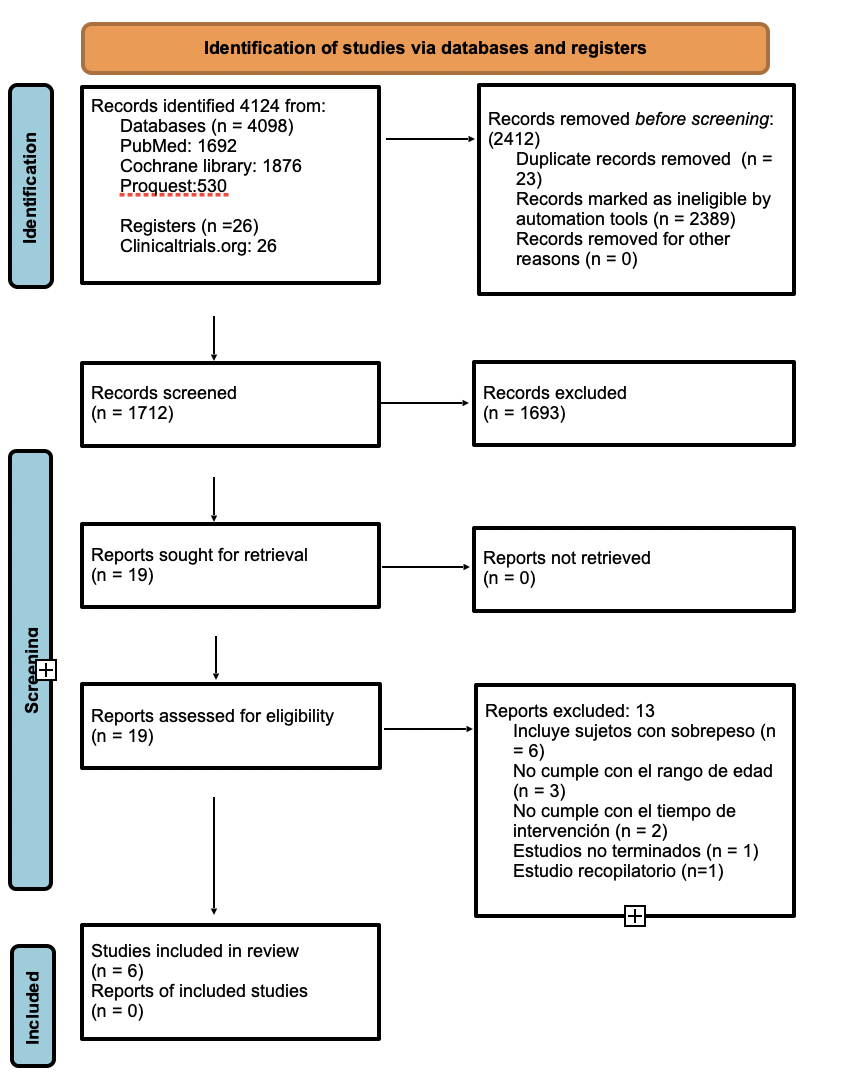
El proceso de búsqueda de los artículos incluidos se presenta en la Figura 1.
Se incluyeron 6 estudios publicados en o antes del 2021 y se utilizaron para la descripción en la fase cualitativa. Se realizó un meta-análisis de dos estudios incluidos en esta revisión sistemática (34,36).
Características de los estudios incluidos:
Las principales características de los estudios incluidos se encuentran disponibles en la Tabla 1. Se realizaron cinco estudios en EE.UU (33,34,36-38) y un estudio en Brasil (35). El número de participantes osciló entre 16 y 83 participante, las edades medias oscilaron entre 25 y 65 años, y la proporción de participantes mujeres osciló entre el 75% y el 88% (33-35), con la excepción de un estudio que incluyó solo a mujeres (36).
Las intervenciones duraron entre 10 y 48 semanas. Cinco de los estudios incluyeron intervenciones de ayuno en días alternos (ADF), donde los sujetos consumieron el 25% de sus necesidades energéticas iniciales en el día de ayuno (24 h) y comieron ad libitum en cada día festivo alterno en 24 hr. Un estudio incluyo una intervención de ayuno con restricción de tiempo (TRF), donde los sujetos consumieron alimentos en un período de 12 horas, y luego manteniendo el ayuno durante las otras 12 horas. Todos los estudios presentaron dos grupos, con excepción de un estudio que tuvo 3 intervenciones y 1 control (37). Todos los estudios evaluaron el peso, IMC y masa grasa (33-38), cinco estudios evaluaron presión arterial (33,35-38), seis estudios evaluaron LDL (33,34,36-38), cuatro estudios evaluaron la frecuencia cardiaca (33,35,37,38), cuatro estudios evaluaron la circunferencia de cintura (34,35,37,38), cinco estudios evaluaron el colesterol total y triglicéridos (33,34,36-38), cuatro estudios evaluaron HDL (33,36-38) y solo un estudio evaluó la glucosa (37).
|
Primer autor, año |
Diseño |
Población de estudio |
Intervención |
Control |
Duración intervención |
|---|---|---|---|---|---|
|
Hoddy K, 2014 |
Estudio de control aleatorizado mediante una muestra estratificada. |
Muestra de 74 sujetos obesos, edad entre 25 a 65 años. ADF-L 20 participantes; 45 ± 3 años. ADF–SM: 20 participantes, 46 ± 2 años. ADF-D: 19 participantes, 45 ± 3 años. Chicago, E.E.U.U. |
Ayuno en días alternos (ADF): Todos los sujetos consumieron el 25% de sus necesidades energéticas iniciales en el día de ayuno (24 h) y comieron ad libitum en cada día de alimentación alterna (24 h). 1) ADF-lunch (ADF-L), 2) ADF-dinner (ADF-D), o 3) ADF-comidas pequeñas (ADF-SM) |
Cada sujeto que participó en un período de referencia de 2 semanas, se les pidió que mantuvieran un peso corporal estable y continuaran con su dieta habitual. |
10 semanas |
|
Bhutani S, 2010 |
Ensayo clínico controlado. |
Muestra de 16 sujetos obesos, grupo de intervención 45 a 51 años. Grupo intervención Mujeres 45 ± 3 años / Hombres 46 ± 5 años mujeres 75% y hombres 25%. Chicago, E.E.U.U. |
Ayuno en días alternos (ADF): Fase de alimentación controlada de ADF: cada sujeto participó en un período de alimentación controlado con ADF de 4 semanas, donde se administró su alimentación. Fase de alimentación autoseleccionada con ADF: los sujetos se sometieron a un período de alimentación autoseleccionado por ADF de 4 semanas, pero no se administró su alimentación. Todos los sujetos consumieron el 25% de sus necesidades energéticas iniciales en el día de ayuno y comieron ad libitum el día de la alimentación. |
Fase de control inicial de 2 semanas. se requirió que cada sujeto mantuviera su peso corporal estable manteniendo sus hábitos alimenticios y de actividad habituales. |
10 semanas |
|
De Oliveira I, 2021 |
Ensayo controlado aleatorio. |
Muestra de 56 mujeres obesas, edad entre los 19 a 44 años en ambos grupos. mujeres 100%. Edad control: 31,03 ± 7,16 años Edad intervención: 31,80 ± 6,96 años Maceió-Alagoas, Brasil. |
Alimentación restringida en el tiempo (TRF) Dieta hipoenergética (con déficit de 500 - 1000 kcal del gasto energético). HC: 45-55%; Lip: 25-30% Prot: 15-25%. Restricción de tiempo para el período de alimentación. Ayuno de 12 horas y ventana de alimento de 12 horas. |
Dieta hipoenergética (con déficit de 500-1000 kcal de gasto energético) HC: 45-55%; Lip: 25-30% Prot: 15-25%. |
48 semanas |
|
Varady K, 2009 |
Ensayo controlado aleatorio |
Muestra de 16 sujetos obesos, 12 mujeres y 4 hombres, los mismos utilizados en el control y la intervención. Edad entre los 35 – 65 años. Chicago, E.E.U.U |
Ayuno en días alternos (ADF): Fase de pérdida de peso de 4 semanas / fase de ingesta de alimentos controlada por ADF: Todos los sujetos consumieron el 25% de sus necesidades energéticas de referencia en el día de "ayuno" (24 h) y luego consumieron alimentos ad libitum en cada día de "alimentación" alternativo (24 h), proporcionando comida a los sujetos. Fase de ingesta de alimentos autoseleccionada de pérdida de peso / ADF de 4 semanas: los sujetos aún consumieron el 25% de sus necesidades energéticas de referencia en el día de ayuno y consumieron alimentos ad libitum el día de la alimentación. Sin embargo, durante este período, no se proporcionó comida a los sujetos |
Se pidió a los sujetos que mantuvieran estable su peso corporal manteniendo sus hábitos habituales de alimentación y ejercicio durante 2 semanas. Como tal, cada sujeto sirvió como su propio control. |
10 semanas |
|
Bhutani S, 2013 |
Ensayo controlado, aleatorizado de brazos paralelos. |
Muestra de 83 participantes obesos, edad entre los 25 a 65 años. Intervención ADF: 25 participantes; 42 ± 2 años Intervención de ejercicio: 24 participantes; 42 ± 2 años. Intervención combinada: 18 participantes; 45 ± 5 años Control: 16 participantes; 49 ± 2 años Chicago, E.E.U.U |
Grupo de combinación y grupo ADF: período de alimentación controlada de 4 semanas (consumieron el 25% de sus necesidades energéticas iniciales en el "día de ayuno" y consumieron alimentos ad libitum en cada "día de alimentación") y un período de alimentación autoseleccionado de 8 semanas (continuaron con el régimen de ADF pero no se les proporcionó comida para el día de ayuno). |
Se pidió a los sujetos del grupo de control y de ejercicio que mantuvieran sus hábitos alimentarios habituales y no se les proporcionó ningún tipo de asesoramiento alimentario o dietético. Los sujetos del grupo de control y de ejercicio consumieron una cantidad ad libitum de comidas todos los días. |
12 semanas |
|
Klempel M, 2012 |
Ensayo controlado, aleatorizado. |
Muestra de 32 participantes obesos, entre los 25 – 65 años. ADF – HF: 15 participantes; 42,4 ± 3 años ADF – LF: 17 participantes; 43,2 ± 2,3 años Chicago, E.E.U.U |
Durante 8 semanas: Intervención ADF-HF (100 g de grasa total) o ADF-LF (55 gr de grasa total) Todos los sujetos consumieron el 25% de sus necesidades energéticas en el día de ayuno (período de 24 horas) y el 125% de sus necesidades energéticas en el día de alimentación (período de 24 horas). Se utilizó la misma composición de macronutrientes |
Durante 2 semanas cada sujeto participó en un período de mantenimiento de peso inicial de 2 semanas en el que consumieron la dieta HF (100 gr de grasa total) o LF (55 gr de grasa total), proporcionando el 100% de sus necesidades energéticas. Se utilizó la misma composición de macronutrientes |
10 semanas |
3.3 Evaluación de riesgo de sesgo:
La evaluación del riesgo de sesgo se presenta en la Figura 2.
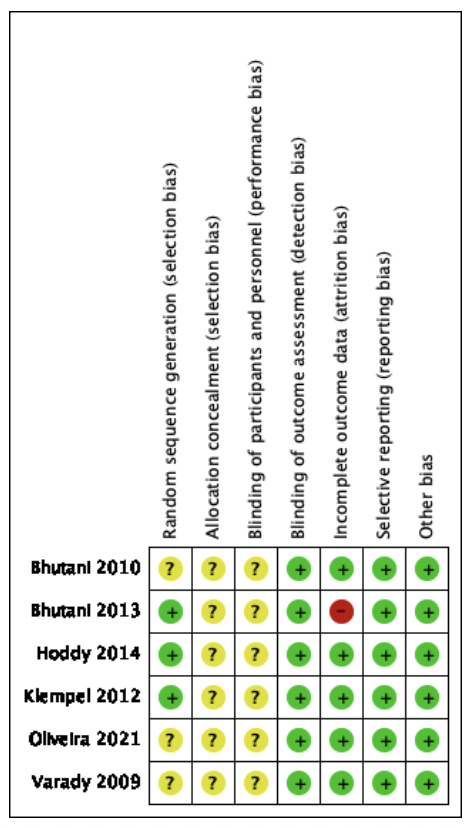
Verde: bajo riesgo de sesgo; amarillo: riesgo de sesgo poco claro; y rojo: alto riesgo de sesgo.
De los 6 estudios incluidos en la RS (ver figura 2), 3 estudios presentaron bajo riesgo de sesgo de selección (33, 37, 38) porque informaron detalles de su generación de secuencia aleatoria. Tres estudios, Bhutani et al., De Oliveira et al. y Varady et al. (34-36) presentaron un riesgo de sesgo de selección no claro, ya que no señala como fueron seleccionados los participantes del estudio. De los 6 estudios no se señaló claramente un método de ocultación de la secuencia de asignación, por lo que tiene un riesgo de sesgo no claro.
Todos los estudios evaluados tienen un riesgo de sesgo de realización o desempeño poco claro, ya que no señala si el administrador se mantiene enmascarado.
En cuanto al riesgo de detección, todos los estudios incluidos en esta revisión sistemática tienen un bajo riesgo de sesgo, si bien el estudio es abierto, los administradores del tratamiento no pueden interferir en la medición de la variable de respuesta, porque se utilizaron instrumentos automatizados.
Con respecto al sesgo de desgaste o seguimiento, cinco estudios presentaron bajo riesgo, mientras que Bhutani et al. (37) tuvo un alto riesgo de sesgo, ya que hay una gran diferencia en el número y sexo de participantes en cada intervención.
En el sesgo de reporte, todos los estudios presentaron un bajo riesgo de sesgo, ya que se informaba el reporte de los hallazgos significativos del estudio.
Resultados de los estudios incluidos:
Los principales resultados de los estudios incluidos se resumen en la Tabla 2. De los 6 paper utilizados en la revisión sistemática se encontraron diferencias estadísticamente significativas en la pérdida de peso e IMC (Tabla 2-A) al final de las intervenciones, en el caso de Hoddy et al. (33), Bhutani et al. (34), Varady et al. (36), Klempel et al. (38) con 10 semanas de intervención y Bhutani et al. (37) con 12 semanas de intervención, disminuyendo el peso corporal en un rango 3 a 6 kg e IMC en un rango de 1 a 3 kg/m2 aproximadamente. No obstante, De Oliveira et al. (35) no presento cambios significativos después de 48 semanas de intervención en ambas variables.
Tabla 2-A. Resultados de los estudios incluidos
|
Primer autor, año |
Peso (kg) |
IMC (kg/m2) |
Masa grasa (kg) |
LDL (mg/dl) |
PA (mmHg) |
Glucosa (mg/dl) |
|---|---|---|---|---|---|---|
|
Hoddy K, 2014 |
Tamaño del efecto (pre-post): ADF–L: 3,5±0,4 (P <0,001) ADF–D: 4,1±0,5 (P <0,001) ADF–SM: 4,0±0,5 (P <0,001)
|
Tamaño del efecto (pre-post): ADF-L: 1.3±0.2 (P <0,050) ADF-D: 1.4±0.2 (P <0,050) ADF-SM: 1.5±0.2 (P <0,050)
|
Tamaño del efecto (pre-post): ADF-L: 0,075±0,027 (P <0,001) ADF-D: 0,135±0,042 (P <0,001) ADF-SM: 0,135±0,032 (semanal) (P <0,001) |
ADF – L: Pre:114±11 Post: 113±9 (P=0,540) ADF – D: Pre:120±6 Post: 119±8 (P= 0,980) ADF–SM: Pre:110±7 Post:110±7 (P= 0,790)
|
PAS: ADF – L: Pre:115±3 Post: 112±3 (P=0,570) ADF – D: Pre:117±3 Post: 112±2 (P=0,070) ADF – SM: Pre:119±3 Post: 112±3 (P=0,040)
PAD: ADF – L: Pre:78±2 Post: 76±2 (P=0,560) ADF – D: Pre: 79±2 Post: 76±1 (P=0,150) ADF – SM: Pre: 83±1 Post: 79±1 (P=0,600)
|
|
|
Bhutani S, 2010 |
Pre: 96±5,3 kg IAC (día 42): Post: 93,7±5 (P <0,050) IAA (día 70) Post: 90,8±4,8 (P <0,050) |
Pre: 33,7±1 IAC (día 42) Post: 32,8±0,9 (P <0,050) IAA (día 70) Post: 31,4±0.9 (P <0,050) |
Pre: 43±2,2 IAC (día 42) Post: 41,3±2,7 (P <0,050) IAA (día 70) Post: 38,1±1,8 (P <0,050) |
Pre: 106±10 IAC (día 42) Post: 73±9 (P <0,050) IAA (día 70) Post: 72±8 (P <0,050) |
|
|
|
De Oliveira I, 2021 |
HD: Pre: 80,25±9,4 Post: 77,53 CI95% [71,99; 83,07] HD+TRF: Pre: 81,25±13,51 Post: 87,33 CI95% [76,81; 97,84]* (P=0,960)
|
HD: Pre: 33,12±3,63 Post: 77,53 CI95% [71,99; 83,07] HD+TRF: Pre: 33,53±4,53 Post: 87,33 CI95% [76,81; 97,84]* (P=0,840)
|
HD: Pre: 43,55±4,7% Post: 44,24 CI95% [41,13; 47,35]
HD+TRF: Pre: 44,41±5,47% Post: 46,21 CI95% [42,69;49,74]* (P=0,020) |
|
PAS: HD: Pre:124,03±11,28 Post: 119,44 CI95% [115,47;123,41] HD+TRF: Pre: 127,1±15,29 Post: 122,41 CI95% [116,49;128,34]* (P=0,480)
PAD: HD: Pre: 86,51±10,08 Post: 82,29 CI95% [78,05;86,54] HD+TRF: Pre: 86,2±13,2 Post: 83,8 CI95% [79,55;88,05]* (P=0,460) |
|
|
Varady K, 2009 |
Tamaño del efecto (pre-post): IAC – ADF: 0,67±0,1 (semana) IAA – ADF: 0,68±0,1 (semana) (P <0,001)
|
Pre: 33,7±1,0 IAC-ADF: Post: 32,8±1,0 (P <0,001) IAA-ADF: Post: 29,9±2,1 (P <0,010) |
Tamaño de efecto (post – pre): 5,4 ± 0,8 kg (P <0,010) |
Pre: 102±9 IAC-ADF: Post: 73±9 IAA-ADF: Post: 72±8 (P <0,010) |
Tamaño del efecto (pre-post): PAS: IAC – ADF: 4,4±1,8% IAA – ADF: 5,1±1,6% (P <0,050)
PAD: Pre: 80,3 ± 2,7
IAC-ADF: Post: 79,2±2,1 IAA-ADF: Post: 78,8±2,5 NS |
|
|
Bhutani S, 2013 |
Combinación: Pre: 91±6 Post: 85±6 (p<0,001)
ADF: Pre: 94±3 Post: 91±3 (p<0,001)
Ejercicio: Pre: 93±2 Post: 92±2 (p=0,027)
Control: Pre: 93±5 Post: 93±5 (p=0,577)
|
Combinación: Pre: 35±1 Post: 33±1 (p<0,001)
ADF: Pre: 35±1 Post: 34±1 (p<0,001)
Ejercicio: Pre: 93±2 Post: 34±1 (p=0,030)
Control: Pre: 93±5 Post: 35±1 (p=0,707)
|
Combinación: Pre: 45±2 Post: 40±2 (p<0,001)
ADF: Pre: 43±2 Post: 41±2 (p=0,008)
Ejercicio: Pre: 46±2 Post: 45±2 (p=0,182)
Control: Pre: 43±4 Post: 43±4 (p=0,570) |
Combinación: Pre: 125±9 Post: 109±11 (p=0,043)
ADF: Pre: 113±8 Post: 112±9 (p=0,917)
Ejercicio: Pre: 113±5 Post: 113±7 (p=0,947)
Control: Pre: 119±6 Post: 123±8 (p=0,586)
|
PAS: Combinación: Pre: 113±3 Post: 111±3 (p=0,262) ADF: Pre: 124±3 Post: 120±3 (p=0,007)
Ejercicio: Pre: 113±2 Post: 115±3 (p=0,284)
Control: Pre: 122±5 Post: 129±6 (p=0,603)
PAD: Combinación: Pre: 76±2 Post: 76±2 (p=0,939) ADF: Pre: 82±2 Post: 80±2 (p=0,034) Ejercicio: Pre: 71±2 Post: 76±2 (p=0,976) Control: Pre: 76±3 Post: 84±4 (p=0,480) |
Combinación: Pre: 94±2 Post: 92±3 (p=0,589) ADF: Pre: 98±5 Post: 95±5 (p=0,146)
Ejercicio: Pre: 92±2 Post: 91±2 (p=0,862)
Control: Pre: 109±7 Post: 111±6 (p=0,637)
|
|
Klempel M, 2012 |
Tamaño del efecto (pre-post): ADF-HF: 4.3 ± 1.0 ADF-LF: 3.7 ± 0,7 (P <0,0001)
|
Tamaño del efecto (pre-post): ADF-HF: 1,7 ± 0,4 ADF-LF: 1,5 ± 0,3 (P <0,0001)
|
ADF-HF: Pre: 43,7±1,9 Post: 38,3±1,8
ADF-LF: Pre: 43,6±1,8 Post:39,4±39,4 (P <0,0001)
|
ADF-HF: Pre: 119±10 Post: 90 ± 7
ADF-LF: Pre: 124±6 Post: 85 ± 7 (P <0,0001)
|
PAS: ADF-HF: Pre: 111±2 Post: 109±2
ADF-LF: Pre: 116±3 Post: 118±3 NS
PAD: ADF-HF: Pre: 77±3 Post: 75±2
ADF-LF: Pre: 75±2 Post: 81±3 NS |
Tabla 2-B. Resultados de los estudios incluidos
|
Primer autor, año |
FC (lpm) |
CC (cm) |
Col-T (mg/dl) |
TG (mg/dl) |
HDL (mg/dl) |
|---|---|---|---|---|---|
|
Hoddy K, 2014 |
ADF – L: Pre: 69±3 Post: 64±2 (P<0,001) ADF – D: Pre: 71±2 Post: 68±2 (P=0,050) ADF – SM: Pre: 72±3 Post: 72±3 (P=0,800) |
|
ADF – L: Pre: 190±11 Post: 184±9 (P=0,920) ADF – D: Pre: 199±8 Post: 190±8 (P=0,190) ADF – SM: Pre:185±8 Post: 181±7 (P=0,820) |
ADF – L: Pre: 104±15 Post: 96±14 (P=0,380) ADF – D: Pre: 108±14 Post: 101±12 (P=0,100) ADF – SM: Pre: 94±9 Post: 84±9 (P=0,910) |
ADF – L: Pre: 55±3 Post: 52±3 (P=0,220) ADF – D: Pre: 57±4 Post: 54±3 (P=0,700) ADF – SM: Pre: 57±3 Post: 55±3 (P=0,690) |
|
Bhutani S, 2010 |
|
Pre: 109±2 IAC (día 42) Post: 106±3 (P <0,050) IAA (día 70): Post: 105±3 (P <0,050) |
Pre: 175 ± 8 IAC (día 42) Post: 140±7 (P <0,050) IAA (día 70): Post: 138±8 (P <0,050) |
Pre: 136±17 IAC (día 42) Post: 110±17 (P <0,050) IAA (día 70): Post: 88±15 (P <0,050) |
|
|
Oliveira I, 2021 |
HD: Pre: 71,85±9,48 Post: 73,74 CI95% [69,62;77,85] HD+TRF: Pre: 76,27±8,79 Post: 74,35 CI95% [71,79;76,91]* (P=0,110) |
HD: Pre: 98,86±9,61 Post: 97,07 CI95% [91,15; 102,98] HD+TRF: Pre: 102,79±3,27 Post: 103,84 CI95% [95,32; 112,36]* (P=0,100) |
|
|
|
|
Varady K, 2009 |
Se redujo significativamente (P <0,050) No informa los valores, pero si la tendencia en una figura. |
|
Pre: 175±8 IAC-ADF: Post: 140±7 IAA-ADF: Post: 138±8 (P <0,001) |
Pre: 125±15 IAC-ADF: Post: 110±17 IAA-ADF: Post: 88±15 (P <0,010) |
Pre: 48±4 IAC-ADF: Post: 45±4 IAA-ADF: Post: 46±3 NS |
|
Bhutani S, 2013 |
Combinación: Pre: 78±2 Post: 76±2 (p=0,384) ADF: Pre: 75±2 Post: 75±2 (p=0,711) Ejercicio: Pre: 71±2 Post: 71±2 (p=0,925) Control: Pre: 76±3 Post: 77±3 (p=0,763) |
Combinación: Pre: 91±2 Post: 88±1 (p<0,001) ADF: Pre: 100±2 Post: 95±2 (p<0,001) Ejercicio: Pre: 98±2 Post: 95±2 (p<0,001) Control: Pre: 99±3 Post: 97±2 (p=0,640) |
Combinación: Pre: 190±10 Post: 186±12 (p=0,658) ADF: Pre: 171±8 Post: 183±11 (p=0,053) Ejercicio: Pre: 181±6 Post: 181±8 (p=0,921) Control: Pre: 185±7 Post: 187±10 (p=0,784) |
Combinación: Pre: 77±7 Post: 87±8 (p=0,161) ADF: Pre: 81±7 Post: 86±8 (p=0,341) Ejercicio: Pre: 74±6 Post: 79±5 (p=0,290) Control: Pre: 97±13 Post: 102±11 (p=0,452) |
Combinación: Pre: 50±3 Post: 59±4 (p=0,041) ADF: Pre: 49±2 Post: 49±3 (p=0,807) Ejercicio: Pre: 51±2 Post: 52±3 (p=0,457) Control: Pre: 52±3 Post: 56±3 (p=0,166) |
|
Klempel M, 2012 |
ADF-HF: Pre: 75±3 Post: 77 ± 3 ADF-LF: Pre: 76±3 Post: 73 ± 2 NS |
ADF-HF: Pre: 98±1,8 Post: 91±1 ADF-LF: Pre: 98,8±2.1 Post: 91,5±2.1 (P <0,001) |
ADF-HF: Pre: 206±11 Post: 172±9 ADF-LF: Pre: 201±6 Post: 162±7 (P <0,0001) |
ADF-HF: Pre: 125±17 Post: 108±15 ADF-LF: Pre: 108±13 Post: 83±10 (P <0,001) |
ADF-HF: Pre: 63±5 Post: 108±15 ADF-LF: Pre: 60±4 Post: 83±10 NS |
En los 6 estudios incluidos (33-) se encontraron diferencias estadísticamente significativas para la variable de masa grasa (Tabla 2-A), con una duración de las intervenciones de un rango de 10 a 48 semanas, disminuyendo 1,3 a 5,4 kg aproximadamente.
En el caso de la variable de circunferencia de cintura (Tabla 2-B) los estudios demostraron que hay una diferencia significativa en los estudios de Bhutani et al. (34), Klempel et al. (38) y Bhutani et al.(37), con un rango de 10 a 12 semanas de intervención y una disminución de 4 a 7 cm. En el caso De Oliveira et al. (35) no presentó cambios significativos para esta variable.
En cuanto al perfil lipídico (Tabla 2-B) se pudieron observar cambios significativos, tanto para el colesterol total, colesterol LDL y triglicéridos en los estudios de Bhutani et al. (34), Varady et al. (36) y Klempel et al. (38), los cuales tienen un tiempo de duración de 10 semanas. Por otra parte Hoddy et al. (33) y Bhutani et al. (37) no presentaron cambios estadísticamente significativos en intervenciones de 10 y 12 semanas respectivamente. De Oliveira et al. (38) no presento resultados a estas variables.
Solo 4 estudios evaluaron el colesterol HDL (Tabla 2-B), Hoddy et al. (33), Varady et al. (36), Bhutani 20 et al. 13 (37) y Klempel et al. (38), de los cuales no presentaron cambios significativos para la variable, variando entre las 10 y 12 semanas de intervención. De Oliveira et al. (35) no presentó resultados.
La variable de glucosa solo fue estudiada por Bhutani et al. (37), con 12 semanas de intervención en la cual no se generó una diferencia estadísticamente significativa (Tabla 2-A).
En cuanto a la frecuencia cardiaca (Tabla 2-A), fue analizada en 5 estudios, presentando una diferencia significativa en el estudio de Varady et al. (36) y en el de Hoddy et al. (33). Ambos estudios fueron desarrollados en un tiempo de 10 semanas. Éste último solo mostró una diferencia significativa en ADF-L (ayuno en días alternos en almuerzo), marcando una desigualdad entre pre y post estudio de 6 pulsaciones por minuto, pero no así para ADF-D y ADF-SM.
De los 6 estudios incluidos, solo se encontró diferencias significativa en la PAS para el estudio de Varady et al. (36), en la cual se redujo significativamente después de completar la fase de ingesta controlada y autoseleccionada de alimentos, durante 10 semanas de intervención (Tabla 2-A).
Resultados del metaanálisis
Solo se dispuso de 2 estudios (34, 36) en relación a cinco variables: IMC, masa grasa, colesterol total, colesterol LDL y triglicéridos. Ambos ensayos tienen el mismo tiempo de intervención de 10 semanas. Se apreció que el ayuno intermitente en días alternos provocó un cambio significativo en el IMC (DMP = -3,93; IC del 95%: -5,01; -2,85 kg/m2). Con respecto a los tamaños del efecto del ayuno intermitente en masa grasa, en los mismos dos estudios (34, 36), con el mismo tiempo de intervención, se encontraron tamaños del efecto medio observados estadísticamente significativos (DMP = -5,12, 95% CI -6,16; -4,08 kg). Respecto al perfil lipídico, para colesterol total se encontró una DMP = -37,00 (IC 95%: -40,91; -33,01 mg/dl) y para LDL una DMP = -31,88 (IC 95%: -36,17; -27,58 mg/dl). Para triglicéridos también el cambio fue estadísticamente significativo (DMP = -42,32, IC 95%: -53,09; -31,55 mg/dl). El detalle está disponible en (Tabla 3).
Tabla 3. Resultados metaanálisis.
|
Variable de respuesta |
Primer autor y año |
Muestra intervenida |
Muestra control |
Peso (%) |
Diferencia de media |
IC 95% |
Heterogeneidad |
||
|---|---|---|---|---|---|---|---|---|---|
|
I2 |
Q |
P-valor |
|||||||
|
Intervención: Ayuno en Días Alternos (ADF) |
|||||||||
|
IMC (kg/m2) |
Buthani 2010 |
16 |
16 |
9,50 |
-5,20 |
-8,71; -16,9 |
|
|
|
|
Varady 2009 |
16 |
16 |
90,50 |
-3,80 |
-4,94; -2,66 |
|
|
|
|
|
DMP * |
32 |
32 |
100,00 |
-3,93 |
-5,01; -2,85 |
0 |
0,5536 |
0,4569 |
|
|
Masa grasa (kg) |
Buthani 2010 |
16 |
16 |
55,94 |
-4,90 |
-6,29; -3,51 |
|
|
|
|
Varady 2009 |
16 |
16 |
44,06 |
-5,40 |
-6,97; -3,83 |
|
|
|
|
|
DMP * |
32 |
32 |
100,00 |
-5,12 |
-6,16; -4,08 |
0 |
0,2185 |
0,6402 |
|
|
c-LDL (mg/dl) |
Buthani 2010 |
16 |
16 |
46,94 |
-34,00 |
-40,27; -27,73 |
|
|
|
|
Varady 2009 |
16 |
16 |
52,06 |
-30,00 |
-35,90; -24,10 |
|
|
|
|
|
DMP * |
32 |
32 |
100,00 |
-31,88 |
-36,17; -27,58 |
0 |
0,8290 |
0,3626 |
|
|
c-Total (mg/dl) |
Buthani 2010 |
16 |
16 |
48,37 |
-48,00 |
-59,09; -36,91 |
|
|
|
|
Varady 2009 |
16 |
16 |
51,63 |
-37,00 |
-47,39; -26,61 |
|
|
|
|
|
DMP * |
32 |
32 |
100,00 |
-37,00 |
-40,91; -33,01 |
0 |
0 |
1,000 |
|
|
Triglicéridos (mg/dl) |
Buthani 2010 |
16 |
16 |
48,37 |
-48,00 |
-59,09; -36,91 |
|
|
|
|
Varady 2009 |
16 |
16 |
51,63 |
-37,00 |
-47,39; -26,61 |
|
|
|
|
|
DMP * |
32 |
32 |
100,00 |
-42,32 |
-53,09; -31,55 |
50,31 |
2,0125 |
0,1560 |
|
La variable peso no se pudo someter a meta-análisis debido a que los resultados de comparación son diferentes, expresando los resultados de distintas formas, donde Buthani et al. (34) expresa el peso inicial y final del estudio en kg totales, en cambio Varady et al. (36) presenta el cambio de peso en kg/semana, por lo que las autoras de este estudios tomaron la decisión de no incluirlo.
DISCUSIÓN
Los resultados de nuestra la revisión sistemática y meta-análisis tuvieron como objetivo determinar la efectividad del ayuno intermitente sobre los marcadores bioquímicos y antropométricos en adultos obesos con riesgo cardiovascular, en un rango de edad de 18 a 65 años. En este contexto, para las variables peso e IMC encontramos cambios favorables en intervenciones de ayuno intermitente en días alternos (ADF) (33, 34, 36-38), entre 10 y 12 semanas. De hecho, los meta-análisis aplicados plantearon un diferencia estadísticamente significativa. Esto puede explicarse a la utilización de la masa grasa como sustrato energético en el periodo de ayuno, ya que normalmente el sustrato energético utilizado por los tejidos corresponde a hidratos de carbono, otorgados a través de la alimentación o reservas. Debido al agotamiento de estos depósitos se derivan las rutas metabólicas hacia la lipólisis, con la obtención de ácidos grasos libres como fuente de energía y la disminución del gasto energético metabólico a consecuencia del ayuno fisiológico, de esta manera disminuye el peso corporal y por ende el IMC. Sin embargo, el estudio De Oliveira et al. (35) publicó una experiencia con la alimentación restringida en el tiempo (TRF), con una duración de 48 semanas, donde no hubo diferencias al final de la intervención. Esto se puede deber al tiempo prolongado del estudio, donde la adherencia de los participantes se ve disminuida durante los meses sin seguimiento por nutricionista, reflejados en los resultados antropométricos y bioquímicos del ensayo clínico. El estudio demostró que al no llevar un ambiente estrictamente controlado, no provocaba una adherencia y mantenimiento de la pérdida de peso a lo largo del estudio en las participantes.
En el caso de la masa grasa en intervenciones de ADF, nuestra revisión sistemática presenta un cambio positivo en los estudios, con una disminución en kg (33, 34, 36-38), y es concordante con el meta-análisis realizado, y también para la circunferencia de cintura (CC) (34, 37,38). Estos datos sugieren que la pérdida de peso observada con ADF se debe a una disminución de la masa grasa y no a la masa libre de grasa (34) , disminuyendo la tasa metabólica en reposo, lo que permite una mayor capacidad de utilización de energía (37) .
Para la variable colesterol total, LDL y TG hubo una disminución de estas variables con ADF (34, 36,38), las que tuvieron un tiempo de intervención de 10 semanas, de igual forma lo plantea el meta-análisis realizado. La oxidación de los ácidos grasos libres (AGL) circulantes aumenta durante los períodos de pérdida de peso, mientras que la síntesis de AGL disminuye (39,40). También se observa una relación entre el aumento de las concentraciones de adiponectina y la disminución de los niveles de colesterol LDL y TG después del tratamiento, donde se plantea que la adiponectina puede disminuir el suministro de AGL al hígado para la gluconeogénesis, disminuyendo así la síntesis de TG. Esta disminución da como resultado una secreción atenuada de VLDL, que a su vez disminuiría las concentraciones de colesterol LDL en el plasma (40).
Para la variable HDL no hubo cambios en los estudios (33, 36-38). La evidencia sugiere que el colesterol HDL puede requerir más de 16 semanas para generar un cambio (38), ya que las concentraciones generalmente aumentan con el ejercicio dependiendo la intensidad, por lo que se requiere un ambiente controlado bajo supervisión al momento de combinar ADF con ejercicio (41, 42). Por este motivo no se puede afirmar rotundamente que se produzca un aumento siguiendo un protocolo de ayuno intermitente. Se debe investigar más al respecto en futuros estudios (43).
La frecuencia cardiaca fue analizada en cinco estudios, presentando una disminución de los latidos por minuto solo en dos (33, 36). Esto puede ser causado por la reducción de los marcadores de inflamación sistémica y estrés oxidativo asociados con la aterosclerosis, aumentando la variabilidad de la frecuencia cardiaca al mejorar el tono parasimpático (44), aunque según lo descrito en otros estudios los hallazgos también son algo sorprendente, ya que el ADF generalmente no mejora la frecuencia cardiaca (37, 38). De igual manera la presión arterial sistólica solo tuvo cambios favorables en un estudio (36). Esto puede estar causado por la disminución de peso y cambios en los hábitos alimentarios (45, 46) los parámetros anteriores mejoran cuando la dieta del ayuno intermitente es combinada con un programa de ejercicio físico, en pacientes con obesidad (37, 46).
Desde un punto de vista global, podemos mencionar que las variables mencionadas anteriormente se ven afectadas, ya que ayuno induce la alteración coordinada de mecanismos metabólicos y transcripcionales. Luego de 12 a 36 horas de ayuno, el cuerpo humano entra en un estado fisiológico de cetosis caracterizado por niveles bajos de glucosa en sangre, disminución del depósito de glucógeno en hígado, y la producción hepática de cuerpos cetónicos (48). La producción de cuerpos cetónicos genera una oxidación de los ácidos grasos como fuente de energía, lo que se puede ver reflejado en la disminución de los parámetros bioquímicos y antropométricos (49).
Este estudio no ha estado exento de limitaciones. La primera da cuenta de la escasa cantidad de estudios que logramos recopilar, por lo tanto la evidencia es poco robusta para llegar a un resultado confiable, sin embargo estos estudios son ensayos clínicos que obedecen a la mejor calidad de la evidencia disponible para el momento. De igual modo quisimos meta-analizar para aprovechar la escasa evidencia disponible y demostrar un resultado cuantitativo, para reforzar la evidencia cualitativa de nuestra revisión. Es más, el estudio de Davey et al. (50) demuestra que el número de estudios elegibles para los meta-análisis suele ser muy pequeño para todas las áreas médicas, los resultados y las intervenciones cubiertas por las revisiones Cochrane. Debido a lo anterior, se puede considerar abrir otros diseños, como también replicar esta búsqueda para los próximos cinco años para evaluar si hay más ensayos clínicos que cumplan los criterios y entren a una segunda versión de esta RS.
También se observa un tamaño de muestra intra-estudio con pocos participantes entre 16 a 83 personas, por lo que la evidencia puede sobreestimar los resultados obtenidos, no obstante, los estudios incluidos en esta revisión sistemática se caracteriza por presentar un control en los procedimientos realizados que exigen las intervenciones. Por lo que se recomienda realizar estudios aumentando el tamaño de la muestra.
De la misma forma se puede observar algunos estudios con un tiempo de intervención de 1 año sin lograr cambios favorables, debido a una poca adherencia al tratamiento, repercutiendo directamente en las variables de respuesta. Los demás estudios incluidos con un tiempo de intervención de 10 a 12 semanas, presentaron mejor adherencia al tratamiento. Por lo que se recomienda tener un seguimiento constante durante el tiempo de intervención, favoreciendo la adherencia de los participantes para la obtención de resultados positivos.
Encontramos pocos estudios de larga extensión, en consecuencia se desconoce los resultados a largo plazo en este tipo de intervención. No obstante, los estudios de menor duración tuvieron un impacto positivo en las variables. Por lo que, no se puede comprobar la efectividad del ayuno intermitente en periodos prolongados. Nuestra recomendación para posibles estudios a futuro es determinar la efectividad a largo plazo.
Ningún estudio presentó efectos adversos en los participantes asignados a los grupos de comparación, por lo tanto, en sí no reportan efectos secundarios es una falencia de la evidencia, limitando la capacidad de análisis de los resultados. Es por eso que proponemos evidenciar los efectos adversos, para comprobar la seguridad e integridad de los participantes en este tipo de tratamiento en estudios a futuro.
Solo se pudo realizar el meta-análisis de 2 estudios con un tamaño de muestra de 16 participantes en cada uno, por lo que el poder estadístico es bajo, aunque según Davey et al. (50), el mínimo de estudios necesarios para ser elegibles para un meta-análisis es de dos estudios y con solo dos individuos. Los estudios incluidos en esta revisión son de alta calidad y con un grado de heterogeneidad moderada a baja, con una baja variabilidad entre los estudios.
Independiente de las limitaciones mencionadas se espera que en próximos estudios de esta naturaleza se realicen intervenciones de tiempo prolongado con una mayor cantidad de participantes, aumentando la adherencia a la dieta ADF, esperando mejores resultados. No obstante, los resultados encontrados son relevantes, ya que se revisaron estudios de la máxima calidad, debido a que se incluyeron ensayos clínicos, mostrando cambios relevantes en intervenciones de 10 a 12 semanas, con cambios favorables en parámetros bioquímicos y antropométricos. Con esta revisión sistemática dejamos en evidencia el estado actual de la investigación respecto a la eficacia del ayuno intermitente en pacientes obesos, por lo tanto, se anima a investigadores a diseñar más estudios para comprobar con mayor grado de potencia estadística los resultados en relación a la hipótesis del estudio.
CONCLUSIÓN
En conclusión, podemos determinar que existe evidencia que permite pensar una relación favorable entre un ayuno intermitente y la disminución de riesgo cardiovascular en pacientes obesos, como estrategia dietoterapéutica para un posible enfoque nutricional, generando cambios en distintas variables como peso, IMC, masa grasa, perfil lipídico, circunferencia de cintura, presión arterial sistólica y frecuencia cardiaca. La disminución de peso y el efecto producido por el ayuno podría ayudar a reducir las grasas, mejorando el perfil lípido de los grupos intervenidos, durante un tiempo establecido, donde en estudios con un tiempo de intervención de 10 a 12 semanas, hubo cambios interesantes.
Contribuciones de Autoría: FO-C participó en la concepción del artículo, la recolección de datos, su redacción y aprobación de la versión final. FG-Z participó en la concepción del artículo, la recolección de datos, su redacción y aprobación de la versión final. ML-E participó en la concepción del artículo, el análisis estadístico de datos, su redacción y aprobación de la versión final.
Financiamiento: Autofinanciado.
Conflictos de intereses: Los autores declaran no tener conflicto de interés.
Recibido: 18 de abril, 2022
Aprobado: 04 de julio, 2022
Correspondencia: Prof. Miguel López-Espinoza.
Dirección: Campus Centro de Alto Rendimiento. Circunvalación Poniente N° 1855, Talca, Chile.
Teléfono:+56942629804
Email: mlopez34@santotomas.cl
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS