ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2022 - Universidad Ricardo Palma10.25176/RFMH.v22i4.5115
MAYTENUS MACROCARPA “CHUCHUHUASI” DISMINUYE LA CALIDAD ESPERMÁTICA Y LA FERTILIDAD EN RATONES
MAYTENUS MACROCARPA “CHUCHUHUASI” DECREASE THE FERTILITY AND SPERM QUALITY IN MICE
Jonathan Vásquez Cavero1,2,a, Pilar Pino Velásquez1,a,b, José Gonzáles Daga1,a,c, Eduardo Pulido-Murillo3,d, José Pino Gaviño1,a
1Laboratorio de Reproducción y Biología del Desarrollo. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima-Perú.
2Laboratorio de Fisiología de la Reproducción Animal. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima-Perú.
3Instituto de investigaciones en ciencias biomédicas. Facultad de medicina humana. Universidad Ricardo Palma. Lima, Perú
aBiólogo
bMagister en Procedimientos en Reproducción Asistida.
cMagister en Biología Molecular.
dpatólogo clínico
RESUMEN
Introduccion: Maytenus macrocarpa (MM) "Chuchuhuasi", es una planta nativa de la región Amazónica de Sudamérica ampliamente usada en la medicina tradicional por sus propiedades antiinflamatoria, analgésica y antitumoral. Sin embargo, sus efectos sobre la fisiología reproductiva y la fertilidad masculina aún no han sido elucidados. Metodos: Estudio experimental preclinico de caso y controles. A ratones machos de ocho semanas se les administró oralmente por 70 días (dos ciclos espermatogénicos) el extracto acuoso de MM: grupo control GC (n=8) 0 mg/kg peso corporal (pc) y al grupo tratado GT (n=8) 1000 mg/kg pc. Posteriormente los animales fueron eutanizados, se registraron el peso de los órganos reproductivos, la movilidad y concentración espermática. Durante los días 60 a 65 del tratamiento los machos se aparearon y las hembras preñadas se sacrificaron al cuarto de día de preñez para la evaluación del desarrollo, calidad y grado de blastulación de los embriones. Resultados: Los pesos de los órganos reproductivos no variaron significativamente entre ambos grupos (p>0.05). Sin embargo, la movilidad progresiva (32,81 ± 4,17 % vs. 15,27 % ± 2,08) y concentración espermática (7,75 ± 0,34 x 106/ml vs. 2,56 ± 0,42 x 106/ml) disminuyeron significativamente entre GC y GT, respectivamente. El 87,5% (7/8) de ratones del GC preñaron produciendo 15 camadas y del GT sólo el 50% (4/8) preñaron produciendo 4 camadas. Sin embargo, no se encontraron diferencias significativas en el porcentaje de embriones en estadío de blastocisto, embriones de buena calidad, ni en embriones con blastocele mayor al 50% del tamaño del embrión entre ambos grupos (p>0.05). Conclusión: el extracto acuoso de Maytenus macrocarpa (1000 mg/kl) podría poseer acciónes anti-reproductiva en ratones machos.
Palabras Clave: Calidad espermática, embriones, extracto acuoso, fertilidad, Maytenus macrocarpa.(Fuente DeCS - BIREME).
ABSTRACT
Introduction: Maytenus macrocarpa (MM) "Chuchuhuasi" is a native plant from the Amazon region of South America, widely used in traditional medicine due its anti-inflammatory, analgesic and anti-tumor properties. However, its effects on reproductive physiology and male fertility have not been elucidated. Methods: Preclinical experimental study of cases and controls. Male mice with eight weeks from birth were administered orally for 70 days (two spermatogenic cycles) an aqueous extract MM: GC (n = 8) 0 mg / kg body weight (bw) control group and treated group GT (n = 8) 1000 mg / kg bw. Later the animals were euthanized, the reproductive organs were weighted, also motility and sperm count were recorded. During the days 60 or 65 of treatment, males were mated and pregnant females were sacrificed in the fourth day of pregnancy for evaluating development, quality and degree of blastulation. Results: The weights of reproductive organs did not differ significantly between the two groups (p> 0.05). However, progressive motility (32.81 vs. 15.27 ± 4.17% ± 2.08%) and sperm count (7.75 ± 0.34 x 106 / ml vs. 2.56 ± 0.42 x 106 / ml) decreased significantly between GC and GT, respectively. 87.5% (7/8) of the pregnant mice produced 15 litters (GC) and only 50% (4/8) of the pregnant GT yields 4 litters. However, no significant differences were found in the percentage of blastocyst stage embryos, good quality embryos, or embryos with greater than 50% the size of the embryo between the two groups (p> 0.05) blastoceles. Conclusion: the aqueous extract of Maytenus macrocarpa (1000 mg/kl) could have possesses anti-reproductive action in male mice.
Keywords: Spermatic parameters, embryos classification, aqueous extract, fertility, Maytenus macrocarpa (Source: MeSH NLM).
INTRODUCCIÓN
Las plantas y sus compuestos activos han sido utilizados como una fuente importante de medicinas para el tratamiento de distintas enfermedades. El potencial terapéutico de la mayoría de estas plantas se basa en sus propiedades anti-cancerígena, anti-diabética, hepatoprotectiva, cardioprotectiva, analgésica y otras propiedades farmacológicas(1). Sin embargo, algunas plantas pueden afectar negativamente distintas funciones fisiológicas, entre ellas la función reproductiva masculina, cuyos efectos adversos han sido atribuidos principalmente a propiedades anti-espermatogénicas y anti-esteroidogénicas de uno o más compuestos activos.(2-5) Debemos considerar la importancia del estudio de las plantas medicinales debido a que aproximadamente el 75-80% de la población mundial las consume(6) y en el Perú 1400 especies de plantas son utilizadas con fines medicinales, cuyo uso popular se registra desde hace miles de años(7).
Celastraceae es una gran familia de árboles y arbustos, existen aproximadamente 89 géneros y 1300 especies que se han utilizado por siglos para el tratamiento de complicaciones estomacales, fiebre, reumatismo y cáncer(8). La familia Celastraceae es reconocida en el Perú por presentar ocho géneros y 29 especies(9) y siendo Maytenus uno de los más grandes géneros(10) y sus plantas son usadas en la medicina tradicional de Sudamérica como infusiones(11). Los metabolitos del genero Maytenus son principalmente tripertenos(12,13) y flavonoides.(14) Se ha demostrado la actividad biológica de varias especies de Maytenus: M. ilicifolia como anticonceptivo, antiinflamatorio y antioxidante(15,16); M. krukovii presenta actividad antioxidante, antimutagénica y antimicrobiana(17); M. aquifolium, propiedades analgésicas(18); M. senegalensis posee actividad antibacteriana, antiviral, antitumoral(19,20,21) y M. macrocarpa actúa como agente citotóxico(22) y antimicrobiano(23).
Maytenus macrocarpa Ruiz y Pav. (Chuchuhuasi) es una planta nativa de la región Amazónica del Perú, su corteza es utilizada generalmente como aguardiente para el tratamiento de reumatismo, influenza, enfermedades gastrointestinales y como agente antitumoral(24). Existe escasa información de los efectos de las plantas del género Maytenus sobre el sistema reproductor en mamíferos; Montanari et al.,(25)proporcionaron dosis diarias de 800 mg/kg pc del extracto etanólico de M. ilicifolia a ratones y el análisis microscópico de los túbulos seminíferos no mostró anormalidades. Sin embargo, en dosis diarias de 1000 mg/kg pc el extracto hidroalcohólico de M. ilicifolia interfirió negativamente con la implantación embrionaria en ratones.
El presente estudio tiene como objetivo evaluar las implicancias de la ingesta del extracto acuoso de Maytenus macrocarpa (1000 mg/kg pc) durante 2 ciclos espermatogénicos (70 días) sobre parámetros reproductivos y la fertilidad en ratones.
MÉTODOS
Diseño y área de estudio
Estudio experimental preclínico de casos y controles, área de biología experimental.
Población y muestra
La muestra estuvo conformada por 20 ratones (Mus musculus) machos de la cepa BALB/c de 8-10 semanas de edad, el grupo casos (experimental)lo conformó 10 ratones, a quienes se les administro extracto acuoso mediante sonda nasogástrica N°18 (Fisher Scientific, Pittsburgh, PA, USA), en una concentración de 1000 mg/kg de peso corporal durante 70 días. El grupo control lo integro 10 ratones quienes recibieron por la misma vía agua destilada. Todos se mantuvieron en una habitación con temperatura controlada (22-25°C) con ciclos de luz y oscuridad de 14/10 h, y se proporcionó agua y comida para ratones ad libitum.
Variables
Variables independientes: Sexo (macho, hembra, tratamiento ratones machos, hembras preñadas día 1 y día 4, peso hembras preñadas día 1 y día 4, presencia de cuerpo lúteo, número de embriones, grado embrionario, estadio del embrión.
Variables dependientes: calidad reproductiva del ratón macho, desarrollo embrionario preimplantacional. Se realizó una ficha de recolección de datos con todas las variables del estudio de investigación donde se registraron los hallazgos encontrados.
Procedimientos
-
Preparación de extracto acuoso: Maytenus macrocarpa se adquirió de la empresa PromoAgro export SAC (Lima, Perú). El extracto acuoso se preparó a partir del material seco y en polvo de la corteza. Se calentó 100 g de Chuchuhuasi (90-100 °C) durante 30 minutos en 1 L de agua. Posteriormente se enfrío a temperatura ambiente toda la noche y al día siguiente el sobrenadante se filtró dos veces con papel filtro estéril Whatman (40µm y 20 µm) hasta obtener una pasta.
La pasta se disolvió en agua destilada. El volumen final del extracto (100 mg-ml) se alicuotó en viales de 1.5 ml y almacenó a 4° C hasta su uso. - Tratamiento: Ratones fueron divididos en dos grupos; al Grupo Tratamiento (GT) (n=10) se le administró el extracto acuoso de Maytenus macrocarpa (1000 mg/kg pc) y al Grupo Control (GC) (n=10) agua destilada (vehículo) por 70 días. El extracto acuoso de M. macrocarpa y el agua destilada fueron administrados usando una sonda esofágica N°18 (Fisher Scientific, Pittsburgh, PA, USA). Cada 7 días se registró el peso corporal y transcurrido el tratamiento los animales fueron eutanizados por dislocación cervical. Se registró el peso de los órganos reproductivos: testículos, epidídimos y próstata mediante una balanza analítica con 0.001 gr de sensibilidad. Se obtuvieron espermatozoides de la cola del epidídimo y se analizó la movilidad y concentración espermática según WHO (2010).
- Obtención de epidídimos y espermatozoides: Cada uno de los epidídimos obtenidos fueron lavados con buffer fosfato salino (PBS pH 7,4) a 37°C, se realizaron varios cortes en la cola del epidídimo y luego los espermatozoides se liberaron permaneciendo durante 10 minutos en 0.5 ml de medio de cultivo Flushing (MediCult®, Copenhagen, Dinamarca), el contenido espermático se recuperó en su totalidad en tubos de polipropileno de 1,5 ml (Axygen Scientific).
- Evaluación de la movilidad espermática: Una gota de muestra espermática (10 ul) fue colocada sobre una lámina portaobjetos atemperada a 37°C en incubadora con CO2 y directamente observada a 400 X en un microscopio de contraste de fases (AJ Seitz, San Francisco, U.S.A). Este procedimiento fue realizado dos veces, los resultados presentados son el promedio de ambas evaluaciones, siendo evaluados al menos 200 espermatozoides. Se consideró que un espermatozoide presentaba Movilidad Progresiva (MP), cuando se desplazaba, Movilidad no Progresiva (MNP) a aquellos que no se desplazaban y solo tenían un movimiento in situ e Inmóviles (I), los que no presentaban ningún tipo de movimiento(6).
- Fertilidad: Durante los días 60-65 de tratamiento se colocaron en la noche (20:00-21:00 horas) 01 ratón macho con dos hembras vírgenes de seis semanas de edad en fase de estro o celo durante toda la noche y a la mañana siguiente (9:00- 10:00 horas) se visualizó la presencia o ausencia del tapón vaginal, la presencia del tapón vaginal fue considerado como día 1 de preñez. Las ratonas preñadas se sacrificaron al cuarto de día de gestación, posteriormente se perfusionaron los cuernos uterinos y oviductos, se recuperaron los embriones para evaluar: desarrollo, calidad y grado de blastulación.
- Obtención y evaluación de embriones preimplantacionales: Las ratonas con 4 días de preñez fueron eutanizadas mediante dislocación cervical. Se disectaron los cuernos uterinos y oviductos para la obtención y evaluación de sus embriones y los ovarios para el recuento de cuerpos lúteos.
- Evaluación de embriones: Los cuernos uterinos y oviductos se perfusionaron con medio de cultivo Flushing (MediCult®, Copenhagen, Dinamarca), para la obtención de los embriones. Posteriormente se evaluó: desarrollo embrionario, calidad embrionaria y grado de blastulación.
-
Desarrollo de los embriones: Se clasificaron de acuerdo al estadio de desarrollo embrionario preimplantacional(26):
- Estadío retardado: Menos de 9 células por embrión.
- Mórula: Más de 8 células con signos de compactación.
- Estadío de blastocisto: Más de 32 células compactas y presencia de blastocele.
-
Calidad de los embriones: Se utilizó un sistema de gradación de embriones propuesto por Dorn & Kramer(27) y descrita posteriormente por Dawson et al (26). Este método clasifica a los embriones en cuatro categorías diferentes:
- Grado I: El embrión presenta blastómeros homogéneos, simétricos y sin fragmentación.
- Grado II: El embrión presenta algunos blastómeros libres pudiendo tener presencia de algunos fragmentos de citoplasma.
- Grado III: El embrión presenta blastómeros libres, asimétricos con malformaciones severas.
- Grado IV o degenerados: El embrión tiene forma de tazón, casi no se observan blastómeros definidos y presenta membrana celular rota.
-
Grado de Blastulación: Según el tamaño del blastocele los embriones se clasificaron de la siguiente manera:
- Blastocisto Inicial: Blastocele ocupa menos del 30% del tamaño del embrión.
- Blastocisto Intermedio: Blastocele ocupa entre 30% y el 50% del tamaño del embrión.
- Blastocisto Avanzado: Blastocele ocupa entre 50% y el 90% del tamaño del embrión.
- Blastocisto Expandido: Blastocele ocupa más del 90% del tamaño del embrión.
Análisis estadísticos
Se comprobó homocedasticidad (igualdad de varianzas) de los datos mediante el Test de Levene. Para comprobar si los datos obtenidos de las distintas variables a evaluar se distribuían normalmente se realizó la prueba de Shapiro-Wilk. Cuando la variable a evaluar presentaba distribución normal se procedió a comparar las medias con t-Student, en caso contrario se aplicó U de Mann-Whitney para pruebas no paramétricas. Los resultados fueron expresados como media ± EE (error estándar). Se usó el programa estadístico SPSS Ver 17.00, considerando el nivel de significancia de p≤ 0.05.
Aspectos éticos
El cuidado y manejo de los animales se realizó de acuerdo con las pautas éticas de nuestra institución.
RESULTADOS
Peso corporal y órganos reproductivos.
No se observaron diferencias significativas en el incremento del peso corporal, peso de los testículos, epidídimos, conductos deferentes y próstata (p>0,05) entre ambos grupos. Los resultados se resumen en la Tabla 1.
Tabla 1. Título 1 de la tabla lorem impsum.
| GC | GT | |
|---|---|---|
| n | 8 | 8 |
| Peso testículo | 0,1066 ± 0,0054 | 0,1180 ± 0,0058 |
| Peso epidídimo izquierdo | 0,0401 ± 0,0012 | 0,0410 ± 0,0013 |
| Peso conducto deferente izquierdo | 0,0133 ± 0,0010 | 0,0137 ± 0,0030 |
| Peso testículo derecho | 0,1121 ± 0,0046 | 0,1239 ± 0,0062 |
| Peso epidídimo derecho | Peso epidídimo derecho | 0,0424 ± 0,0014 |
| Peso conducto deferente derecho | 0,0138 ± 0,0010 | 0,0138 ± 0,0005 |
| Peso Próstata | 0,0513 ± 0,0022 | 0,0428 ± 0,0029 |
Movilidad y concentración espermática
En el GT respecto al GC, la MP disminuyó significativamente (15,27 ± 2,08 vs. 32,81 ± 4,17, p<0.05) y los espermatozoides inmóviles aumentaron significativamente (69,25 ± 4,17 vs. 50,05 ± 3,77, p<0.05). La MNP no fue alterada (17,14 ± 3,48 vs. 15,48 ± 3,09, p>0.05) entre ambos grupos. Figura 1.
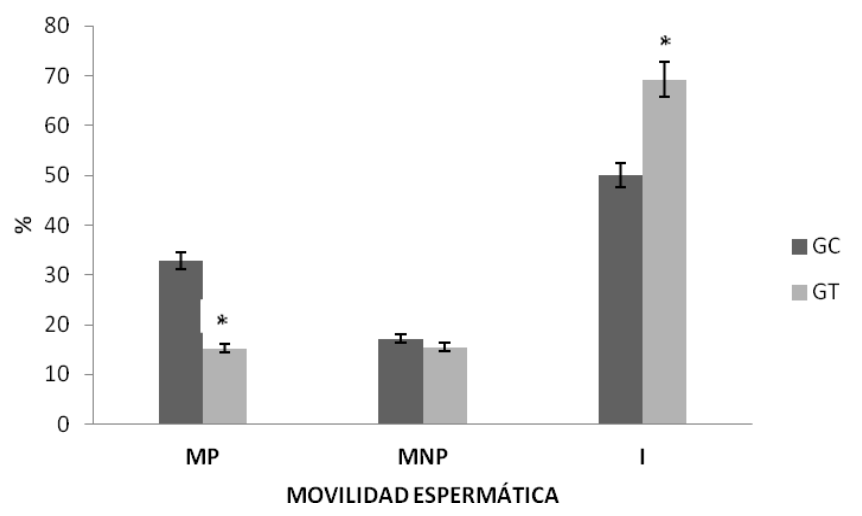
Respecto a la concentración espermática en la cola del epidídimo, disminuyó en el GT respecto al GC (2,56 ± 0,42 vs. 7,75 ± 0,34, p<0.05). Figura 2.
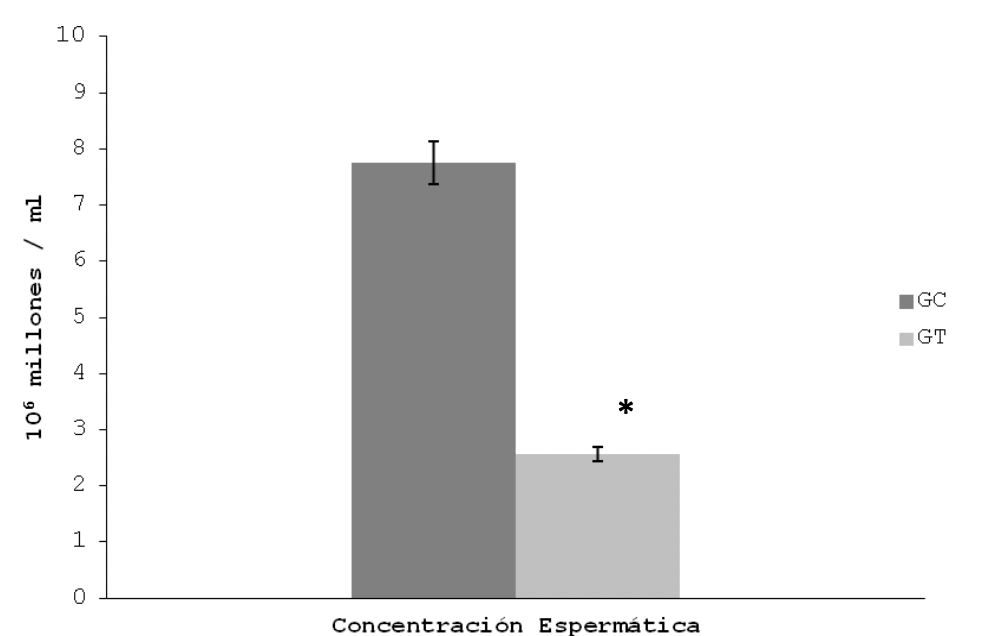
Fertilidad
Del GC el 87,5% (7/8) de machos preñaron hembras y produjeron 15 camadas y del GT sólo el 50% (4/8) de machos preñaron hembras produciendo cuatro camadas (Tabla 2).
Tabla 2. Evaluación de la fertilidad en ambos grupos.
| GC | GT | |
|---|---|---|
| Fertilidad | 87,5 (7/8) | 50,0 (4/8) |
| Hembras Preñadas | 15 | 4 |
| Embriones por Camada | 9,27 ± 0,66 | 9,75 ± 1,11 |
Las evaluaciones de las hembras preñadas se resumen en la Tabla 3.
Tabla 3. Características de las hembras.
| GC | GT | |
|---|---|---|
| Número de hembras evaluadas | 15 | 4 |
| Número total de embriones analizados | 139 | 39 |
| Número de cuerpos lúteos | 10,26 ± 0,50 | 11,25 ± 0,85 |
| Número de embriones por camada | 9,26 ± 0,65 | 9,75 ± 1,10 |
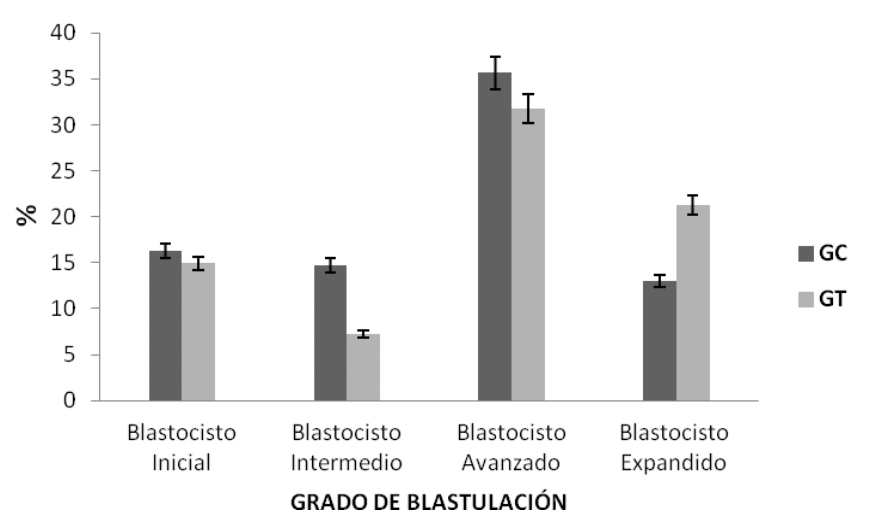
Si bien el extracto acuoso de Maytenus macrocarpa disminuyó la fertilidad debido que un menor número de machos consiguió preñar (Tabla 2 y Tabla 3), la calidad, el desarrollo y el grado de blastulación no difirieron entre ambos grupos (Figura 3, 4 y 5).
En cuanto a los embriones obtenidos, no se encontraron diferencias significativas en el porcentaje de blastocistos (79,69 ± 5,25 % vs. 75,23 ± 12,00 %), mórulas (15,42 ± 4,30 % vs. 20,61 ± 9,55 %) y embriones con menos de 9 células (4,87 ± 2,40 % vs. 4,17 ± 1,35 %) entre el GC y el GT, respectivamente (p›0.05) (Figura 3)
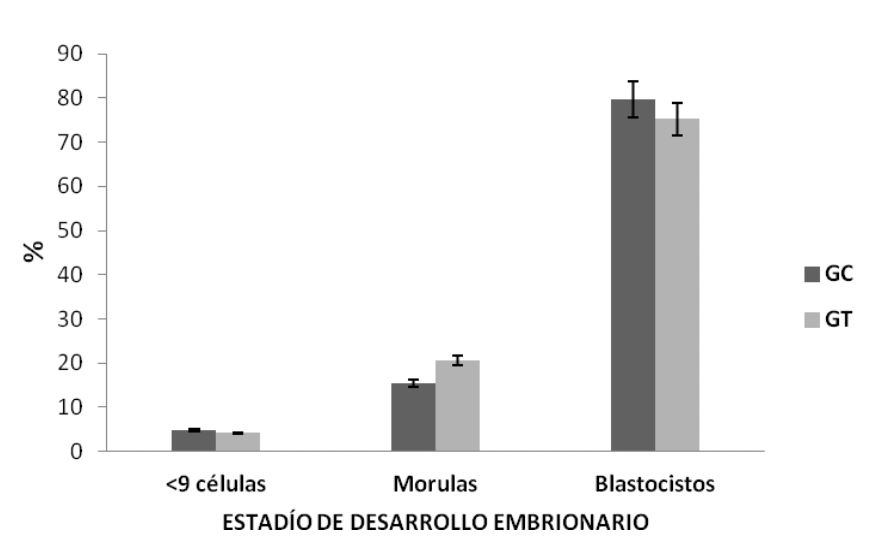
No se encontraron diferencias significativas en el porcentaje de embriones de grado I (80,64 ± 5,28 % vs. 79,40 ± 9,55 %), grado II (8,63 ± 2,36 % vs. 10,61 ± 7,87 %), grado III (2,96 ± 2,96 % vs. 10,00 ± 10,00 %) y grado IV o degenerado (7,76 ± 3,69 % vs. 0,00 ± 0,00 %) entre el GC y el GT, respectivamente (p›0.05) (Figura 4).
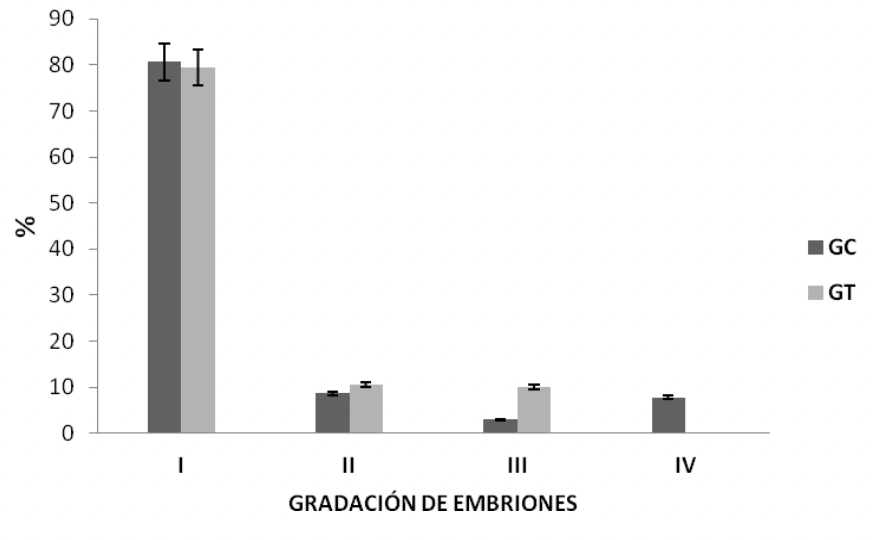
No se encontraron diferencias significativas en el porcentaje de blastocistos: iniciales (16,29 ± 5,82 % vs. 14,91 ± 3,61 %), intermedios (14,72 ± 4,40 % vs. 7,27 ± 4,75 %), avanzados (35,63 ± 5,08 % vs. 31,77 ± 8,62 %) y expandidos (13,05 ± 4,24 % vs. 21,28 ± 12,00 %) (p›0.05) (Figura 5).
DISCUSIÓN
El presente estudio investigó el efecto de Maytenus macrocarpa sobre parámetros reproductivos y fertilidad en ratones. Se ha postulado el uso de algunas plantas como anticonceptivos masculinos(2,3,5), debiendo ejercer un efecto localizado a nivel del sistema reproductivo, y no un efecto sistémico que pueda alterar otras funciones fisiológicas.(28,29,30) El presente trabajo sugiere la acción directa de Maytenus macrocarpa sobre el sistema reproductivo debido a que no existe modificación del peso corporal (Tabla 1, p>0.05), mientras que los valores de movilidad y concentración espermática disminuyeron (Figura 1 y 2, respectivamente, p<0.05), además la fertilidad también disminuyó después del tratamiento con Maytenus macrocarpa (Tabla 2). Los testículos, epidídimos y próstata son órganos dependientes de andrógenos(31), no observamos modificación de sus pesos por lo cual Maytenus macrocarpa no estaría ejerciendo un efecto anti-androgénico sobre el sistema reproductor masculino (32).
Las especies del género Maytenus poseen gran cantidad de metabolitos fenólicos como triterpenos(12,13) y flavonoides(14), justificando su potente acción anti-inflamatoria(33,34). En base a nuestros resultados, se sugiere que estas moléculas podrían ser las responsables de la disminución de los parámetros reproductivos al estar reportado que moléculas triterpenos inhiben fuertemente la movilidad espermática(35) y detienen la espermatogénesis en ratas(36) además de poseer un potente efecto inhibitorio sobre la prostaglandina E2(37); esta molécula lipídica es de gran importancia sobre la movilidad espermática(38) al incrementarla(39), además induce la entrada de calcio en el espermatozoide previo a la reacción acrosomal(40). A su vez, los flavonoides han mostrado inhibir la movilidad espermática(35) y la actividad acrosomal(41). También se han reportado nor-triterpenos conocidos como macrocarpinas en Maytenus macrocarpa quienes poseen fuerte actividad citotóxica(22), por lo cual estas moléculas también podrían ser responsables de la disminución de las características reproductivas después de la ingesta de Maytenus macrocarpa.
A diferencia de nuestros resultados, Montanari et al.(24) observaron mediante cortes histológicos de testículos de ratón, que la ingesta de dosis diarias de 800 mg/kg pc del extracto etanólico de M. ilicifolia por 30 días no alteraba la espermatogénesis lo cual nos podría indicar que la acción de Maytenus macrocarpa podría ser a nivel post- testicular, es decir durante el tránsito de los espermatozoides por el epidídimo. Otras posibilidades son que el efecto de las plantas del género Maytenus sea especie-específico y/o propio del tipo de extracto que se use al reportarse en otras plantas distintos tipos de acción de acuerdo al extracto utilizado(42). Debido a que nosotros usamos un extracto acuoso y Montanari et al(24) un extracto etanólico sugerimos que uno o más compuestos altamente polares serían los responsables de los efectos anti-reproductivos observados.
El tiempo de dosis (30 días) que usaron Montanari et al. (24) no sería la causa por la cual no se observaron efectos sobre la espermatogénesis debido a que en un trabajo previo(43) observamos que la ingesta por tan sólo 7 días de Maytenus macrocarpa disminuía la calidad espermática en ratones, esto apoyaría nuestra observación que Maytenus macrocarpa ejercería su efecto sobre la espermiación y el transporte en el epidídimo debido a que estos fenómenos transcurren en un periodo de 7 días(44).
Si bien las deficiencias citoplasmáticas del espermatozoide pueden ser detectadas tan temprano como en un embrión de una célula(45),las deficiencias que ocurren a nivel genómico del espermatozoide no puede ser detectado en el embrión antes del estadio de 8 celulas en el desarrollo del embrión(46,47), debido a esto, decidimos evaluar el embrión en estadio de blastocisto. Se ha encontrado una relación entre la integridad genética del espermatozoide y el clivaje durante el proceso de desarrollo del embrión (48,49)y la ausencia de efectos negativos en los estadios de blastocistos del Grupo Tratamiento que corresponde a hembras preñadas que podría indicar que la ingesta del extracto acuoso de M. macrocarpa no afecta la integridad genética del espermatozoide, permitiendo un desarrollo embrionario normal. Estos resultados están en concordancia con estudios previos donde no existe efecto toxico en especies del genero Maytenus(50,52), por otra parte se ha reportado propiedades antimutagenicas en el género Maytenus(17).
Muchos anticonceptivos obtenidos de plantas actúan disminuyendo la movilidad y concentración espermática en la cola del epidídimo(28,29), características de gran importancia para el éxito reproductivo(53), tal como se observó con el extracto acuoso de Maytenus macrocarpa.
Las limitaciones del estudio fueron principalmente de orden logístico institucional; como cortes de luz o cierre intempestiva de la universidad que impidieron dosificación o evaluación en el momento acordado, teniendo que repetir de nuevo toda la dosificación.
CONCLUSIÓN
La ingesta del extracto acuoso de Maytenus macrocarpa podría disminuir la movilidad y concentración espermática, así como la fertilidad en ratones. En cuanto a los embriones obtenidos, no se encontraron diferencias significativas entre los estadios estudiados. Es evidente que se necesitan más estudios para identificar que compuestos serían los responsables de sus efectos anti-reproductivos.
Contribuciones de Autoría: Los autores participaron en la génesis de la idea, diseño del proyecto, desarrollo, recolección e interpretación de data, análisis de resultados y preparación del manuscrito.
Financiamiento: Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos (Proyecto Multidisciplinario Grant # PEM2008A02).
Conflictos de intereses: Los autores declaran no tener conflicto de interés en la publicación de este artículo.
Recibido: 06 de mayo 2022
Aprobado: 25 de agosto 2022
Correspondencia:José Luis Rafael Pino Gaviño.
Dirección: Av. German Amézaga 375, cercado Lima-Perú.
Teléfono: 992169186.
Email: jpinog@unmsm.edu.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS
