CASO CLÍNICO
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2023 - Universidad Ricardo Palma10.25176/RFMH.v23i4.5814
PRIMER CASO DE DISPLASIA TANATOFÓRICA TIPO 1 EN LOS ANDES PERUANOS CON VARIANTE PATOGÉNICA EN EL GEN FGFR3
FIRST CASE OF THANATOPHORIC DYSPLASIA TYPE 1 IN THE PERUVIAN ANDES WITH A PATHOGENIC VARIANT IN THE FGFR3 GENE
Torres-Salinas Carlos
 1,2,a
1,2,a
Ledesma-Porras Yesenia
 1,3,b
1,3,b
1 Facultad de Medicina Humana. Universidad Continental, Perú.
2 Hospital Bicentenario EsSalud Jauja, Perú.
3 Hospital Nacional Ramiro Prialé EsSalud, Perú.
a Médico Pediatra.
b Médico Genetista.
RESUMEN
La displasia tanatofórica tipo 1 es una forma de displasia esquelética letal, se caracteriza por desproporciones del esqueleto axial-apendicular además de talla baja, macrocefalia, prominencia frontal, tórax estrecho, arqueamiento femoral y micromelia. Dichas características fenotípicas son el resultado de variantes patogénicas en el gen del receptor 3 del factor de crecimiento de fibroblastos (FGFR-3), localizada en el cromosoma 4p16.3
Para su estudio la ecografía obstétrica, el examen físico y los hallazgos radiográficos son importantes. Sin embargo, se debe confirmar el diagnóstico mediante estudio genético a fin de descubrir variantes o asociaciones nuevas, así como dar a conocer su casuística real en una determinada región.
Palabras clave: Displasia esquelética, displasia tanatofórica, receptor tipo 3 de factor de crecimiento de fibroblastos. ( Fuente: DeCS – BIREME)
ABSTRACT
Thanatophoric dysplasia type 1 is a form of lethal skeletal dysplasia, characterized by axial-appendicular skeletal disproportions as well as short stature, frontal bossing, cloverleaf skull, narrow chest, femoral bowing, and micromelia. These phenotypic characteristics are the result of pathogenic variants in the fibroblast growth factor receptor 3 (FGFR-3) gene, located on chromosome 4p16.3
For its study, obstetric ultrasound, physical examination and radiographic findings are important. However, the diagnosis must be confirmed by genetic study in order to discover new variants or associations, as well as to reveal its actual casuistry in a certain region.
Keywords: Skeletal dysplasia, thanatophoric dysplasia, fibroblast growth factor receptor type 3. (SOURCE: MeSH – NLM)
INTRODUCCIÓN
La displasia tanatofórica (DT) es una displasia esquelética severa y está causada por variantes patogénicas en el gen FGFR3 (receptor 3 del factor de crecimiento de fibroblastos). Las variantes patogénicas más comunes se dan en el dominio extracelular ya sea por una sustitución de cisteína por arginina en la posición 248 (Arg248Cys) o sustitución de cisteína por tirosina en la posición 373 (Tyr373Cys), mientras que para la displasia tanatofórica tipo 2 es (Lys650Glu). La DT tipo I presenta micromelia con arqueamiento femoral y craneosinostosis de grado variable, mientras que la DT tipo II se caracteriza por micromelia con fémures rectos, presencia de craneosinostosis de grado moderado a severo y deformidad de cráneo en “trébol” (1)
En relación a las displasias esqueléticas en Latinoamérica el estudio más grande muestra una prevalencia de 3.2 casos en 10.000 recién nacidos vivos (RNV) (2). Mientras que la displasia tanatofórica es más rara aún con 0.37 casos en 10.000 RNV (3).
Hasta la fecha en Perú no existen casos publicados de displasia tanatofórica tipo 1, con confirmación por estudio de panel de displasias esqueléticas de forma temprana y a su vez reportada a la comunidad científica.
Presentamos un caso de displasia tanatofórica tipo I que fue diagnosticada por la detección de la mutación del gen FGFR3 en la región central del Perú y se cuenta con el consentimiento informado para los fines exclusivamente médicos de publicación.
Reporte de caso:
Neonato varón de 38 semanas, nacido de cesárea electiva debido a malformaciones esqueléticas y polihidramnios diagnosticadas por ecografía a las 36 semanas (estudios ecográficos anteriores de forma particular, sin aparentes alteraciones). La edad materna fue de 40 años y la edad paterna de 46 años, G4P3003, VRDL: no reactivo, VIH: no reactivo y controles prenatales completos en centro de salud rural.
A la ampliación de anamnesis no se encontró antecedentes de endogamia, uso de drogas, alcohol o tóxicos. Asimismo, los padres no mostraban enfermedades actuales y tampoco hubo antecedentes familiares de enfermedades congénitas.
El paciente al nacer requirió estimulación táctil, aspiración de secreciones y 01 ciclo de ventilación a presión positiva con pieza en T (Neopuff®), score APGAR: 61-85, gasometría arterial de cordón umbilical: pH: 7.18, PaO2: 55.1 mmHg, PaCO2: 52 mmHg, HCO3: 15.8 mmol/L, EB: -9.8 mmol/L, lactato: 4.5 mmol/L, SatO2: 85%, escala Silverman – Anderson: 5 puntos, con ello se decide pasar a soporte CPAP (nasal) mejorando parcialmente la dificultad respiratoria y SatO2: 92%. A las 8 horas se cambia dispositivo a cánula de alto flujo con respuesta aceptable.
En la evaluación antropométrica se encontró un peso: 2710g, talla: 39 cm, perímetro cefálico: 36 cm, perímetro toráxico: 29.5 cm. Además, dismorfismo craneofacial, macrocefalia relativa, cuello corto, tórax estrecho, talla baja, piel en acordeón, acortamiento rizomélico de las cuatro extremidades, braquidactilia e hipotonía generalizada (Fig. 1).
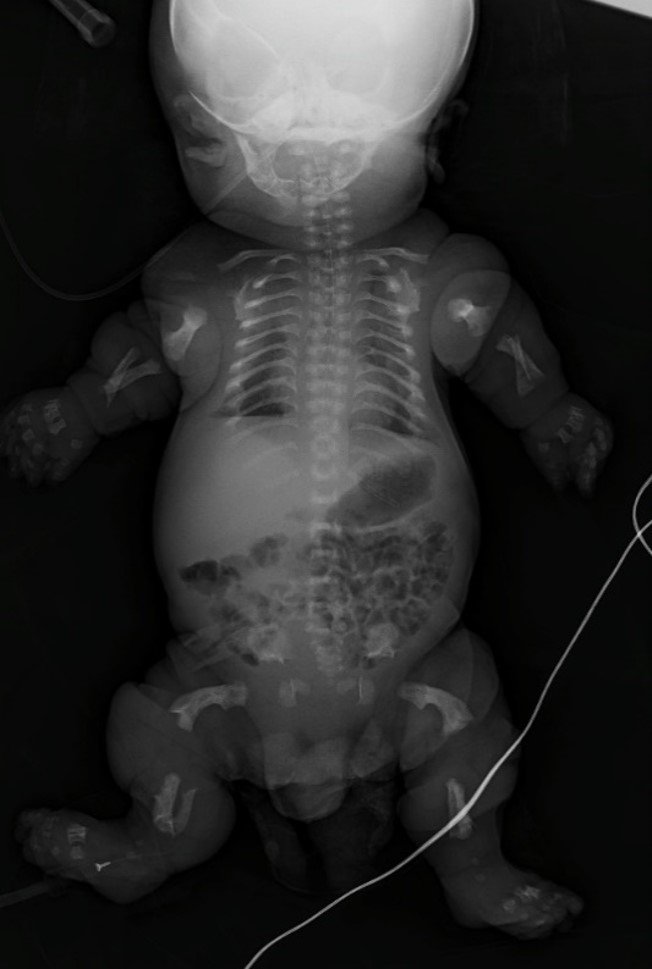
El estudio radiográfico mostró una base craneal pequeña, platispondilia, arcos costales en disposición de “campanario” en relación a un tórax estrecho, ilión hipoplásico y arqueamiento femoral, con el clásico hallazgo de “receptor de teléfono” (Fig. 2).
Por otro lado, se realizó un panel genético para displasias esqueléticas que incluía 358 genes, identificándose 01 variante patogénica: en el gen FGFR3, variante c.1108G>T (p.Gly370Cys), (NM_000142.4).Incidentalmente se encontró en el gen KIAA0753 (NM_014804.2), una variante c.2656C>T (p.Arg886*) que está asociada a ciliopatías esqueléticas autosómicas recesivas. Esta variante no ha sido reportada en la literatura en individuos afectados con condiciones relacionadas con KIAA0753 (Fig. 3)
La evolución clínica mostró deterioro progresivo en el tiempo y pese a los diferentes dispositivos se soporte oxigenatorio y ventilatorio, falleció a los 16 días debido a un paro respiratorio secundario a la hipoplasia pulmonar y estrechez considerable de la caja toráxica.
DISCUSIÓN
La displasia tanatofórica (DT) es un desorden autosómico dominante, típicamente causada por una variante patogénica de novo, en ella tenemos un subgrupo relacionado a las condrodisplasias esqueléticas las cuales se dividen en 02 tipos (aunque no siempre guardan una correlación con el gen hallado); éstas son la DT tipo I con fémur curvo en “receptor de teléfono”, platispondilia, por lo general cráneo normal y DT tipo II con fémur recto y cráneo en “trébol”; fenotípicamente muestran un acortamiento de todas las extremidades, pliegues cutáneos redundantes, puente nasal deprimido, abdomen grande y tórax estrecho que va asociado a un pobre desarrollo pulmonar. En relación a la DT1 ésta al igual que la DT2, es causada por una mutación heterocigota en el gen que codifica el receptor 3 del factor de crecimiento de fibroblastos (FGFR3; 134934) en el cromosoma 4p16, teniendo por código OMIM #187600 (1, 4)
En cuanto al diagnóstico, se recomienda que sea precoz y de forma antenatal dado su pronóstico y desenlace; el método usado es el ultrasonido obstétrico y los criterios a considerar son: micromelia rizomélica severa con arqueamiento longitud de extremidades inferiores al percentil 3 (p3) respecto a la edad gestacional; tórax hipoplásico determinado por una circunferencia cardiaca superior al 60% de la circunferencia toráxica. (6)
Otros hallazgos referidos a las etapas de la gestación describen que en el primer trimestre entre la semana 12 y 14 se aprecia un incremento de la translucencia nucal y acortamiento de huesos largos, mientras que en el segundo trimestre es posible identificar la deficiencia de crecimiento de extremidades por debajo del percentil 5 (p5). Es posible también observar platispondilia, ventriculomegalia, cavidad torácica estrecha con costillas cortas, polihidramnios y arqueamiento femoral, sobretodo en la DT tipo I. Mientras que el cráneo en trébol y la craneosinostosis que afectan las suturas coronal, lambdoidea y sagital dando al cráneo un aspecto trilobulado o también denominado “Kleeblattschädel” se presentan más en la DT tipo II. (1, 5, 7)
Sin embargo, no siempre resulta fácil la evaluación de los hallazgos antes descritos es por ello, que ante la duda se recomienda complementar el estudio ecográfico usando índices como la relación: (diámetro biparietal / longitud de fémur), siendo ésta una herramienta útil y objetiva para detectar con mayor precisión las displasias tanatofóricas, sobre todo en etapas tempranas de la gestación. (8, 9)
Otros hallazgos ecográficos, como la displasia del lóbulo temporal podrían fortalecer la sospecha diagnóstica de estar frente a un caso de DT; mientras que hallazgos morfométricos postnatales podrían aplicarse a la búsqueda ecográfica antenatal de características de DT y así optimizar la especificidad del ultrasonido obstétrico (10)
Las DT son un desorden de herencia autosómica dominante, esporádicos con penetrancia al 100% y de baja recurrencia; la mayoría de los casos sólo esta reportado en los afectados, siendo los padres sanos. Excepcionalmente, se ha descrito un caso de mosaicismo en una persona adulta con extremidades asimétricas, displasia congénita de cadera, áreas focales de arqueamiento óseo, húmero en “S”, acantosis nigricans extensa y óbito a las 30 semanas de una gestación con displasia esquelética severa e hipoplasia pulmonar. (11)
No debemos olvidar que el gen FGFR3, es responsable de una variedad de condrodisplasias, por lo que también se puede encontrar casos de hipocondrodisplasias y pseudocondrodisplasias desde grados leves hasta severos, como el síndrome de Crouzon o Pfeiffer. (12)
En nuestro caso, la gestante siguió sus controles obstétricos en un centro de salud rural sin alteraciones aparentes (donde no se tiene acceso pleno a personal entrenado, ni equipo ecográfico), los controles ecográficos según refiere se realizó de forma particular y sin hallazgos de anomalías, de lo cual no tuvimos evidencia física.
A las 36 semanas fue referida al hospital para completar monitoreo de gestación según normativa nacional, y es ahí donde se detecta mediante ecografía hallazgos sugerentes de DT; al nacer el bebé requirió asistencia médica inicial siendo dependiente de soporte oxigenatorio y cursando con mala evolución, llegando a fallecer a los 16 días de vida.
El diagnóstico certero se hizo mediante estudio genético e incidentalmente se detectó la coexistencia de la variante heterocigota del gen KIAA0753, la cual consideramos que no tuvo relevancia clínica al encontrarse una única mutación en dicho gen, y por ello sin consecuente expresión propia de las ciliopatias esqueléticas. Y que de otro modo hubiera resultado difícil de distinguir por el clínico entre ambas entidades.
Conclusiones:
En los últimos años el Perú ha sido una de las economías de la región con mayor crecimiento. Sin embargo, observamos una disociación entre ello y la posibilidad de realizar exámenes genéticos por parte de nuestros hospitales, tal como en el caso descrito. Constituyéndose así, en una barrera al acceso a estudios no sólo genéticos sino también de enfermedades raras por lo que recomendamos no sea tomado con ligereza.
Contribuciones de Autoría:
Los autores son gestores del artículo en su totalidad.
Financiamiento:
Ninguno
Declaración de conflictos de intereses:
Ninguno
Recibido:
18 de Julio de 2023
Aprobado:
2 de Noviembre de 2023
Correspondencia:
Dr. Carlos Torres Salinas
Dirección:
-
Teléfono:
+51 947459408
Correo electrónico:
ctorress@continental.edu.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.