ARTICULO REVISIÓN
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2023 - Universidad Ricardo Palma10.25176/RFMH.v23i4.6206
MODELOS MURINOS PARA EL ESTUDIO DE CÁNCER DE MAMA TRIPLE NEGATIVO
MURINE MODELS FOR THE STUDY OF TRIPLE NEGATIVE BREAST CANCER
Yudith Cauna-Orocollo
 1,a
1,a
Ariana Alessandra Córdova-Salazar
 1,b
1,b
Jhanina Campos-Tineo
 1,a
1,a
1 Instituto de Investigaciones en Ciencias Biomédicas, Universidad Ricardo Palma. Lima, Perú
a Magister en Bioquímica y Biología Molecular
b Bachiller en Biología
RESUMEN
El estudio de diferentes variables, como patogénesis, perfil inflamatorio, identificación de blancos terapéuticos, eficacia de tratamientos en modelos murinos ha resultado uno de los más prácticos para el estudio preclínico del cáncer de mama triple negativo (CMTN), el subtipo de cáncer más agresivo, con limitada aplicación de tratamientos y baja tasa de sobrevivencia. Sin embargo, hay que reconocer que existen otros menores en los que se viene estandarizando la inducción del CMTN. En esta revisión se engloban los diferentes métodos de inducción que han permitido el desarrollo de CMTN y las aplicaciones terapéuticas más relevantes por el que se desarrollaron los modelos murinos con CMTN.
Palabras clave: modelo murino, cáncer de mama triple negativo, inducción, terapia antitumoral. (Fuente: DeCS- BIREME)
ABSTRACT
The study of different variables, such as pathogenesis, inflammatory profile, identification of therapeutic targets, efficacy of treatments in murine models has proven to be one of the most practical for the preclinical study of triple negative breast cancer (TNBC), the most aggressive subtype of cancer, with limited application of treatments and low survival rate. However, it must be recognized that there are other minors in which the induction of TNBC is being standardized. This review encompasses the different induction methods that have allowed the development of TNBC and the most relevant therapeutic applications by which murine models with TNBC were developed.
Keywords: murine model, triple negative breast cancer, induction, antitumor therapy. (Source: MESH-NLM)
INTRODUCCIÓN
El cáncer de mama es la segunda neoplasia maligna femenina con alta incidencia y mortandad global (1), y podría superar los 4.4 millones de pacientes en el año 2070 (2). De acuerdo a la clasificación molecular, el cáncer de mama se divide en subtipos en base a los niveles de expresión de los receptores de estrógeno (ER), de progesterona (PR) y de factor de crecimiento epidérmico humano 2 (HER2). Los subtipos moleculares de cáncer de mama son luminal A (ER+ / PR+ / HER2-), luminal B (ER+ / PR+ / HER2+), HER2+ (ER- / PR- / HER2+), y triple negativo (ER- / PR- / HER2-), siendo éste de peor pronóstico en comparación a los demás subtipos (3). Además, se divide en los subtipos basal-like y normal-like, a diferencia entre estos dos subtipos consiste en la expresión de CK5, siendo CK5+ y CK5-, respectivamente (4).
Para acelerar el hallazgo de blancos terapéuticos para tratamientos prospectivos y de prevención del cáncer de mama, se requieren modelos animales para estudios preclínicos (5). Se ha logrado desarrollar modelos murinos inmunosuprimidos con cáncer de mama triple negativo (CMTN) (4, 5), como ratones cepa BALB/c y ratas cepa Sprague-Dawley, que permitieron evaluar la farmacocinética, patogénesis, perfil inflamatorio, microbioma, nivel de expresión de genes, y determinar dosis efectiva, toxicidad de compuestos químicos, etc. (6, 9). El objetivo de esta revisión es resumir los métodos de inducción de CMTN en modelos murinos, las aplicaciones terapéuticas evaluadas a la actualidad y sus ventajas y desventajas para el estudio del CMTN.
ESTRATEGIA DE BÚSQUEDA
La estrategia de búsqueda para las referencias bibliográficas de esta revisión se estructuró meticulosamente, empleando una combinación de palabras clave y operadores booleanos para afinar los resultados. Las palabras clave en inglés utilizadas fueron: 'triple negative breast cancer', 'murine model', 'rat model', 'cell', 'xenograft', 'allograft', 'chemical cancer inductor', 'ionizing radiation', 'radiotherapy', 'chemotherapy', 'immunotherapy', y 'probiotics', relacionadas con 'animal model breast cancer'. Estas se combinaron mediante operadores booleanos como 'AND' y 'OR' para optimizar la búsqueda. La búsqueda se llevó a cabo en buscadores como PubMed, Google Scholar y Science Direct. Además, se establecieron criterios de selección rigurosos para los artículos, priorizando estudios recientes, de alto impacto y relevancia para el tema, asegurando así que la revisión estuviera fundamentada en la literatura más actual y pertinente.
MÉTODOS Y DESARROLLO DE MODELOS MURINOS CON CMTN
Se tienen métodos químicos, físicos y biológicos que promueven la carcinogénesis y son administrados por diferentes vías.
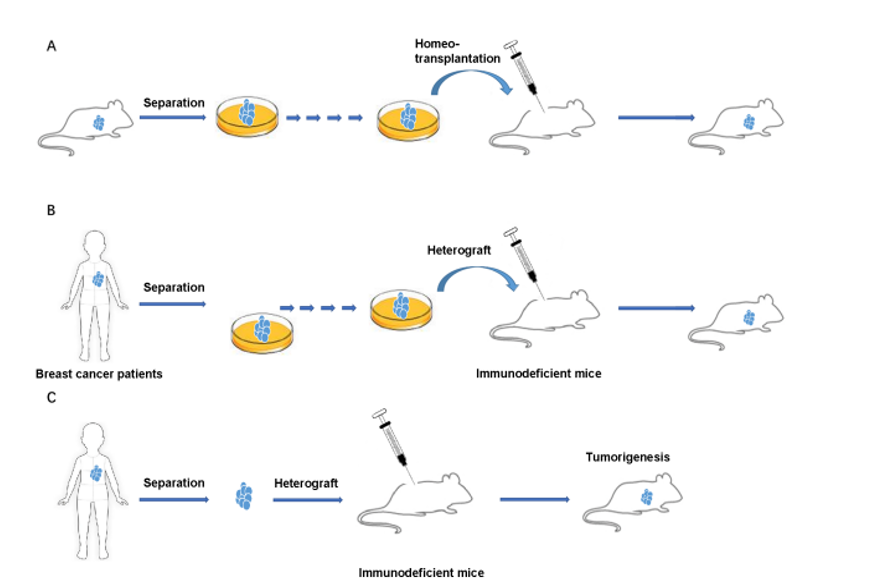
Entre los métodos de inducción biológicos para el desarrollo de cáncer de mama, fue el trasplante de injertos, líneas celulares y tejidos provenientes de modelos murinos o mujeres con cáncer de mama, que precisaron el estudio de la patogénesis de alguno de los subtipos de cáncer de mama para el desarrollo de terapias personalizadas. Los tipos de injerto son los aloinjertos u homeotrasplante, que se basan en usar los tejidos o células de un animal y trasplantarlo en otro animal de la misma especie (Figura 1A), y los xenoinjertos o heteroinjerto, son obtenidos del humano y trasplantados a un animal (Figura 1B, 1C) (9). Si bien, existen dos tipos de injertos, el trasplante de xenoinjertos es de mayor importancia para estudios preclínicos, por tratarse de injertos humanos.
El éxito del desarrollo de un modelo murino con cáncer de mama generalmente depende de la inmunodeficiencia del animal para estudios oncológicos, pues la respuesta inmunológica wild type puede ser un obstáculo para el crecimiento de tumores y metástasis (10). Sin embargo, se debe considerar también las aplicaciones del estudio, como la composición terapéutica que se pretende evaluar (11). Recientemente, se desarrolló y validó el modelo de ratas Sprague Dawley Rag2/Il2rg double- knockout (SRG OncoRat) inmuosuprimidas para estudios de oncología y se observó la reducción del volumen tisular del bazo y timo, y consigo, la disminución de células T, NK y B circulantes (Figura 2) (7).
Inducción biológica de CMTN
Modelos murinos transgénicos mediado por virus
El uso de DNA foráneo permitió desarrollar modelos murinos transgénicos para la inducción de cáncer de mama. Los lentivirus promueven la sobreexpresión de oncogenes, especificamente, de HER2/ERBB2, PyMT, Wnt, Myc, Ras, y PIK3CA, o la supresión de la expresión de dichos genes en modelos murinos transgénicos (9). Los ratones transgénicos infectados con Wnt-1 por hiperplasia ductal extensiva también es un modelo murino para estudiar la patología del CMTN (12).
Frente a otros métodos de inducción de cáncer de mama, este método incluye altas tasas de incidencia, latencias cortas y resultados más confiables; las desventajas son los periodos largos de incubación, diferentes tiempos de incidencia y características patológicas heterogéneas (9).
Modelos murinos con cáncer de mama knockout en genes supresores de tumores
Estos modelos se desarrollaron noqueando a los genes supresores tumorales p53, BRCA1/2 y pTEN del murino mediante sistemas de recombinasa, siendo el 50% de la población susceptibles a desarrollar cáncer de mama (13, 14). Otros modelos murinos knockout emplean sistemas inducibles, como Cre-loxP para la expresión condicional de Brca1, o el sistema Tet-off/Tet-on para la expresión condicional de PIK3CA¨H1047R humano, para obtener una alta tasa de incidencia (95%) con signos de adenocarcinoma y fenotipos de tumores primarios en periodos de incubación de 7 meses (15, 16).
Inducción ortotópica basada en xenoinjertos derivado de líneas celulares de CMTN
Comúnmente, se ha reportado que la vía ortotópica para la inoculación de células en los ratones es en la almohadilla de la grasa mamaria (17, 19). Otras vías ortotópicas más complejas son la vía intraductal (9, 20, 21), canal del pezón mamario (22), flanco derecho o izquierdo (23, 24), o por vías heterotópicas subdérmica (25) o subcutánea (21, 26, 27).
La línea celular 4T1 es una de las más utilizadas para inducir el CMTN en modelo de ratones aloinjerto. Con esta línea celular, se desarrolló el modelo metastásico de CMTN en diferentes ratones FVB/N y BALB/c usando el método intraductal mamario, que comprende en realizar un corte en la base del pezón para acceder al conducto principal de las glándulas mamarias y se inoculan 5 x 104 células en 5 uL (28). Adicionalmente, se tienen otras líneas celulares de cáncer de mama provenientes de ratones genéticamente modificados que promueven el desarrollo de cáncer de mama luminal y basal, además generan metástasis a nivel pulmonar y otros órganos (Tabla 1) (8).
|
Línea celular |
Origen |
Latencia |
Patología |
Metastasis |
Sitio de transferencia |
||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
4T1 67NR |
BALB/C |
8-17 d |
luminal |
sí |
pulmones |
||||||||||||||||||
|
4T1 4T1.2 |
BALB/C |
8-17 d |
basal |
no |
pulmones |
||||||||||||||||||
|
TM40D |
BALB/C |
1 s |
sí |
pulmones |
|||||||||||||||||||
|
D2A1 |
BALB/C |
14 -18 d |
sí |
pulmones, corazón |
|||||||||||||||||||
|
EMT6 |
BALB/C |
3 -5 d |
sí |
pulmones |
|||||||||||||||||||
|
E0771 |
C57BL/6 |
basal |
sí |
pulmones |
|||||||||||||||||||
|
MVT1 |
FVB/N |
luminal |
sí |
pulmones |
|||||||||||||||||||
|
6DT1 |
FVB/N |
luminal |
|||||||||||||||||||||
|
M6 |
FVB/N |
44 d |
luminal |
sí |
pulmones |
||||||||||||||||||
|
CST |
FVB/N |
20 d |
basal |
||||||||||||||||||||
|
EAC |
Extraamericano |
sí |
pulmones, hígado, corazón, huesos |
d: día, s: semana. Fuente: adaptado de Yang et al. (2017)(8).
Entre otras líneas celulares de cáncer de mama de murinos, en un estudio se desarrolló el modelo murino con CMTN inyectando 106 células de la línea D2A1 en 100 uL en la glándula mamaria, resultando en metástasis pulmonar (29). En otro estudio, se inoculó 5x104 células en 20 uL de la línea celular murina JygMC(A), con fenotipo triple negativo, en la almohadilla inguinal del tejido graso mamario de ratones atímicos, observándose la aparición temprana de tumores (30).
Las líneas celulares humanas aisladas de pacientes con CMTN también han sido empleadas para el desarrollo de modelos murinos xenoinjerto, considerando la expresión negativa del ER, PR y HER2, y las características histopatológicas que genera cada línea celular (Tabla 2); asimismo, se han clasificado en dos subtipos de CMTN, Triple-Negativo A o basal-like (TNA) y Triple-Negativo B o normal-like (TNB) (31).
|
Línea celular |
ER |
PR |
HER2 |
Clasificación tumoral |
Características histopatológicas |
||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
HMT-3522 |
- |
- |
- |
TNA |
tumor benigno |
||||||||||||||||||
|
DU-4475 |
- |
- |
- |
TNA |
Carcinoma Ductal Invasivo |
||||||||||||||||||
|
HCC-1806 |
- |
- |
- |
TNA |
Carcinoma escamoso |
||||||||||||||||||
|
HCC-70 |
- |
- |
- |
TNA |
Carcinoma Ductal |
||||||||||||||||||
|
MA-11 |
- |
- |
- |
TNA |
Carcinoma Lobular Invasivo |
||||||||||||||||||
|
MDA-MB-231 |
- |
- |
- |
TNB |
Adenocarcinoma |
||||||||||||||||||
|
MDA-MB-157 |
- |
- |
- |
TNB |
Carcinoma Medular |
||||||||||||||||||
|
SUM-149PT |
- |
- |
- |
TNB |
Carcinoma Ductal inflamatorio |
||||||||||||||||||
|
SUM-159PT |
- |
- |
- |
TNB |
Adenocarcinoma |
TNA: Triple Negativo A, TNB: Triple Negativo B, (-): negativo. Fuente: adaptado de Costa et al. (2020)(31).
Entre las líneas celulares humanas mencionadas para la inducción de CMTN, MDA-MB-231 destaca como una de las más utilizadas. En un estudio, se inocularon, por vía subcutánea, 107 células MDA-MB-231 en 100µl en el flanco derecho de ratones desnudos, lo que resultó en la formación de tumores visibles en menos de 15 días (23). Nofiele & Cheng emplearon la misma línea celular para inducir el CMTN en ratas saludables hembras inmunodeficientes de 6 semanas de edad, y determinaron que para la aparición de tumores primarios es necesario el ultrasonido (32).
En otro estudio, se utilizaron ratones no obesos inmunodeficientes diabéticos (NOD/SCID), a los cuales se les inoculó 3 x 106 células en 100µl en la almohadilla de la grasa mamaria, observándose un crecimiento inicial más lento de los tumores MDA-MB-231 en comparación a los tumores 4T1 (25).
Inducción basada en xenoinjertos derivados de tejido mamario con CMTN
El desarrollo del cáncer de mama en modelos murinos a partir de xenoinjertos derivados de tejidos mamarios de pacientes con CMTN, ha sido un gran reto en cuanto a histocompatibilidad. Por ejemplo, los ratones desnudos con mutación en el gen Foxn1nu, deficientes en el desarrollo de linfocitos B y mayor actividad de los linfocitos NK, pueden tolerar los xenoinjertos derivados de líneas celulares humanas, pero no pueden tolerar los xenoinjertos derivados de tejidos humanos (33).
Recientemente se desarrolló un modelo murino de xenoinjerto derivado de pacientes (PDX) a partir de aspirado tumoral, el cual fue concentrado y trasplantado ortotópicamente en ratones inmunodeficientes, y se reportó que de 269 xenoinjertos, 62 resultaron con éxito (34), siendo muy baja la eficiencia de este método para el desarrollo de modelos murinos con CMTN.
Inducción de CMTN por compuestos químicos
La inducción por carcinógenos es uno de los métodos más prácticos para el desarrollo de cáncer de mama en modelos murinos. Los carcinógenos comúnmente empleados en murinos son DMBA (7,12-dimetilbenzantraceno), MCA (3-metilcholantreno), 1,2,5,6 dibenzantraceno, MNU (N-metil-N-nitrosourea), 2-acetylamino-fluorene, 3,4-benzopyrene, etilnitrosourea, y butilnitrosourea, que generan adenomas y adenocarcinomas tipo B (9, 35, 36). DMA y MNU, los cuales son dependiente-hormonal e inducen cáncer de mama en ratas de tipo ER alfa-positivo.
Por otro lado, las ratas ACI, Sprague Dawley, Fisher 344, Inbred S-D administradas con 17 β-estradiol sobreexpresaron los ER y PR, y proteínas de unión 3 (Gata3), siendo un modelo ideal para el estudio de cáncer de mama subtipo luminal o cáncer de mama hormonal-dependiente (9, 21, 37, 38). No se encontró información de carcinógenos usados para el desarrollo específico de CMTN.
Inducción de CMTN por radiación ionizante
Son escasos los trabajos orientados a inducción específica de CMTN por radiación ionizante (RI). El tipo de RI más empleado fueron los rayos X para la inducción de cáncer de mama bajo una dosis subletal, 0.2 Gy, en ratas Sprague Dawley y ratones BALC/c (39). Otros tipos de radiación ionizante (RI), como los neutrinos 177Lu y rayos gamma, tambien son capaces de inducir linfopenia y tumorigénesis en modelos murinos (39, 40).
En otro estudio, se evidenció que los tumores mamarios de ratas irradiadas fueron principalmente tumores hormono-dependientes del tipo adenocarcinoma y fibroadenomas. No obstante, en 2020 se emplearon rayos X sobre células MDA-MB-231 para generar un modelo de xenoinjerto de CMTN con características de radioresistencia (41).
APLICACIONES TERAPÉUTICAS EN MODELOS MURINOS CON CMTN
Quimioterapia en modelos murinos con CMTN
La quimioterapia es el tratamiento primario sistémico contra el CMTN temprano o avanzado, sin embargo, la heterogeneidad celular encontrada en las pacientes con CMTN promovió la resistencia a este tipo de terapia (42).
Anteriormente, se emplearon ratones GEMM (BRCA1 mutant breast cancer mice) (BRCA1Co/Co - MMTV-Cre-p53+/− mice) para la evaluación de Cisplatin contra el CMTN, de manera individual o agregada con OMO-1, un selectivo inhibidor del factor de transición epitelial mesenquimal (c-MET), que redujo la progresión tumoral (22, 43). En otro estudio, se evaluó la acción de Veliparib y Olaparib como inhibidores de ADP ribose polymerase (PARP) y se observó el retraso del desarrollo de tumores BRCA1-deficiente (CMTN) en modelo de ratones (44).
Por otra parte, la quimioterapia puede requerir de compuestos suplementarios que mejoren la actividad de los fármacos. En un estudio se observó el efecto antitumoral de doxorrubicina/ciclosporina combinado con IMMUNEPOTENT CRP, inmunomodulador que comprime una mezcla de pequeñas moléculas derivadas del bazo de bovino, en modelo murino aloinjerto con CMTN (45). Otros esquemas de quimioterapia actúan sinérgicamente con la inmunoterapia. Es el caso de α5β1 integrina-marcada con paclitaxel micelar (ATN-MPTX), proteína ATN depositadas en micelas, más nano-STING, activador de la vía inmune innata STING, resultando en la reducción del volumen tumoral y mitigó la metástasis pulmonar (46).
Radioterapia en modelos murinos con CMTN
La radioterapia es una forma de tratamiento que se basa en el empleo de rayos X o gamma para frenar el desarrollo del cáncer bajo los criterios de dosis efectiva, tiempo de exposición y administración localizada o completa (47).
Las terapias hormonales no son útiles para el CMTN, por ello, la radioterapia es una de las opciones de tratamiento contra el CMTN (40, 48). Diversos estudios han demostrado su eficacia para reducir la probabilidad de recurrencia locorregional incrementando la tasa de supervivencia de los pacientes. Sin embargo, son insuficientes, sumado a la resistencia y efectos secundarios ocasionados por las altas dosis de RI (47, 49).
En estos últimos años se han identificado nuevos objetivos de radio sensibilización, como las alquilfosfocolinas sobreexpresadas en células malignas. Su análogo es el 18-(p-yodofenilo) octadecil fosfocolina, que al ser marcado con el radioisótopo 125I, se convierte en CLR 125, agente de radioterapia. Éste se administró en modelos murinos con xenoinjertos subcutáneos y metastásicos de CMTN, y resultó en la destrucción de células cancerosas (50).
En un estudio se reportó la efectividad de destrucción de células tumorales basada en la terapia con protones en ratones con xenoinjertos MDA-MB-231 (51). En el mismo grupo de terapias novedosas se tiene la fotobiomodulación (PBM), que en combinación con radioterapia en ratones BALB/c aloinjerto se observó que la PBM retuvo el crecimiento del tumor, atenuó los efectos negativos de la radioterapia, y frenó la metastasis (47). Otro método de radiosensibilización evaluado en ratones aloinjerto, se basó en el uso de D-manosa, un azúcar inestabilizador del ARNm de BRCA1, RAD50 y MRE11, el cual inhibió el crecimiento tumoral (48). Asimismo, la radioquimioterapia basada en Lu-NM600, evaluada en modelo murino aloinjerto, fue efectiva contra el CMTN, incrementando el tiempo de sobrevivencia (40).
Inmunoterapia en modelos murinos con CMTN
Generalmente, la inmunoterapia, se basa en el uso de antígenos identificados en las células tumorales para generar efecto tumoricida y reprimir la producción de moléculas inmunosupresoras, resolviendo la resistencia a la quimioterapia (8, 42).
Uno de los métodos de inmunoterapia contra el CMTN en modelo murino heterotópico fue la administración de anticuerpos anti-proteasa aspártica catepsina D (cath-D), sobreexpresada en las células tumorales de cáncer de mama, lo cual inhibió el crecimiento tumoral y promovió la activación de linfocitos NK e inactivación de macrófagos M2 (52). Sin embargo, el infiltrado tumoral se compone también de un perfil inmunitario heterogéneo que genera resistencia inmunoterapeutica (36, 53). Se tienen 2 subtipos inmune de CMTN, subtipo enriquecido de neutrófilos inmunosupresores (NES), y subtipo enriquecido de macrófagos (MES), ambos resistentes al bloqueo inmune (53).
Debido a la heterogeneidad inmune, se han desarrollado vacunas basadas en vesículas de membrana tumoral de la línea celular 4T1 (vacuna TMV) combinadas con anticuerpos anti-CTLA-4, promoviendo la activación de los linfocitos T contra el CMTN en murinos aloinjerto (54). Por otro lado, se desarrolló un método inmunoterapéutico con elevada actividad tumoricida basado en el factor estimulante de colonias granulocito-macrófago (GM-CSF) en modelo de ratón aloinjerto (55). Xu et al. desarrollador puerarina en nanoemulsión, denominado nanoPue, que al ser administrado en modelos murinos con CMTN, éste redujo la actividad de los fibroblastos asociados al tumor e incrementó la infiltración de linfocitos T citotóxicos y macrófagos M1 (56).
Terapia basada en probióticos en modelos murinos con CMTN
Debido a la elevada tasa de resistencia a las terapias mencionadas, también se han evaluado formas alternativas complementarias que sean efectivas contra el CMTN. En los últimos años, se ha dado importancia a los probióticos, cepas de microorganismos con propiedades antiinflamatoria, inmunomoduladora, antimetastática, antiangiogénica, ya que, la microbiota gastrointestinal regula el sistema inmune adaptativo, y su alteración puede originar inmunodepresión y mayor susceptibilidad a desarrollar cáncer.
Por ejemplo, se comprobó que la administración oral de Lactobacillus acidophilus, Lactobacillus plantarum depositadas en nanopartículas de selenio, Lactobacillus helveticus R389, Bifidobacterium longum RAPO combinado con anticuerpos anti-PD-1, leche fermentada con Lactobacillus casei CRL 431, redujeron el crecimiento tumoral y metástasis, favoreció la infiltración de linfocitos CD4+ y CD8+ y apoptosis de células tumorales en el modelo murino aloinjerto 4T1 (58, 60, 62). Asimismo, la administración oral de Bifidobacterium bifidum en el mismo modelo, redujo la expresión de Ki67, proteína asociada a la proliferación celular, e incrementó la expresión de p53, proteína supresora tumoral (63).
VENTAJAS Y DESVENTAJAS DEL USO DE MODELOS MURINOS CON CMTN
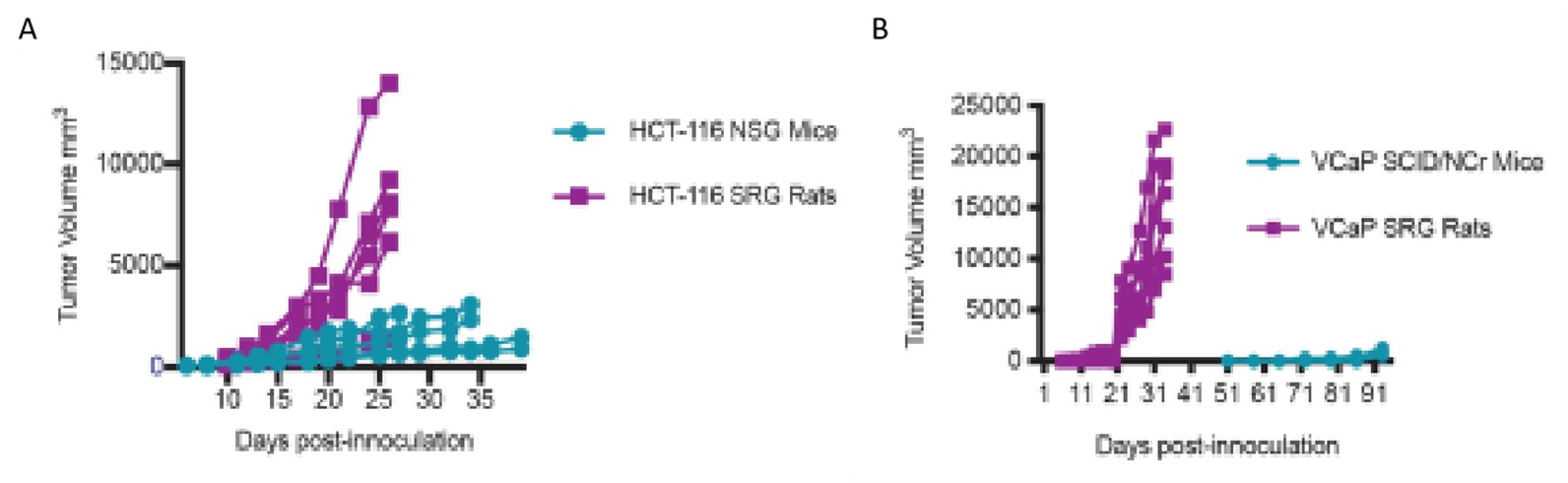
Los ratones BALB/c son los modelos murinos más empleados en estudios de investigación de CMTN (9, 18, 32, 64), siendo los ratones NSG (NOD/SCID/γc−/−) los modelos inmunosuprimidos más efectivos para el desarrollo de metástasis a partir de cáncer de mama, en comparación a los ratones desnudos (atímico) (Puchalapalli et al., 2016). Por otra parte, las ratas Sprague-Dawley o llamadas también ratas Holtzman (Rattus norvegicus), han sido menos empleadas, pero mostraron mayores ventajas por su mayor volumen de biopsias tisulares y líquidas en contraste con los ratones inmunosuprimidos NSG y SCID/NCr (Figura 3), mayor crecimiento de los tumores, mayor capacidad para obtener imágenes no invasivas y mayor facilidad en la manipulación quirúrgica (7).
Una de las desventajas para el uso de modelos murinos, ya sean ratones o ratas, es la demanda de amplias áreas de bioterio y recursos económicos, así como recursos humanos especializados en el manejo de estos animales. Se vienen desarrollando otros modelos animales menos demandantes, de menor tamaño y con mayor costo-efectividad, por ejemplo, el modelo de peces zebra (65). En este modelo se ha registrado que el tiempo de desarrollo del cáncer, dependiendo de su estadio, puede ser entre 5 a 7 días (estadio larval) o de semanas a meses (estadio adulto inmunosuprimido), como en los ratones, pero se emplea un mayor número de células (105 - 106 células) que en los peces cebra (65). Sin embargo, el tamaño de las biopsias para histopatología sigue siendo un beneficio para el uso de los modelos murinos, más aún en ratas (7).
CONCLUSIONES
Entonces, los modelos animales, en particular los murinos, tienen relevancia en el estudio del CMTN, pues los métodos desarrollados para la inducción de CMTN, empleando líneas celulares para modelos de aloinjerto (línea celular de ratón 4T1) y de xenoinjerto (Ej. línea celular humana MDA-MB-231), previa inmunosupresión del animal, se han desarrollado con éxito para la evaluación de la patologia y propuesta de terapias contra la CMTN. Como se reportó anteriormente, no se ha logrado inducir el CMTN mediante compuestos químicos, y son muy escasos los estudios que reportan la inducción de CMTN por radiación ionizante.
Entre las aplicaciones terapéuticas evaluadas en los modelos murinos con CMTN, se han propuesto innovadores tratamientos para enfrentar la alta tasa de resistencia a la quimioterapia, mediados por radiación ionizante, inmunoterapia y consumo de probióticos, siendo la regulación del microbioma un mecanismo complementario para conseguir un mayor efecto antitumoral.
Contribuciones de Autoría:
Los autores participaron en la génesis de la idea, diseño de proyecto, recolección e
interpretación de datos, análisis de resultados y preparación del manuscrito del presente
trabajo de investigación.
Financiamiento:
Autofinanciado
Declaración de conflictos de intereses:
Los autores declaran no tener conflicto de interés.
Recibido:
10 de Octubre del 2023
Aprobado:
20 de Diciembre del 2023
Correspondencia:
Yudith Cauna - Orocollo.
Dirección:
Jr. Enrique Barreda 314, Lima - Perú.
Teléfono:
949610400
Correo electrónico:
yudith.cauna@urp.edu.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.