ARTICULO REVISIÓN
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2024 - Universidad Ricardo Palma10.25176/RFMH.v24i2.6518
ABORDAJE GLOBAL DEL PACIENTE CON PIE DIABÉTICO: UNA REVISIÓN
GLOBAL APPROACH TO THE PATIENT WITH DIABETIC FOOT: A REVIEW
Jordi Viadé-Julià
 1,a
1,a
John Longa-López
 1,2,a
1,2,a
María Nicolás-Piera
 3,a
3,a
Miquel Sabriá-Leal
 1,4,a
1,4,a
Melcior Lladó-Vidal
 1,5,a
1,5,a
Fernando José Muñoz-De La Calle
 6,a
6,a
Xavier Madirolas-Alonso
 1,4,a
1,4,a
Marc Sirvent-González
 7,b
7,b
Clàudia Riera-Hernández
 8,a
8,a
Cristian Carrasco-López
 8,a
8,a
Ricard Pérez-Andrés
 8,a
8,a
Alfonso Rodríguez-Baeza
 1,a
1,a
1 Universidad Autónoma de Barcelona. Barcelona, España.
2 Instituto de Investigación en Ciencias Biomédicas, Universidad Ricardo Palma. Lima, Perú.
3 Hospital Universitario Mútua de Terrassa. Barcelona, España.
4 Parc Hospitalari Martí Julià. Girona, España.
5 Hospital Universitario Son Espases. Palma de Mallorca, España.
6 Hospital General de Medellín. Medellín, Colombia.
7 Hospital General de Granollers. Barcelona, España.
8 Hospital Universitario Germans Trias i Pujol. Badalona, España.
RESUMEN
El pie diabético es una de las complicaciones más prevalentes y graves que pueden desarrollar los
pacientes con diabetes mellitus, y su manejo presenta numerosos desafíos clínicos debido a la
complejidad de las lesiones y las múltiples comorbilidades asociadas. La resolución efectiva de esta
condición requiere la participación coordinada de un equipo multidisciplinario de especialistas,
incluyendo endocrinólogos, cirujanos, ortopedistas y enfermeras especializadas. El objetivo de este
trabajo es presentar el "Sistema para la Evaluación y Tratamiento del Pie Diabético" como una
herramienta integral y fácil de usar que facilita el manejo del pie diabético en diversos entornos
clínicos, incluyendo la atención primaria, hospitales y servicios de urgencias. Este sistema estandariza
la evaluación y el tratamiento, mejora la comunicación entre profesionales y ha demostrado, a lo largo
de más de 20 años, una significativa reducción en el número de amputaciones y una mejora en los
resultados clínicos de los pacientes.
ABSTRACT
Diabetic foot is one of the most prevalent and severe complications that can develop in patients with
diabetes mellitus, presenting numerous clinical challenges due to the complexity of the lesions and the
multiple associated comorbidities. Effective resolution of this condition requires coordinated
participation from a multidisciplinary team of specialists, including endocrinologists, surgeons,
orthopedists, and specialized nurses. The objective of this paper is to present the "System for the
Evaluation and Treatment of Diabetic Foot" as an integral and user-friendly tool that facilitates the
management of diabetic foot in various clinical settings, including primary care, hospitals, and
emergency services. This system standardizes evaluation and treatment, enhances communication among
professionals, and has demonstrated, over more than 20 years, a significant reduction in the number of
amputations and an improvement in clinical outcomes for patients.
INTRODUCCIÓN
El pie, y más concretamente la planta, es la región corporal que nos contacta con el terreno, tanto en
la posición de pie como en la deambulación, debido a nuestra postura bípeda. Un hecho significativo de
la deambulación es, en gran medida, la evolución cultural de nuestra especie. Esta importante función
nos permite diferentes modalidades de movimiento como caminar, correr y practicar deportes, entre otras.
Para ello, disponemos de una serie de receptores, propioceptivos y nociceptivos. Estos receptores nos
permiten interactuar con el terreno y mantener el equilibrio en las diferentes modalidades de
deambulación mediante la denominada ley de Hilton(1).
Existen evidentes homologías en el desarrollo embrionario(2) del autópodo observadas hacia la sexta
semana posfecundación de la mano y el pie (placas manía y pedia) y en la organización anatómica general
de ambas estructuras (similitudes entre los elementos esqueléticos, los músculos intrínsecos y
extrínsecos, los vasos y los nervios). Sin embargo, la diferente función determina las adaptaciones
morfológicas observadas en cada una de ellas.
PIE DIABÉTICO
Se entiende como Pie Diabético(PD) a la “presencia de signos, síntomas o úlcera en el pie a consecuencia
de las complicaciones crónicas de la diabetes”(3). El PD, es una de las complicaciones más prevalentes
en pacientes con diabetes mellitus (DM)(4). En pacientes con DM el riesgo de desarrollar una úlcera en
el pie puede llegar a alcanzar hasta el 25%+.
Cuando en un paciente con DM aparece una úlcera, confluyen varios factores como cambios en los puntos de
apoyo, deformidades o el uso de calzado inadecuado, además de la pérdida total o parcial de la capacidad
protectora (sensibilidad), unido a un trastorno vegetativo y vascular de base. Como consecuencia, se
produce la quiebra de la capa epidérmica y la aparición de una lesión que puede progresar hacia partes
más profundas y alcanzar el hueso (3,5), poniendo en riesgo la extremidad e incluso la vida del
paciente.
El abordaje de las lesiones en el pie suele ser complejo y requiere la participación coordinada de
diferentes profesionales. Estudios han demostrado que el enfoque multidisciplinar es el más eficaz para
tratar a estos pacientes y reducir el número de amputaciones (6-8). Por ello, proponemos nuestro
“Sistema de evaluación y tratamiento del Pie Diabético” para facilitar este enfoque (9).
Esta revisión tiene como objetivo proporcionar una visión global del manejo del PD, destacando la
importancia de un enfoque multidisciplinar y presentando un sistema de evaluación y tratamiento fácil de
usar y aplicable en cualquier ámbito de trabajo, desde la atención primaria hasta el hospital o los
servicios de urgencias. Además, se discuten las limitaciones y posibles sesgos en los estudios revisados
para proporcionar una visión más equilibrada y crítica de la literatura.
EPIDEMIOLOGÍA DE LA NEUROPATÍA DIABÉTICA
La prevalencia de la neuropatía diabética (ND) varía según la serie consultada, dependiendo de la
metodología diagnóstica, los criterios empleados y la duración de la enfermedad en la población
estudiada, lo cual dificulta la comparación de las prevalencias obtenidas en distintas latitudes. En
este contexto, Pirart J. evaluó a 4 400 pacientes con diabetes mellitus (DM) durante 25 años de
seguimiento (10-13). En este estudio, la neuropatía se definió como una disminución de la sensibilidad
en los pies y la disminución o ausencia del reflejo aquiliano. La aparición de la neuropatía se
correlacionó positivamente con la duración de la DM y, a los 25 años, el 50 % de los pacientes había
desarrollado neuropatía.
En España, Mundet et al. evaluaron la prevalencia e incidencia de complicaciones macro y microvasculares
en un período de diez años de seguimiento, en un estudio de base poblacional prospectivo que incluyó 317
pacientes con DM tipo 2, encontrando una prevalencia de ND de 26,8 % [19,3-30,2] al final del estudio
(14). En Latinoamérica y el Caribe, una revisión sistemática y metaanálisis de 29 estudios de ocho
países de la región reportó una prevalencia estimada de ND de 46,5 % (95 % CI: 38,0-55,0) con una
significativa heterogeneidad (I² = 98,2 %; p < 0,01), encontrando una tendencia creciente de
prevalencia
acumulada de ND a lo largo del tiempo. En este mismo estudio, en Perú, se reportaron cuatro
investigaciones con un tamaño muestral de 874 pacientes, hallándose una prevalencia de ND de 52 %
(15).
Sin embargo, es importante señalar que hasta el 50 % de los pacientes con ND pueden ser
asintomáticos, lo cual incrementa la brecha de subdiagnóstico de esta complicación. Según Longa J.
en su estudio “Actitudes de los Médicos hacia el Abordaje de la Neuropatía Diabética en
Establecimientos de Salud Públicos y Privados, 2023”, de 143 médicos encuestados, el 80,5 %
manifestó basarse solo en los síntomas y signos referidos por el paciente para hacer el diagnóstico
de ND (16).
La alta tasa de ND produce una morbilidad sustancial, que incluye la discapacidad generada por los
síntomas dolorosos neuropáticos y el déficit neurológico subyacente, los cuales tienen un gran
impacto en la calidad de vida de estos pacientes y traen como consecuencia manifestaciones como
ataxia, debilidad, caídas, fracturas, laceraciones, traumatismos encéfalo craneanos, infecciones
recurrentes de las extremidades inferiores, ulceraciones y amputaciones posteriores. Los pacientes
con diagnóstico de pie diabético (PD) ocupan más camas de hospital que aquellos con otras
complicaciones diabéticas (17). El riesgo acumulado de amputación de una extremidad inferior en un
estudio fue del 11 %, 25 años después del diagnóstico de DM (18).
Los factores de riesgo para ND que han sido estudiados varían según la fuerza de asociación. Tienen
una muy fuerte asociación: la duración de la diabetes, la hiperglicemia y la edad. Tienen una fuerte
asociación: la prediabetes, la talla, la hipertensión arterial, la obesidad, el síndrome metabólico,
el estrés oxidativo, la deficiencia de vitamina D, los factores genéticos, la inflamación subclínica
y el bajo nivel de actividad física. Tienen una moderada asociación: la variabilidad glicémica, la
dislipidemia, el tabaquismo, la resistencia a la insulina, el consumo de alcohol, la
hipoinsulinemia, la activación plaquetaria y la depleción del factor de crecimiento (19).
DIAGNÓSTICO DE LA NEUROPATÍA DIABÉTICA
El tamizaje de la neuropatía diabética (ND) debe realizarse en pacientes con diabetes mellitus tipo
2 (DM2) al momento del diagnóstico de la enfermedad. En pacientes con diabetes mellitus tipo 1
(DM1), el tamizaje se debe realizar a los cinco años del diagnóstico. Asimismo, los pacientes con
prediabetes deben ser incluidos en este tamizaje si presentan síntomas neuropáticos. Si el examen
inicial es negativo, deberá repetirse anualmente (20).
El diagnóstico de la ND se basa en tres pilares fundamentales: la evaluación de los síntomas,
los signos y, en algunas ocasiones, la realización de pruebas de neurofisiología y/o morfometría.
Los síntomas pueden clasificarse como positivos o negativos, dependiendo de si hay una ganancia o
pérdida de función, resultado de la respuesta desadaptativa al daño o patología del sistema nervioso
somatosensorial. En el primer grupo de síntomas (positivos), se encuentran las parestesias, el dolor
espontáneo (tipo quemazón, ardor, fulgurante, etc.) o el dolor evocado (hiperalgesia o alodinia). En
el segundo grupo (negativos), se pueden hallar déficits sensitivos como hipoestesia, anestesia,
hipoalgesia o analgesia. Estos tipos de manifestaciones clínicas pueden coexistir o alternar a lo
largo de la historia natural de la ND.
La evaluación sistemática de los síntomas puede realizarse a través de cuestionarios validados,
tales como el Michigan Neuropathy Screening Instrument (MNSI), la Utah Early Neuropathy Scale
(UENS), el United Kingdom Screening Test y el Total Symptom Score (TSS). Desde el punto de vista
fisiopatológico, la afectación de las fibras nerviosas delgadas (C o Aδ), caracterizadas por ser
amielínicas o finamente mielinizadas, se manifiesta clínicamente como dolor tipo quemazón, descargas
eléctricas o puñaladas. También pueden presentarse síntomas neurovegetativos, ya que estas fibras se
encargan de la sensibilidad termoalgésica y de la función autonómica.
En cuanto a las fibras gruesas (Aα o Aα/β), su afectación puede ocasionar dolor tipo entumecimiento,
sensación de caminar sobre algodones, dificultad para realizar tareas finas como pasar las páginas
de un libro o abrocharse los botones de una camisa, y alteraciones del equilibrio o del trofismo
músculo-esquelético, con incapacidad ocasional para pararse sobre la punta de los pies o los
talones. Estas fibras mielinizadas tienen como función el control muscular, así como la sensibilidad
táctil, vibratoria y propioceptiva.
En el examen físico, se pueden encontrar signos como piel seca, fisuras, hiperqueratosis plantar,
úlceras, dedos sobrepuestos o rígidos, dedos en martillo o garra, deformidades, prominencias óseas,
neuroartropatía de Charcot y atrofia de los músculos interóseos. La evaluación clínica de los
distintos tipos de fibras nerviosas depende de la disponibilidad de recursos instrumentales,
pudiendo emplearse para tal propósito el monofilamento de Semmes-Weinstein de 10 g, el diapasón de
128 Hz y el martillo de reflejos para evaluar las fibras gruesas, y la barra térmica y el pinprick
para evaluar las fibras delgadas.
Es importante señalar que ninguna de estas pruebas por sí sola alcanza la sensibilidad y
especificidad necesarias para el diagnóstico de ND, por lo que es necesario combinar dos o más de
ellas para confirmar el diagnóstico. Además, no existe una estandarización de la metodología de
evaluación, lo que puede dificultar la detección de neuropatía en etapas tempranas (21).
Las pruebas de neurofisiología y/o morfometría son herramientas importantes, aunque de uso limitado
debido a su complejidad y poca disponibilidad en la práctica médica habitual. Para la evaluación de
fibras gruesas, se utilizan estudios de velocidad de conducción nerviosa (VCN) para fibras Aβ y el
DPNCheck, que evalúa las fibras Aβ del nervio sural con una buena sensibilidad (92-95 %) comparado
con la VCN. Para la evaluación de fibras delgadas, se puede emplear la biopsia de piel, que permite
evaluar las fibras C a través de la cuantificación de la densidad de fibras nerviosas
intraepidérmicas (IENFD), considerada el estándar de oro para esta evaluación y capaz de detectar
cambios tempranos. La microscopía corneal confocal (MCC) también permite evaluar las fibras Aδ y C,
siendo un método no invasivo de buena reproducibilidad, rápido y objetivo.
Las pruebas autonómicas como el Neuropad, el Sudoscan y el QSART son útiles para evaluar las fibras
C, responsables de funciones neurovegetativas, incluidas las sudomotoras. Aunque estas herramientas
tienen sensibilidades y especificidades diferentes, son útiles para este propósito. Los métodos
cuantitativos de evaluación de umbrales de sensibilidad térmica y vibratoria (Quantitative Sensory
Testing, QST) permiten evaluar tanto fibras delgadas (Aδ y C) como gruesas (Aβ) con una buena
reproducibilidad (21).
NEUROPATÍA DE CHARCOT
La neuroartropatía de Charcot tiene una etiología multifactorial, y se han propuesto dos teorías
principales para explicar su desarrollo: la neurotraumática y la neurovascular. La teoría
neurotraumática sugiere que la deficiente percepción del dolor en pacientes diabéticos provoca que
los traumas repetitivos no sean detectados, resultando en fracturas múltiples y el colapso de la
estructura ósea del pie. Por otro lado, la teoría neurovascular postula que la destrucción ósea se
debe a un estado de hiper-vascularidad causado por una alteración nerviosa simpática, lo que lleva a
la pérdida del control vasomotor. Esta condición provoca una lixiviación de minerales óseos,
resultando en osteopenia u osteoporosis, haciendo al tejido más susceptible a fracturas de baja
magnitud.
El proceso inflamatorio es localizado y persistente, sin repercusiones sistémicas, y se caracteriza
por un incremento del flujo vascular y niveles elevados de citoquinas proinflamatorias. Esto
desequilibra la actividad del sistema RANKL (receptor activador del factor nuclear kappa B ligando),
aumentando el número y actividad de los osteoclastos y, por ende, la resorción ósea. Moléculas como
el péptido relacionado al gen de la calcitonina, que normalmente estabilizan la matriz extracelular
capsulo-ligamentaria, se liberan menos en el contexto del pie diabético, propiciando un entorno de
inestabilidad biomecánica y la generación de zonas de presión (22). Además, la cicatrización se ve
comprometida debido a la disminución de la actividad de los macrófagos y la angiogénesis, aumentando
el riesgo de infección debido a una respuesta inmunitaria disminuida (23).
El diagnóstico de la neuroartropatía de Charcot es principalmente clínico. Los signos semiológicos
incluyen inflamación (flogosis) y edema. Es crucial investigar cambios neuropáticos en la anamnesis
y objetivar diferencias de temperatura mayores de 2 °C con respecto a la extremidad contralateral.
En fases avanzadas, los signos inflamatorios se vuelven menos notorios, predominando prominencias
óseas y deformidades en el pie, especialmente en el retropié, que pueden incluir dedos en garra y
piel seca (xerótica) debido a la pérdida de humectación (24,25).
Las pruebas de laboratorio, como la fosfatasa alcalina óseo-específica y los niveles de telopéptidos
carboxi-terminal del colágeno tipo 1, son útiles para cuantificar la resorción ósea en fases agudas
y disminuyen conforme se establece la cronicidad. Los reactantes de fase aguda, como
eritrosedimentaciones menores de 70 mm/h, indican un proceso más neuroartropático que infeccioso.
Las radiografías en carga (postero-anterior y lateral) junto con vistas oblicuas permiten observar
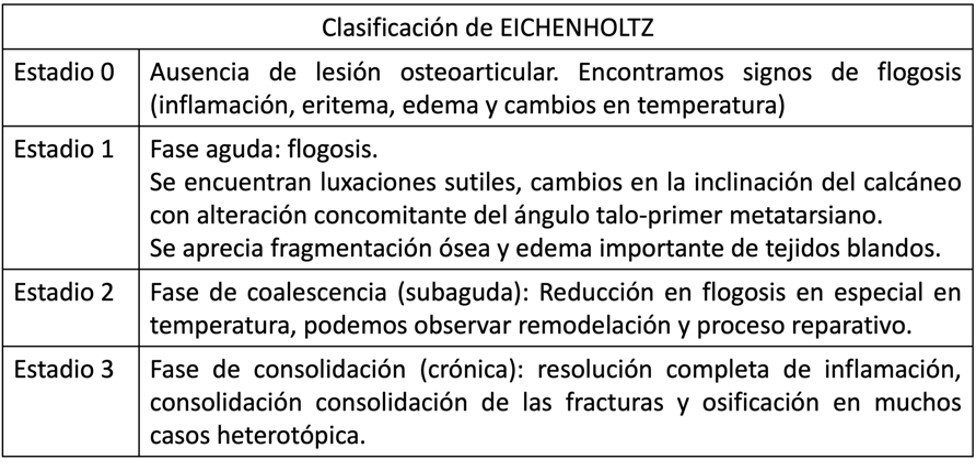
deformidades y clasificar la enfermedad según la clasificación de Eichenholtz (26). Es importante
evaluar deformidades en el plano sagital, considerando las inclinaciones a nivel de Chopart y la
elevación ("pitch") del ángulo calcáneo y quinto metatarsiano.
Tabla 1. Clasificación de Eichenholtz.
En la fase aguda, la resonancia magnética (RM) puede evidenciar edema de médula ósea subcondral
y microfracturas, facilitando el seguimiento del proceso clínico. La tomografía por emisión de
positrones/tomografía (PET/TC) muestra incrementos en el metabolismo de las regiones afectadas,
permitiendo una evaluación más sensible. Diferenciar la artropatía de Charcot de un proceso
infeccioso o inflamatorio puede ser difícil, ya que pueden coexistir. Por ello, proponemos un
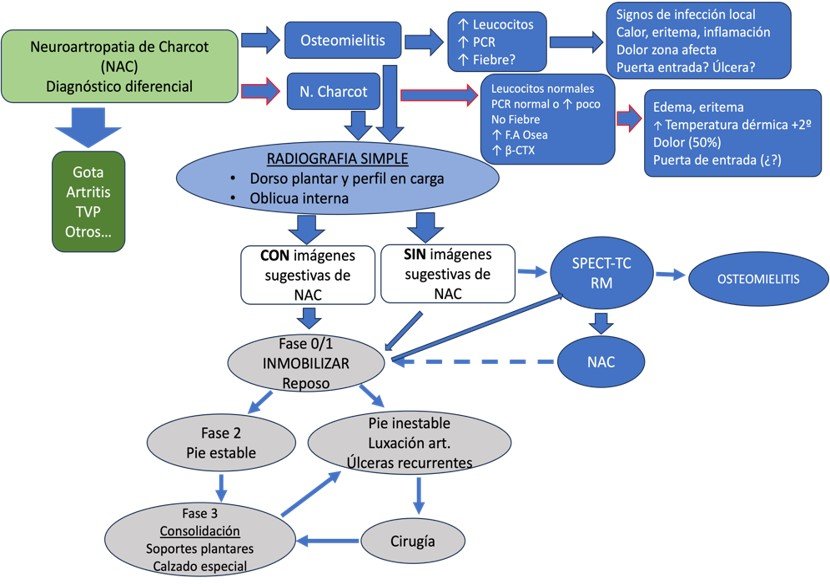
algoritmo que forma parte del sistema de diagnóstico, evaluación y tratamiento (Ilustración 1).
Ilustración 1.Algoritmo diagnóstico de Neuroartropatía de Charcot.
Se recomienda un tratamiento conservador siempre que sea posible. Las descargas son esenciales y
pueden realizarse mediante yeso de contacto total inicial durante seis a ocho semanas, con
cambios cada dos semanas, hasta que el estado inflamatorio se reduzca, permitiendo el uso de
calzado ortopédico adaptado. Este proceso generalmente toma un mínimo de seis meses. A excepción
del manejo metabólico y de las comorbilidades del paciente con DM, no hay evidencia de la
efectividad de medicamentos específicos para el tratamiento de la artropatía de Charcot (27).
El objetivo del tratamiento es obtener un pie plantígrado con una distribución homogénea de las
presiones plantares. Si se mantiene esta posición, hasta el 50 % de las ulceraciones
neuropáticas pueden curarse sin necesidad de intervenciones quirúrgicas, permitiendo al paciente
retornar a un nivel funcional similar al previo, prevenir ulceraciones y reducir costos médicos
a largo plazo.
Las deformidades crónicas son un desafío significativo para corregir debido a la alteración
morfológica y la generación de úlceras prominentes. Es esencial una evaluación holística del
paciente, incluyendo antecedentes de infecciones, cultivos previos, tratamientos y estudios
imagenológicos para determinar las articulaciones comprometidas. Se debe planificar el material
de fijación adecuado y tomar cultivos apropiados para usar antimicrobianos según los resultados
(3,27). Las intervenciones pueden incluir tutores externos, fijaciones con tornillos y placas,
exostectomías, transferencias y alargamientos miotendinosos, que pueden ser transicionales hasta
lograr un constructo definitivo (28).
PIE VASCULAR
La enfermedad macrovascular en pacientes con DM se caracteriza por ser un proceso ateromatoso
difuso que afecta no solo a las arterias de las extremidades inferiores, sino también a las
arterias coronarias y carótidas. La afectación arterial en la enfermedad arterial periférica
(EAP) varía dependiendo de si el paciente tiene DM. En pacientes sin DM, la EAP afecta
preferentemente el territorio aorto-ilíaco y femoropoplíteo. En contraste, en pacientes con DM,
la EAP afecta con mayor frecuencia a las arterias tibiales, es decir, a las arterias situadas
por debajo de la rodilla. Curiosamente, las arterias del pie suelen estar conservadas, lo cual
es relevante al considerar las opciones de tratamiento para estos pacientes (3).
En cuanto a la prevalencia de EAP en pacientes con pie diabético (PD), los datos actuales
muestran que esta condición está presente en aproximadamente la mitad de los pacientes. La
presencia de EAP en pacientes con PD incrementa el riesgo de infección de la úlcera y dificulta
su cicatrización (29). Esto se debe, al menos en parte, a la dificultad para que lleguen
nutrientes y oxígeno al tejido, así como a la pobre penetración de los antibióticos en el tejido
infectado.
El tratamiento de la isquemia en pacientes con PD sigue siendo subóptimo según los datos del
estudio Eurodiale. El objetivo principal de este estudio, en el que participaron 14 centros
hospitalarios, fue analizar las características de 1 229 pacientes con DM que presentaban una
úlcera en el pie. Solo al 40 % de los pacientes con isquemia grave se les realizó una
angiografía y solo al 43 % de los pacientes con isquemia crítica se les practicó un
procedimiento de revascularización (30).
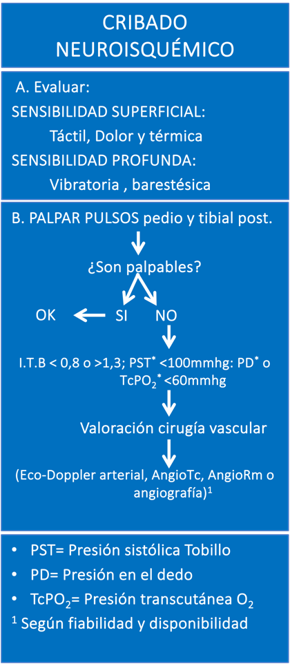
Ilustración 2. Algoritmo de Cribaje Neuroisquémico.
ABORDAJE INTEGRAL DEL PACIENTE DIABÉTICO CON ULCERA EN EL PIE
El manejo de las úlceras en pacientes diabéticos es complejo debido a la necesidad de
intervención de múltiples profesionales. Esta complejidad radica en la ejecución coordinada del
tratamiento propuesto. Para facilitar este abordaje multidisciplinar, proponemos utilizar el
"Sistema de evaluación y tratamiento del Pie Diabético", publicado en noviembre de 2023 en la
revista Foot and Ankle Research.
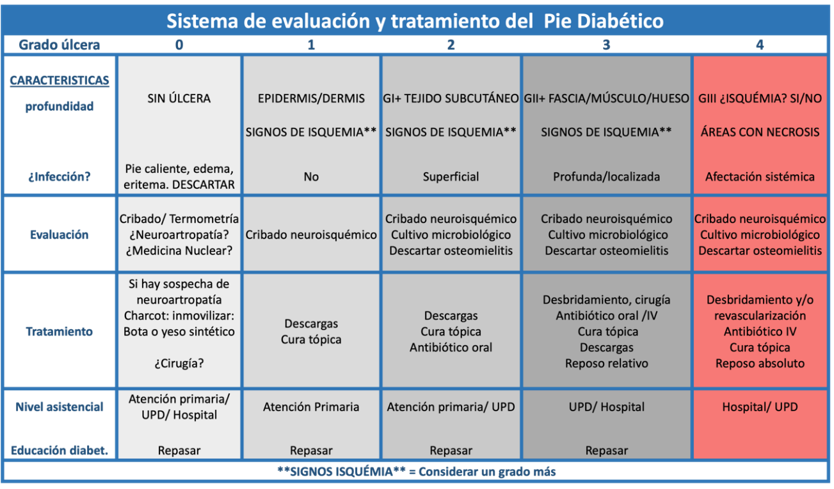
Este sistema (Tabla 2) está compuesto por una tabla principal que evalúa dos variables fijas: la
presencia de infección y la profundidad de la úlcera, clasificándolas en cinco grados (de 0 a
4). El grado 0 descarta el pie de Charcot o infecciones subyacentes sin la presencia de úlcera;
el grado 1 abarca úlceras superficiales (epidermis/dermis) sin signos de infección; el grado 2
incluye úlceras que llegan al tejido subcutáneo con signos de infección superficial; el grado 3
comprende úlceras profundas que alcanzan el tejido subcutáneo o el hueso, con signos de
infección profunda pero localizada; y el grado 4 considera úlceras profundas como en el grado 3,
pero que además presentan isquemia crítica, áreas de necrosis y/o afectación sistémica. Cuando
una úlcera es de carácter isquémico, se considera y trata como un grado adicional debido al
empeoramiento significativo del pronóstico.
Ilustración 2. Sistema de evaluación y tratamiento propuesto.
Además de la tabla principal, el sistema incluye nueve tablas o algoritmos complementarios que
abordan diferentes aspectos del manejo del PD: diagnóstico de neuroartropatía de Charcot
(Ilustración 1), cribaje neuroisquémico (Ilustración 2), diagnóstico de osteomielitis
(Ilustración 3), obtención de muestras para cultivo microbiológico (Ilustración 4),
microorganismos a considerar (Ilustración 5), antibióticos orales (Ilustración 6), tratamiento
tópico (Ilustración 7), sistemas de descarga (Ilustración 8), y técnicas quirúrgicas (Ilustración
9). Cada uno de estos algoritmos proporciona pautas para la exploración requerida, el
diagnóstico diferencial y el tratamiento más adecuado para cada situación. La implementación de
este sistema permite una gestión más estructurada y efectiva de las úlceras en pacientes
diabéticos, optimizando la colaboración entre los diversos especialistas involucrados.
INFECCIONES Y ANTIBIOTICOTERAPIA EN EL PIE DIABÉTICO
La infección en pacientes diabéticos puede ser una complicación grave. Aunque la mayoría de las
infecciones son superficiales, hasta un 25 % de ellas pueden extenderse a los tejidos más
profundos, llegando incluso a afectar el hueso. Es importante recordar que una úlcera infectada
en el pie precede al 60 % de las amputaciones (31). El tratamiento antibiótico de las
infecciones en el pie diabético requiere un conocimiento profundo de la patogenia de la lesión,
con mención expresa del biofilm, y de los microorganismos involucrados. Esto es fundamental para
seleccionar el antibiótico adecuado, basándose en la sensibilidad del microorganismo y en varias
características farmacocinéticas.
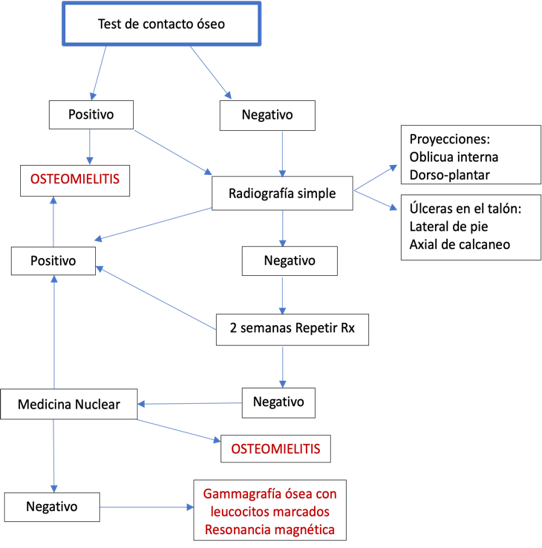
La infección del hueso, u osteomielitis, es una complicación frecuente de las úlceras del pie
diabético. Para descartar la infección por contigüidad, se realiza el test de contacto óseo.
Cualquier hueso expuesto en la base de una úlcera, ya sea visible o que se pueda contactar
introduciendo un estilete de punta roma estéril, tiene una alta probabilidad de estar infectado,
con una especificidad del 83 % y una sensibilidad del 87 % (32). El siguiente algoritmo
(Ilustración 3) ayuda en la correcta interpretación del test de contacto óseo y en el
diagnóstico preciso de osteomielitis.
Ilustración 2. Test de contacto óseo para diagnóstico de Osteomielitis.
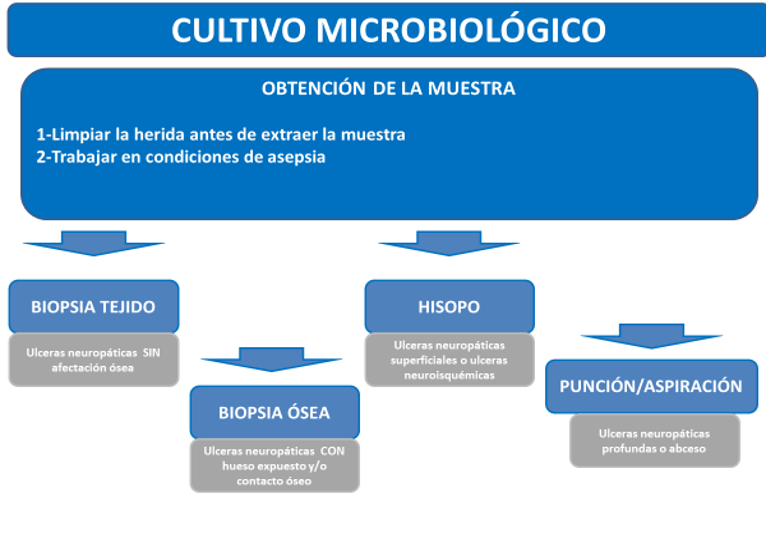
BIOFILM Y CULTIVO MICROBIOLÓGICO
La presencia del biofilm en las úlceras del pie diabético complica la antibioticoterapia. El
biofilm, una biocapa generada por la interacción de las células que recubren la úlcera y
factores fisicoquímicos y bacterianos, dificulta la penetración y actividad de los antibióticos,
así como el aislamiento de los microorganismos responsables de la infección. Esto último impide,
con muestras mal recogidas, diferenciar entre contaminación e infección (33). Para identificar
etiológicamente al microorganismo responsable, es obligatorio limpiar y desbridar la herida
antes de obtener la muestra. Esta puede ser obtenida mediante raspado de la úlcera con bisturí,
legrado o biopsia de la superficie. También puede ser útil la aspiración de secreciones
purulentas con una aguja y jeringa estéril. Todas las muestras deben colocarse rápidamente en un
contenedor estéril o medio adecuado y remitirse al laboratorio para Gram y cultivo aerobio y
anaerobio (34).
Ilustración 4. Procedimiento para obtención de muestras para cultivo microbiológico.
Por el contrario, no se deben cultivar úlceras no infectadas ni obtener muestras sin lavado o
desbridamiento previo, ni mediante escobillado de la herida o de secreciones purulentas. En la
Tabla 3 se presentan los microorganismos responsables de la infección del pie diabético según
varias series(31,35-37).
| GRAM POSITIVOS | |
|---|---|
| S. aureus | 72 (30) |
| S. coagulasa negativos | 4 (1.7) |
| Enterococcus spp | 8 (3.3) |
| Streptococcus pyogenes | 4 (1.7) |
| GRAM NEGATIVOS | |
| E. coli | 24 (10) |
| Klebsiella pneumoniae | 22 (9.2) |
| Enterobacter spp | 22 (9.2) |
| Proteus spp | |
| Pseudomonas aeruginosa | 28 (11.7) |
| Acinetobacter spp | 12 (5.2) |
| S. maltophilia | 2 (0.8) |
| ANAEROBIOS | 21 (2) |
| OTROS | (>5.2) |
Sin embargo, según las características de la herida habrá que tener en cuenta especialmente
determinados microorganismos (Tabla 4).
| Tipo de herida | Microorganismos responsables de la infección |
|---|---|
| Celulitis o herida cutánea abierta | S. aureus / Streptococcus β hemolíticos |
| Úlcera infectada (NO antibióticos previos) | S. aureus / Streptococcus β hemolíticos |
| Úlcera crónica infectada (antibióticos previos) | S. aureus / Streptococcus β hemolíticos / Enterobacteriaceae |
| Úlcera macerada | Pseudomonas aeruginosa |
| Úlceras de larga duración con antibióticos previos | Cocos gram positivos aerobios, Enterobacterias, Pseudomonas spp y otros BGN no fermentadores |
| Olor fétido, necrosis extensa o gangrena | Flora polimicrobiana: cocos gram positivos, enterobacterias, BGN no fermentadores, anaerobios |
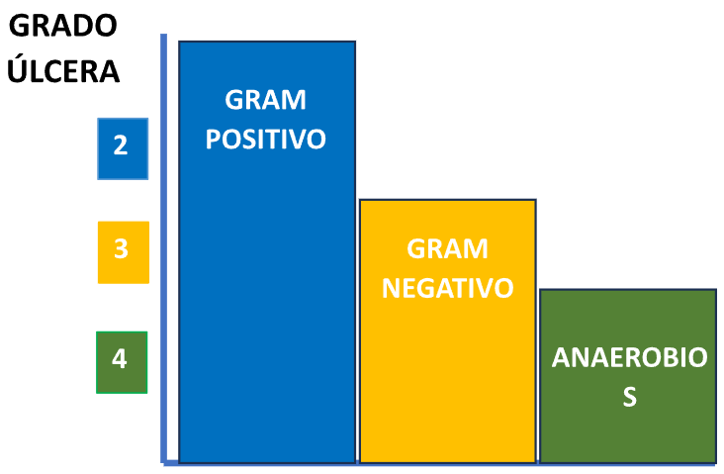
Dependiendo de la gravedad de la úlcera, según los criterios de nuestro sistema de
clasificación, se deben considerar los microorganismos indicados en la ilustración 5.
Ilustración 5. Microorganismos a considerar según la gravedad de la úlcera.
Como se observa en la ilustración 5, los cocos grampositivos están presentes habitualmente en
todos los estadios de gravedad, por lo que siempre será necesario cubrirlos con los antibióticos
adecuados. Los anaerobios, por el contrario, se observan en úlceras graves y siempre asociados a
otros microorganismos. En estos casos, se impone un tratamiento antibiótico de amplia cobertura,
considerando también la posibilidad de enterobacterias multirresistentes productoras de
betalactamasas de espectro extendido.
ANTIBIOTICOTERAPIA
Antes de administrar antibióticos, es crucial considerar varias características inherentes al
microorganismo y a la farmacocinética del antibiótico. Esto incluye la sensibilidad del
microorganismo a los antibióticos probados según antibiograma, la biodisponibilidad del
antibiótico cuando se administra por vía oral y su volumen de distribución (38).
La biodisponibilidad oral es una característica fundamental para seleccionar antibióticos
eficaces por esta vía. Algunos antibióticos, como las fluoroquinolonas, tienen una
biodisponibilidad cercana al 100 %, mientras que la amoxicilina no alcanza el 70 %. Ambos son
útiles en el pie diabético, pero las dosis deben ajustarse adecuadamente (39). El volumen de
distribución también es importante, ya que algunos antibióticos se distribuyen preferentemente
en el compartimento vascular, alcanzando el intersticio y el compartimento celular en bajas
concentraciones. En el pie diabético, se prefieren antibióticos con un alto volumen de
distribución para asegurar que lleguen adecuadamente al lugar de la infección (40).
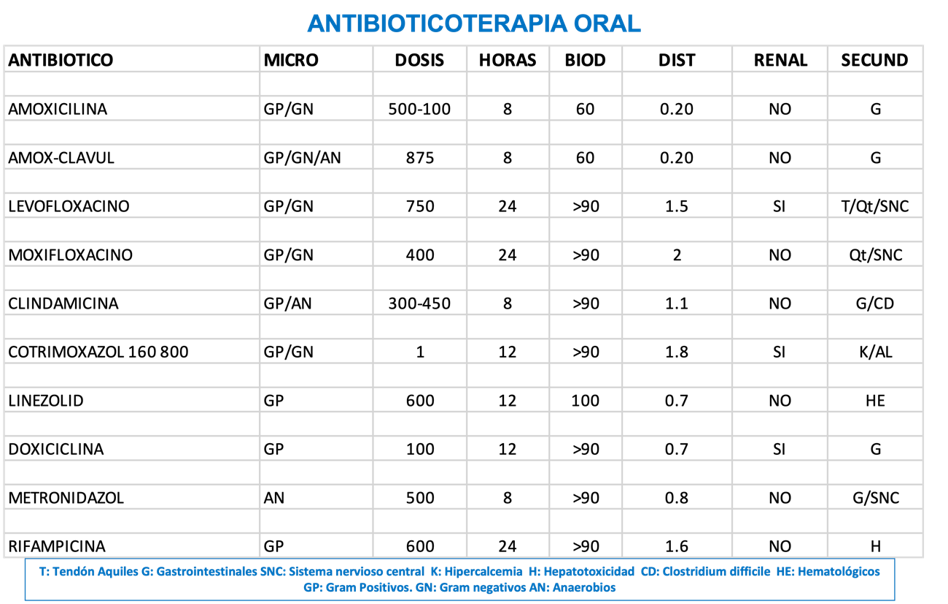
En La Ilustración 6 se presenta un esquema que detalla el uso y las consideraciones de los
antibióticos orales en el tratamiento de infecciones en el pie diabético. La ilustración se
divide en varias secciones que abordan aspectos críticos de la antibioticoterapia, tales como la
selección del antibiótico, su biodisponibilidad oral y el volumen de distribución.
Ilustración 6. Antibioticoterapia oral para infecciones del pie diabético.
DURACIÓN DEL TRATAMIENTO ANTIBIÓTICO
La duración del tratamiento antibiótico varía según la severidad de la infección. La mayoría de
las úlceras se esterilizarán con una o dos semanas de tratamiento oral. En casos más
complicados, se puede iniciar con tratamiento intravenoso seguido de tratamiento oral hasta
completar dos semanas. La sospecha de osteomielitis requiere tratamientos de tres a cuatro
semanas, y tras el desbridamiento, si queda hueso viable, el tratamiento debe continuar por
aproximadamente tres meses. En todo caso, la evolución clínica determinará la duración exacta
del tratamiento antibiótico (38,41).
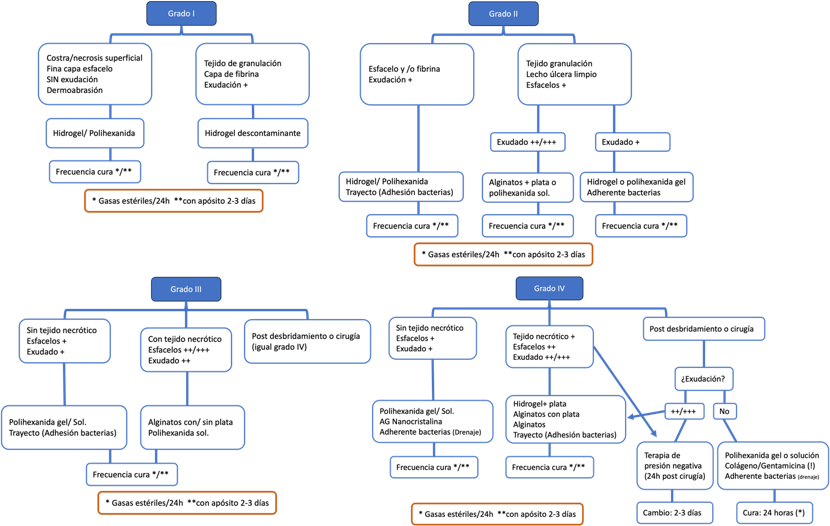
TRATAMIENTO TÓPICO
En los últimos años, se han desarrollado nuevas tecnologías y productos para acelerar la
cicatrización de úlceras en el pie en pacientes con diabetes. Actualmente, existe una amplia
gama de productos y dispositivos para el tratamiento tópico. La elección del producto adecuado
depende de varios factores, incluyendo la profundidad y extensión de la úlcera, la presencia de
infección y/o tejido necrótico, y el grado de exudación (42). Es importante considerar que la
propia enfermedad puede ralentizar este proceso de cicatrización debido a la presencia de
vasculopatía, neuropatía, factores de inmunodeficiencia humoral, tabaquismo, entre otros (3).
En úlceras ubicadas en la planta del pie, donde el estrato córneo es más grueso, no se
recomienda el uso de apósitos adhesivos para evitar la maceración. Si el grado de exudación es
significativo o se requiere realizar un injerto, la terapia de presión negativa puede ser una
opción terapéutica efectiva (43). La Ilustración 7 proporciona una orientación sobre el
tratamiento tópico en función del grado de la úlcera.
Ilustración 7. Orientación sobre el tratamiento tópico de úlceras según el grado.
La descarga es esencial para la prevención o tratamiento de las zonas de presión o con úlcera
activa. Existen diversos materiales y sistemas disponibles para este propósito, que requieren
conocimientos en biomecánica y habilidades para su correcta confección y aplicación. El objetivo
general de las descargas, ya sean provisionales (fieltro adhesivo, plastic cast, ortesis
funcional) o definitivas (soporte plantar, ortesis de silicona, calzado especial), es distribuir
uniformemente las fuerzas y presiones que inciden en el pie, protegiendo las zonas sanas y
aislando las zonas ulceradas o susceptibles (3).
Las alteraciones estructurales del pie, junto con una elevada presión plantar, son factores
principales que influyen en la formación de úlceras plantares en pacientes diabéticos (44)44Para
la confección de descargas provisionales, se utiliza preferentemente fieltro adhesivo y vendas
de poliuretano. La ortesis funcional (Walker) puede usarse en combinación con fieltro adhesivo
para descarga o para controlar el edema y evitar deformidades en pacientes con neuroartropatía
de Charcot en fase 0-1 o sospecha (45).
La utilización de soportes plantares está indicada para cuando la úlcera esté curada o como
prevención de áreas de hiperpresión que, de no corregirse, podrían convertirse en úlcera, así
como para evitar las recidivas (3,46). La Ilustración 8 presenta un esquema detallado de los
diferentes sistemas de descarga utilizados en el manejo de úlceras del pie diabético. Estos
sistemas son cruciales para reducir la presión sobre las áreas afectadas y promover la
cicatrización.
Ilustración 8. Sistema de descargas de úlceras en pie diabético.
TRATAMIENTO QUIRÚRGICO
La cirugía es frecuentemente necesaria en pacientes diabéticos para tratar una variedad de
problemas como úlceras, infecciones y deformidades severas. Diversas técnicas quirúrgicas se
utilizan para corregir deformidades, eliminar zonas de hiperpresión, mejorar el apoyo del pie,
curar o evitar úlceras, revascularizar la extremidad o realizar algún tipo de amputación (47)
(Ilustración 9).
Ilustración 9. Técnicas quirúrgicas para el tratamiento del pie diabético.
El pilar básico de las intervenciones quirúrgicas en el pie diabético son las osteotomías. Estas
intervenciones permiten corregir deformidades óseas que pueden contribuir a la formación de
úlceras. La cirugía en estos casos consiste en cortar y reposicionar huesos para aliviar la
presión y mejorar la distribución de cargas en el pie (48). Las osteotomías están especialmente
indicadas en úlceras neuropáticas sin osteomielitis subyacente que no responden al tratamiento
convencional.
Entre las osteotomías más frecuentes están: la osteotomía de base del primer metatarsiano (49),
indicada en casos de hiperpresión en la cabeza del primer metatarsiano, provocada por pies
cavos, pies aductos, acortamiento muscular del compartimento posterior de la pierna o
alteraciones biomecánicas; la osteotomía de base de la falange proximal del primer dedo (3),
indicada para tratar úlceras ubicadas en la zona plantar de la articulación interfalángica del
primer dedo; y la osteotomía oblicua distal de los metatarsianos menores (segundo a quinto)
(50), indicada en úlceras situadas en la zona metatarsal plantar sin presencia de osteomielitis.
La decisión sobre el número y tipo de osteotomías se basa en criterios clínicos y radiológicos,
teniendo en cuenta la morfología de la fórmula metatarsal y la localización de la úlcera,
recomendándose seguir la fórmula de Leventen para guiar estas intervenciones (3).
TÉCNICAS QUIRÚRGICAS
Cuando se encuentra un pie infectado, las técnicas quirúrgicas más comunes incluyen inicialmente
el desbridamiento quirúrgico, que consiste en la eliminación de tejido muerto o infectado
alrededor de una úlcera. Este procedimiento no solo limpia la herida y promueve la curación,
sino que también permite la recogida de muestras para su estudio y cultivo microbiológico. El
desbridamiento puede necesitar repetirse según sea necesario (3,47,51).
Una vez realizado el desbridamiento, se pueden llevar a cabo diferentes técnicas quirúrgicas
dependiendo del problema específico. Las exostectomías, ya sean parciales o completas, permiten
realizar el cierre cutáneo y prevenir recidivas de las úlceras (3,52). En casos de
inestabilidades articulares o grandes deformidades, se realiza una artrodesis, que implica la
fusión de una articulación. Al fusionar una articulación, se elimina su movilidad natural,
reduciendo así el riesgo de formación de nuevas úlceras. Las artrodesis pueden realizarse
mediante fijación interna con placas y tornillos o mediante fijación externa (53), conocida como
osteotaxis.
Debido a la complejidad biológica de los pacientes diabéticos, las artrodesis no siempre son
efectivas y pueden resultar en una artroplastia fibrosa. Aunque no es el escenario ideal, la
artroplastia fibrosa proporciona una estabilidad relativa compatible con la deambulación y un
pie plantígrado (54). Para evitar este escenario, actualmente se tiende a realizar las
artrodesis y las osteosíntesis con técnicas de "superconstrucciones", que utilizan una mayor
cantidad de material de osteosíntesis y tornillería para asegurar una fijación más robusta y
duradera (55).
Técnicas e indicaciones de la revascularización
En situaciones donde los resultados de otras intervenciones no son satisfactorios y la evolución
es desfavorable, comprometiendo la extremidad o la vida del paciente (56), se recurre a las
amputaciones. En casos graves, donde las úlceras o infecciones son extensas y no responden a
otros tratamientos, la amputación puede ser la única opción para prevenir la propagación de la
infección y salvar la vida del paciente. Además, en casos donde el sistema arterial se encuentra
obstruido, la revascularización del pie diabético puede ser necesaria para restablecer el flujo
sanguíneo. Esto puede incluir técnicas como angioplastia, colocación de stent o bypass vascular
(3).
Técnicas de reconstrucción: Cirugía plástica
En cuanto a la cirugía plástica, existen diversas técnicas como injertos, colgajos y dermis
artificial, que son útiles para la cobertura de úlceras en pacientes con pie diabético. La
reconstrucción de la extremidad inferior distal es un reto quirúrgico, especialmente en aquellos
casos que presentan alto riesgo de complicaciones como diabetes o vasculopatía avanzada. Se han
descrito varios tipos de colgajos locales y regionales, como el colgajo sural o el extensor de
los dedos. Sin embargo, el principal problema reside en la falta de fiabilidad de su
vascularización, especialmente en pacientes que ya presentan vasculopatía de base o pérdida de
calidad del tejido debido a patologías crónicas o por el elevado grosor del colgajo, lo que crea
defectos de contorno (57).
RECOMENDACIONES FINALES SOBRE EL DIAGNÓSTICO DEL PIE DIABÉTICO
- El diagnóstico de infección del pie diabético se hará fundamentalmente con criterios clínicos.
- Un hueso visible con test óseo positivo es altamente sugestivo de osteítis/osteomielitis.
- Es muy importante limpiar y desbridar antes de cultivar.
- La biopsia es el procedimiento más rentable desde un punto de vista microbiológico.
- Para el tratamiento ambulatorio, utilizar antibiótico con buena biodisponibilidad oral y buena distribución compartimental.
- Se recomienda una ventana antibiótica en caso de una mala evolución o recidiva (en ningún caso tratar a medida que vamos seleccionando microorganismos).
- La documentación microbiológica de las infecciones del pie diabético es de gran ayuda para la prescripción antibiótica, siempre acompañada de la información clínica (especialmente aspecto y evolución).
- El laboratorio de Microbiología debe conocer e informar y detectar los patrones de resistencia bacteriana locales.
- La tinción de Gram como prueba rápida aporta una valiosa información. La cuantificación de los cultivos no ha demostrado un valor añadido.
- El tratamiento de las infecciones del pie diabético debe incluir antibióticos empíricos que cubran Staphylococcus aureus (SSA, MRSA, CA-MRSA) y Streptococcus spp.
- Es esencial limpiar y desbridar la herida antes de tomar muestras para cultivo microbiológico.
- Utilizar antibióticos con buena biodisponibilidad oral y adecuada distribución compartimental para el tratamiento ambulatorio.
- En caso de mala evolución o recidiva, se recomienda una ventana antibiótica en lugar de ajustar el tratamiento continuamente.
- Seleccionar productos para el tratamiento tópico de acuerdo con la profundidad, extensión, presencia de infección o tejido necrótico y grado de exudación de la úlcera.
- Implementar sistemas de descarga, como fieltro adhesivo, vendas de poliuretano y ortesis funcionales, para reducir la presión sobre las zonas afectadas.
- Utilizar soportes plantares para prevenir la recidiva de úlceras una vez curadas y corregir áreas de hiperpresión.
- Realizar desbridamiento quirúrgico para eliminar tejido muerto o infectado y promover la curación, permitiendo la recogida de muestras para cultivo microbiológico.
- Considerar la realización de exostectomías parciales o completas para permitir el cierre cutáneo y prevenir recidivas.
- Emplear artrodesis para fusionar articulaciones en casos de inestabilidad o deformidades graves, utilizando fijación interna o externa según sea necesario.
Todo paciente con diagnóstico de pie diabético debe recibir tratamiento a través de un equipo multidisciplinar (7-9,58). Es fundamental coordinar las diferentes especialidades con un objetivo común y establecer un nexo de unión entre todos los especialistas. El "Sistema para la Evaluación y Tratamiento del Pie Diabético" agrupa en un solo documento todas las variables necesarias para el manejo adecuado de estos pacientes. Este sistema puede ser utilizado en cualquier ámbito de trabajo, desde atención primaria y unidades de pie diabético hasta hospitales y servicios de urgencias. Su implementación simplifica el manejo multidisciplinar, facilita la colaboración entre profesionales y contribuye significativamente a la reducción del número de amputaciones. Los resultados obtenidos durante más de 20 años respaldan su eficacia y utilidad en la práctica clínica.
Contribuciones de Autoría:
JVJ, JLL, MNP, MSL, MLV, FJMC, XMA, MSG, CRH, CCL, RPA y ARB participaron en la
conceptualización, curación de datos, análisis formal, investigación, metodología,
administración del proyecto, visualización, redacción del borrador original, supervisión,
validación y redacción, revisión y edición. Todos los autores aprobaron la versión final a
publicar.
Financiamiento:
Autofinanciado
Declaración de conflictos de intereses:
Los autores declaran no tener conflicto de interés.
Recibido:
5 de enero del 2024
Aprobado:
29 de abril del 2024
Correspondencia:
Jordi Viadé Julià
Dirección:
C/ Lacy 184. 08202. Sabadell. Barcelona.
Teléfono:
+34 630403613
Correo electrónico:
jviadej@gmail.com
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/1.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.