ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2024 - Universidad Ricardo Palma10.25176/RFMH.v24i3.6538
EFECTO DE LA AVERRHOA CARAMBOLA L. EN LA PIEL EN UN MODELO ANIMAL DE CICATRIZACIÓN HIPERTRÓFICA
EFFECT OF AVERRHOA CARAMBOLA L. ON THE SKIN IN AN ANIMAL MODEL OF HYPERTROPHIC SCARRING
Alberto Córdova-Aguilar
 1,a,d,f
1,a,d,f
Elydia Mujica-Albán
 1,b,d,h
1,b,d,h
José Manuel Ortiz-Sánchez
 1,a,d,g
1,a,d,g
Silvia Suárez-Cunza
 2,c,j
2,c,j
Rodrigo Iglesias-Bustamante
 3,i
3,i
Daniel José Blanco-Victorio
 4,e,k
4,e,k
1 Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima-Perú.
2 Facultad de Farmacia y Bioquímica, Universidad Nacional Mayor de San Marcos, Lima-Perú.
3 Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima-Perú.
4 Facultad de Ciencias e Ingeniería, Universidad Peruana Cayetano Heredia, Lima-Perú.
a Doctor en Medicina.
b Doctor en Ciencias con mención en Fisiología.
c Doctor en Farmacia y Bioquímica.
d Magíster en Fisiología.
e Maestro en Gerencia en Salud y Especialista en Investigación.
f Médico Cirujano especialista en Cirugía Plástica.
g Médico Cirujano especialista en Anatomía Patológica y Patología Clínica.
h Biólogo.
i Médico Veterinario.
j Químico Farmacéutico.
k Cirujano Dentista.
Alberto Córdova-Aguilar: acordovaa@unmsm.edu.pe
Elydia Mujica-Albán: emujicaa@unmsm.edu.pe
José Manuel Ortiz-Sánchez: jortizs@unmsm.edu.pe
Silvia Suárez-Cunza: ssuarezc@unmsm.edu.pe
Rodrigo Iglesias-Bustamante: rodibusp10@gmail.com
Daniel José Blanco-Victorio: daniel.blanco.v@upch.pe
RESUMEN
Introducción: La cicatrización hipertrófica en la piel representa un grave problema de salud
pública mundial, pues afecta física y emocionalmente a las personas que la padecen. Esto hace necesario
investigar nuevas alternativas para su prevención y tratamiento. El objetivo del estudio fue comparar el
efecto de la Averrhoa Carambola L. (carambola) en la piel bajo un modelo animal de cicatrización
hipertrófica.
Métodos: Estudio experimental; se utilizó 10 conejos machos de raza Nueva Zelanda, entre 3 y 4
meses de edad, con un peso promedio de 3 a 3.5Kg. Se indujo la formación de cicatrices hipertróficas en
las orejas de los conejos bajo el modelo descrito por Morris y col. A un grupo de heridas se administró
1mL de solución acuosa del liofilizado del fruto de la carambola al 10%, mientras que al otro grupo de
heridas se administró 1mL del acetónido de triamcinolona; en ambos grupos la aplicación fue intralesional,
semanal y por un mes consecutivo. Finalizado el tratamiento, bajo sedación se extrajeron solo las
cicatrices hipertróficas utilizando un punzón de biopsia y los tejidos fueron conservados en formol al
10% para el examen anatomopatológico posterior.
Resultados: El grupo que recibió la solución de carambola al 10% mejoró significativamente la
dermis y la epidermis en las cicatrices hipertróficas de las orejas de conejos que recibieron
tratamiento. Al compararla con el grupo que recibió el acetónido de triamcinolona, no hubo diferencias
estadísticamente significativas.
Conclusión: El extracto acuoso liofilizado de carambola al 10% demostró un efecto similar al
acetónido de triamcinolona (tratamiento de elección) en la reducción de la fibrosis de las cicatrices
hipertróficas en las orejas de los conejos.
Palabras clave: Averrhoa Carambola L.; triamcinolona; cicatriz hipertrófica; modelos animales.
(Fuente: DeCS/BIREME)
ABSTRACT
Introduction: Hypertrophic scarring in the skin represents a serious global public health
problem, as it physically and emotionally affects people who suffer from it. This makes it necessary to
investigate new alternatives for its prevention and treatment. The objective of the study was to compare
the effect of Averrhoa Carambola L. (star fruit) on the skin under an animal model of hypertrophic
healing.
Methods: Experimental study; 10 male New Zealand breed rabbits were used, between 3 and 4 months
old, with an average weight of 3 to 3.5Kg. The formation of hypertrophic scars in the ears of rabbits was
induced under the model described by Morris et al. One of the groups received 1 mL of a 10% aqueous
solution of the lyophilized star fruit, while the other received 1 mL of triamcinolone acetonide; in both
groups the application was intralesional and weekly in a month. After the treatment, under sedation,
only the hypertrophic scars were extracted using a biopsy punch and the tissues were preserved in 10%
formalin for subsequent pathological examination.
Results: The group that received star fruit solution significantly improved the dermis and
epidermis in the hypertrophic scars on the ears of rabbits that received treatment. When compared with
the group that received triamcinolone acetonide, there were no statistically significant differences.
Conclusion: The lyophilized aqueous extract of star fruit at 10% demonstrated a similar effect
compare to triamcinolone acetonide (treatment of choice) in reducing the fibrosis of hypertrophic scars
in the ears of rabbits.
Keywords: Averrhoa Carambola L., triamcinolone, hypertrophic scar, animal models. (MeSH/NLM)
INTRODUCCIÓN
La cicatrización hipertrófica en la piel es producto del depósito excesivo de colágeno sobre una cicatriz y puede crear graves problemas funcionales y estéticos en quienes la padecen, como: la limitación del movimiento, el dolor, el prurito y la inflamación crónica de la zona afectada. Este tipo de cicatrización constituye un problema común en los seres humanos, especialmente, en pacientes posoperados y posquemaduras profundas. En países industrializados, anualmente alrededor de 100 millones de personas desarrollan cicatrices excesivas en la piel o problemas relacionados con éstas. Tal es el problema, que el mercado de fármacos anticicatrices supera los 12 billones de dólares estadounidenses al año(1,2).
La cicatrización fisiológica en la piel es un proceso de reparación tisular que involucra tres fases (inflamación, proliferación y remodelación) y dura un año. Al parecer, si la fase inflamatoria se prolonga o es excesiva se genera una cicatriz hipertrófica, la cual se caracteriza histológicamente por el aumento de los fibroblastos, la matriz extracelular y la neoangiogénesis(3,4,5).
El desconocimiento en la patogenia conlleva actualmente al uso de diversas terapias inespecíficas, como el acetónido de triamcinolona. Este corticoide sintético aplicado intralesionalmente se ha convertido en la primera elección para el tratamiento de las cicatrices hipertróficas, aunque puede producir un efecto rebote, la hipopigmentación, y la atrofia de piel y grasa subyacente(1,6,7).
Pese a que la cicatrización hipertrófica en la piel es un problema casi exclusivo de los humanos, la epitelización tardía en heridas de la piel ventral en orejas de conejos produce cicatrices hipertróficas similares a las humanas(8,9). Esto permite utilizar este modelo animal para el estudio de la cicatrización hipertrófica.
El Perú cuenta con una megadiversidad de plantas medicinales que pueden ser usadas como potenciales fitofármacos. Una de estas plantas es la Averrhoa carambola L., se cultiva especialmente en la Amazonía y su fruto es popular como hidratante. En la medicina tradicional se usa principalmente como hipoglucemiante, antihipertensivo, antitusígeno y antiemético(10)
Esta planta, en diversos extractos a diferentes concentraciones y vías de administración demostraron actividad antiinflamatoria y antioxidante produciendo efectos nefroprotector, cardioprotector y hepatoprotector en animales de experimentación, aunque se desconoce el principio activo de dicha actividad biológica(11-15). Actualmente, no hay estudios del efecto antiinflamatorio del fruto de la Averrhoa carambola L. en las cicatrices hipertróficas en orejas de conejos. Por lo expuesto, el objetivo de esta investigación fue comparar los efectos de la Averrhoa carambola L. frente al acetónido de triamcinolona en cicatrices hipertróficas inducidas en orejas de conejos.
MÉTODOS
Tipo, diseño y área del estudio
La investigación fue de tipo básica, bajo un diseño experimental preclínico en el área de fisiología experimental.
Población, muestraLa muestra estuvo conformada por 40 cicatrices hipertróficas en orejas de conejos raza Nueva Zelanda. Se utilizaron 10 conejos machos, entre 3 y 4 meses de edad, con un peso promedio de 3 a 3.5Kg, procedentes del Instituto Nacional de Salud (Chorrillos, Lima, Perú).
Diseño experimental y procedimientosDadas las restricciones establecidas en la pandemia por la covid-19, se adecuó un bioterio temporal en Chorrillos considerando el espacio, la ventilación y la temperatura. Los conejos fueron mantenidos en jaulas individuales a 24 °C y 60% de humedad, con ciclos de luz/oscuridad de 12h, recibiendo acceso libre al agua y alimento. Este último, fue adquirido de la Universidad Nacional Agraria La Molina y el cuidado de los animales estuvo a cargo de un médico veterinario.
El liofilizado de Averrhoa Carambola L. fue obtenido de la empresa NutriCargo® y fue reconstituido al 10% en el laboratorio del Instituto de Investigación de Bioquímica y Nutrición “Alberto Guzmán Barrón” (Facultad de Medicina – UNMSM).
El modelo de cicatrización hipertrófica en orejas de conejos se realizó según lo descrito por Morris y col.(16). Se indujeron 40 cicatrices hipertróficas en la piel ventral de las orejas de los animales de experimentación mediante heridas creadas con un punzon de biopsia de 6mm diámetro que se dejaron libres por 8 semanas. Una vez formadas las cicatrices hipertróficas, se escogieron al azar 20 de ellas (2 heridas por oreja) para recibir 1mg tratamiento semanal A o B de manera intralesional por 4 semanas consecutivas (Figura 1). A las cicatrices hipertróficas de las orejas izquierdas se les administró el tratamiento A, acetónido de triamcinolona (Triamcicort®) y a las de las orejas derechas se les administró el tratamiento B, extracto acuoso liofilizado de Averrhoa Carambola L. (Nutricargo®). A los 90 días del ensayo, bajo sedación se extrajeron solo las cicatrices hipertróficas utilizando un punzon de biopsia de 7mm y los tejidos fueron conservados en formol al 10% para la posterior tinción con hematoxilina-eosina.
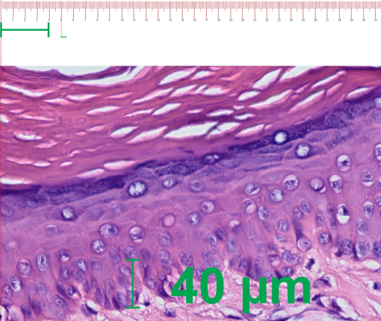
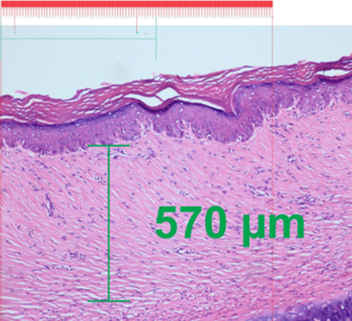
Con el uso de un microscopio óptico Olympus BX53F® se tomaron microfotografías de la dermis papilar y reticular de las cicatrices hipertróficas. Se midió la distancia entre la cresta y la papila a 40X en la dermis papilar y el espesor total de la dermis reticular a 10X (Figura 2). La medición del espesor de la dermis en las microfotografías se realizó bajo una escala (en µm) con el programa CorelDRAW 2020®.
Figura 1: Tratamiento aplicado en las orejas de los conejos.
Figura 2: Ejemplo de medición en la dermis papilar (izquierda) y dermis reticular (derecha) en programa CorelDRAW 2020®.
Análisis estadístico
Los datos obtenidos se registraron en una ficha de datos y fueron importados a una hoja de cálculo de Microsoft Excel 2021® para posteriormente ser tabulados y analizados con el programa estadístico Stata® v17.0. Se procesaron los datos mediante el uso de la estadística descriptiva e inferencial. Las variables numéricas fueron analizadas con las medidas de tendencia central y dispersión. Se compararon las medianas de ambos grupos mediante la prueba no paramétrica de Wilcoxon. La elaboración del informe final se realizó en el programa Microsoft Word 2021®.
Aspectos éticosEsta investigación fue aprobada por la Unidad de Posgrado de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos (Dictamen N° 000374-2021-UPG-VDIP-FM/UNMSM). El estudio respetó los principios éticos internacionales para la investigación con animales de laboratorio y se basó en las 3R´s: refinamiento, reducción y reemplazo. Asimismo, se siguieron los lineamientos del Consejo de Organizaciones Internacionales de las Ciencias Médicas, como los señalados en la guía para el cuidado y uso de animales de laboratorio(17).
ResultadosLa media encontrada en la cicatriz hipertrófica (dermis papilar: distancia cresta - papila) del grupo que recibió la Averrhoa carambola L. fue 32.3 µm (±17.21) y en el grupo que recibió el acetónido de triamcinolona fue 22.05 µm (±20.15). Al evaluar con la prueba de Wilcoxon no se encontraron diferencias estadísticamente significativas (Tabla 1).
|
Grupo |
Media/strong> |
DE |
Mediana |
RIC |
Mín |
Máx |
n |
p |
|---|---|---|---|---|---|---|---|---|
| Carambola | 32.3 | 17.21 | 31.50 | 21 | 8 | 57 | 10 | 0.414* |
| Triamcinolona | 22.05 | 20.15 | 20.75 | 38 | 0 | 60 | 10 |
*Prueba de Wilcoxon, Z=-0.868, p>0.05 no significativo
La media encontrada en la cicatriz hipertrófica (dermis reticular) del grupo que recibió la Averrhoa carambola L. fue 291.60 µm (±61.56) y en el grupo que recibió el acetónido de triamcinolona fue 292.40 µm (±78.83). Al evaluar con la prueba de Wilcoxon, no se encontraron diferencias estadísticamente significativas (Tabla 2).
|
Grupo |
Media/strong> |
DE |
Mediana |
RIC |
Mín |
Máx |
n |
p |
|---|---|---|---|---|---|---|---|---|
| Carambola | 291.60 | 61.56 | 262.5 | 99 | 228 | 395 | 10 | 0.941* |
| Triamcinolona | 292.40 | 78.83 | 324 | 114 | 168 | 400 | 10 |
*Prueba de Wilcoxon, Z= -0.102, p>0.05 no significativo
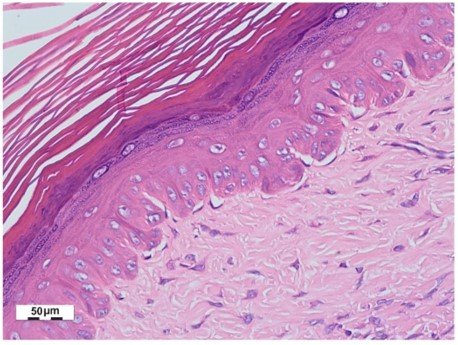
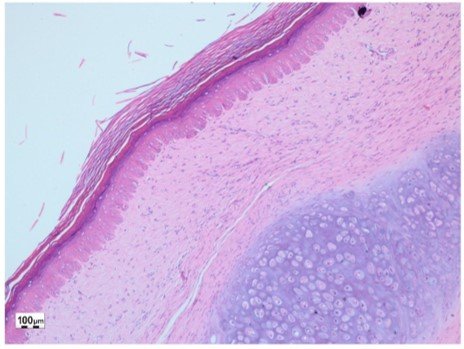
El efecto que tuvo el extracto acuoso liofilizado de Averrhoa carambola al 10% en la cicatriz hipertrófica, tras 1 mes de tratamiento semanal, se muestra en las figura 3 y 4. Se observa el aumento de la dermis papilar (mayor distancia cresta-papila) en la figura 3 y la disminución del espesor de la dermis reticular (menor distancia dermis papilar a hipodermis) en la figura 4.
Figura 4: Cicatriz hipertrófica postratamiento con Averrhoa carambola L., hematoxilina-eosina (40X).
Figura 5: Cicatriz hipertrófica postratamiento con Averrhoa Carambola L., hematoxilina-eosina (10X).
DISCUSIÓN
La cicatrización hipertrófica en la piel afecta a todas las heridas que llegan hasta la dermis reticular. Pese a que la etiología de las cicatrices hipertróficas es múltiple, diversos factores apuntan a la inflamación crónica por los radicales libres como su principal causa. En ese sentido, el estudio de los compuestos derivados de las plantas con potencial antiinflamatorio y antioxidante, como la Averrhoa carambola L. (carambola), permitiría ofrecer nuevos tratamientos (10-14,18-22).
Los datos obtenidos demuestran que tanto la Averrhoa carambola L. (carambola) como el acetónido de triamcinolona mejoraron la cicatrización, en un modelo de cicatriz hipertrófica en orejas de conejos. Este hallazgo es similar a otros estudios que obtuvieron una mejoría en la cicatrización hipertrófica como la crema de simvastatina al 10 %, el kiwi, el apremilast, el asiaticósido, el ácido úsnico, la toxina botulínica tipo A y el dimetilsulfóxido (23-29).
Al comparar las medianas obtenidas de la distancia cresta-papila en la dermis papilar no se encontraron diferencias estadísticamente significativas entre el grupo que recibió la Averrhoa carambola L. y el grupo que recibió el acetónido de triamcinolona. Asimismo, al comparar las medianas obtenidas del espesor total en la dermis reticular de ambos grupos, no se encontraron diferencias estadísticamente significativas. Este resultado es relevante pues demuestra que la Averrhoa carambola L. tuvo efectos positivos en el tratamiento de las cicatrices hipertróficas en las orejas de los conejos.
La dermis papilar al ser la capa más superficial de la dermis está en contacto directo con la epidermis y contiene una gran cantidad de vasos sanguíneos, nervios y células madre dérmicas que pueden diferenciarse en diversos tipos de células de la piel, incluyendo fibroblastos -que producen colágeno- y otros componentes de la matriz extracelular. Esto la convierte en una región importante para la reparación y regeneración de la piel. Asimismo, la dermis reticular al ser la capa más profunda de la dermis proporciona la estructura y la fuerza a la piel, aunque su capacidad de regeneración es limitada en comparación con la dermis papilar (1-2).
Al analizar específicamente los resultados de ambos tratamientos, se observó que la Averrhoa carambola L. (carambola) tuvo un mejor efecto sobre la dermis papilar respecto al acetónido de triamcinolona que tuvo un mejor efecto sobre la dermis reticular. Este efecto importante de la Averrhoa carambola L. (carambola) sobre la dermis papilar, parece ser debido a la gran actividad antioxidante de la planta dado su alto contenido de vitamina C, polifenoles y flavonoides. Estos resultados positivos se dieron con un extracto acuoso a partir de un producto comercial lioflizado de Averrhoa carambola L. (NutriCargo®), lo que reforzaría la idea que los materiales liofilizados mantienen las propiedades organolépticas.
De forma opuesta, el acetónido de triamcinolona tuvo un mejor efecto sobre la dermis reticular. Esto probablemente se deba a su gran actividad antiproliferativa, producto de la inhibición de la fosfolipasa A2 y la consecuente inhibición de la cascada inflamatoria. Es probable que pueda reducir la expresión de genes que codifican citocinas proinflamatorias y moléculas de adhesión, lo que disminuye la infiltración de células inflamatorias en el sitio de la inflamación. La dermis reticular tiene fibras de colágeno más gruesas y rígidas. Diversos estudios han demostrado que el acetónido de triamcinolona reduce la actividad de los fibroblastos, por ende, la síntesis de colágeno y otros componentes de la matriz extracelular, lo que disminuye la cantidad y la rigidez de las fibras de colágeno en la cicatriz . También se ha demostrado que el acetónido de triamcinolona inhibe la formación de nuevos vasos sanguíneos -neoangiogénesis- en la cicatriz hipertrófica, lo que reduce la inflamación y el enrojecimiento de la cicatriz (7,8,30).
Si bien los antecedentes señalan que la Averrhoa carambola L. (carambola) tiene actividad antiinflamatoria y antioxidante, parece que su mayor efecto sería este último.
La principal fortaleza del estudio radica en ser la primera investigación en el país -hasta donde se revisó- que utilizó la Averrhoa carambola L. (carambola) para el tratamiento de cicatrices hipertróficas en orejas de conejos. Asimismo, la principal limitación del estudio fue la pandemia por la covid-19. Ya que, se tuvo que implementar un bioterio temporal para el cuidado de los animales de experimentación y trabajar con el liofilizado de un producto comercial.
Finalmente, si bien los resultados no pueden ser directamente extrapolados a los humanos, abre un camino promisorio para seguir indagando en las bondades de este potencial fitofármaco y sus efectos benéficos en la cicatrización patológica.
Conflictos de intereses: Los autores declaran no tener conflictos de interés.
Contribuciones de autoría: Los autores participaron en la génesis de la idea, diseño
de proyecto, recolección e interpretación de datos, análisis de resultados y preparación del
manuscrito del presente trabajo de investigación.
Financiamiento: Autofinanciado.
Recibido: 02 de abril del 2024
Aprobado: 28 de junio del 2024
Correspondencia: Alberto Córdova-Aguilar
Dirección: Jr. Paseo del Prado 133 – Urb. Las Lomas, La Molina. Lima, Perú.
Teléfono: (511) 999 779 789
Correo: acordovaa@unmsm.edu.pe
Correspondencia: Pedro Aro
Dirección: Av. Honorio Delgado 430, San Martín de Porres. Lima, Perú.
Teléfono: (01) 319-0000 - 980815956
Correo electrónico: pedro.aro.g@upch.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/4.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.