CASO CLÍNICO
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2024 - Universidad Ricardo Palma10.25176/RFMH.v24i3.6605
SARCOMA DE KAPOSI Y COINFECCION POR BARTONELLA EN PACIENTE VIH POSITIVO
KAPOSI SARCOMA AND BARTONELLA COINFECTION IN HIV-POSITIVE PATIENT. CASE REPORT
Roger Antonio Sernaque Mechato
 1,a,b
1,a,b
Clariza Biminchumo Sagastegui
 1,b
1,b
Diego Alejandro Jimenez Mercado
 2,d
2,d
Jesus Dario Toledo De La Torre
 1,c
1,c
1 Hospitsal Santa Rosa. Lima, Perú.
2 Instituto de investigaciones en ciencias biomédicas. Universidad Ricardo Palma, Lima, Perú.
a Medicina interna.
b Infectología.
c Médico residente gastroenterología.
d Médico Cirujano.
RESUMEN
Introducción: El Sarcoma de Kaposi es una neoplasia maligna multifocal de células endoteliales.
Su agente etiológico es el HHV-8 y constituye una de las patologías definitorias de SIDA. Representa
aproximadamente el 12% de los cánceres diagnosticados en personas que viven con VIH. La angiomatosis
bacilar (AB) es una enfermedad infecciosa poco frecuente, causada por bacterias del género Bartonella
spp. transmitidas por vectores como pulgas, piojos y mosquitos. En pacientes con infección por el virus
de inmunodeficiencia humana (VIH) con recuento de LT CD4 + <100 cél/µL se asocia a lesiones
angiomatosas con neovascularización que comprometen la piel y, en menor medida, mucosas, hígado, bazo y
huesos.
Caso clínico: Paciente varón de 48 años con antecedente de VIH en TARGA hace 15 años, que ingresa
por consulta externa de infectología debido a lesiones nodulares violáceas en MMII derecho, izquierdo,
parpado superior izquierdo y orofaringe. Durante hospitalización se obtiene hemocultivo positivo para
Bartonella y resultado de biopsia de lesión de miembro inferior que concluye Sarcoma de Kaposi. Se
indica endoscopia digestiva alta y tomografía de tórax y abdomen que evidencian compromiso visceral y
sistémico. Se realiza genotipo VIH resultando resistencia a antirretrovirales por lo que se rota
medicamentos y se inicia quimioterapia presentando buena respuesta y mejoría.
Conclusión: El Sarcoma de Kaposi relacionado al VIH afecta a pacientes con SIDA de una forma
mucho más severa, agresiva y fulminante en comparación con otros grupos de pacientes inmodeficientes.
Sin embargo, al presentar lesiones características, debemos tener en cuenta su principal diagnóstico
diferencial: Angiomatosis Bacilar, que incluso, de manera muy poco común, pueden presentarse en
simultáneo.
Palabras clave: Sarcoma de Kaposi, VIH, SIDA, Angiomatosis bacilar. (fuente: DeCS-BIREME)
ABSTRACT
Introduction: Kaposi's sarcoma is a multifocal malignant neoplasm of endothelial cells, its
etiological agent is HHV-8 and it constitutes one of the defining pathologies of AIDS. It represents
approximately 12% of cancers diagnosed in people living with HIV. Bacillary angiomatosis (AB) is a rare
infectious disease caused by bacteria of the genus Bartonella spp., transmitted by vectors such as
fleas, lice, and mosquitoes. In patients with human immunodeficiency virus (HIV) infection with a CD4+
T-cell count <100 cells/µL, it is associated with angiomatous lesions with neovascularization that
involve the skin and, to a lesser extent, mucous membranes, liver, spleen, and bones.
Clinical case: the case of a 48-year-old male patient with a history of HIV on HAART for 15
years, who was admitted for an outpatient infectious disease clinic due to violaceous nodular lesions in
the right and left MMII, upper eyelid. left and oropharynx. During hospitalization, a blood culture
report was obtained that was positive for Bartonella and a biopsy result of a lower limb lesion
concluded that Kaposi's Sarcoma was present. Upper gastrointestinal endoscopy and chest and abdominal
tomography were performed, which showed the visceral and systemic involvement of Kaposi's Sarcoma. The
HIV genotype is performed, resulting in resistance to antiretrovirals, so the medication is changed and
chemotherapy is started, with the patient showing a good response and improvement.
Conclusion: HIV-related Kaposi's Sarcoma affects AIDS patients in a much more severe,
aggressive, and fulminant manner compared to other immunodeficient groups. However, when presenting
characteristic lesions, we must consider its main differential diagnosis: Bacillary Angiomatosis, which,
even very uncommonly, may occur simultaneously.
Keywords: Kaposi sarcoma, HIV, AIDS, Bacillary angiomatosis. (source: MeSH NLM)
INTRODUCCIÓN
Sin tratamiento, la infección por VIH causa canceres propios del SIDA como el Linfoma No Hodgkin, Cáncer
de cuello uterino y Sarcoma de Kaposi (1, 2).
El Sarcoma de Kaposi representa aproximadamente el 12% de los canceres diagnosticados en personas que
viven con VIH. (3) La seroprevalencia varía geográficamente entre
continentes, siendo más alta en regiones como África y América Latina y menos prevalente en Europa y
Norteamérica (4). Asimismo, presenta una alta prevalencia entre los hombres
que tienen sexo con hombres (HSH), particularmente en aquellos con coinfección por VIH. Es una neoplasia
maligna multifocal de células endoteliales descrita por primera vez en 1872 por Moritz Kaposi. El riesgo
de presentarse en esta población es 500 vece mayor (4).
Se han descrito cuatro tipos de Sarcoma de Kaposi con características epidemiológicas y clínicas
distintas (1); el clásico, endémico, iatrogénico y el epidémico que ocurre
en contexto del VIH. Ha estado universalmente asociado con la infección por HHV- 8, se considera la
presencia de este como factor primario y necesario para su desarrollo (5).
La pregunta de, si es qué el sarcoma de Kaposi es una neoplasia clonal, proceso oligoclonal, o
proliferación vascular multifocal, aún no se ha resuelto por completo. Estudios recientes son
consistentes con que el Sarcoma de Kaposi es una enfermedad multifocal en que las lesiones individuales
surgen por separado en lugar de por metástasis. Sin embargo, se necesitan investigaciones adicionales.
Cualquiera que sea la resolución, desde una perspectiva clínica, el Sarcoma de Kaposi asociado al VIH
actúa como otros procesos neoplásicos con invasión de varios órganos y el resultado devastador si no se
trata (6).
Clínicamente el sarcoma de Kaposi se presenta con lesiones cutáneas maculares asintomáticas violáceas
rosadas o rojas que pueden converger para formar placas y nódulos de color azul violáceo o negro que con
frecuencia se asocian con edema en extremidades inferiores (7). Los
pacientes pueden desarrollar un edema leñoso que puede persistir incluso después del tratamiento y el
edema de larga data puede conducir a infecciones recurrentes de la piel y problemas de movilidad
(6). Estas lesiones cutáneas a menudo se diseminan. En casos graves las
lesiones pueden presentarse en cavidad oral como lesiones nodulares, ganglios linfáticos o cualquier
órgano visceral, más comúnmente el tracto gastrointestinal o el sistema pulmonar. En algunos casos se
observan lesiones óseas en imágenes que pueden ser intermitentemente sintomáticas.
Para los pacientes con síntomas respiratorios o gastrointestinales, la broncoscopia o la endoscopia
pueden ser beneficiosas para visualizar las lesiones y realizar la estadificación de la enfermedad. La
tomografía computarizada es útil para mostrar el sarcoma de Kaposi visceral y determinar el estadio de
la enfermedad. Se deben obtener biopsias de la piel o del sistema gastrointestinal para confirmar el
diagnóstico, pero no se recomienda la biopsia de las vías respiratorias. Las características
diagnósticas del sarcoma de Kaposi en la biopsia incluyen la presencia de marcadores endoteliales,
células de huso y tinción positiva de antígenos nucleares asociados a la latencia del HHV-8 en la
inmunohistoquímica(6).
El sarcoma de Kaposi y la angiomatosis bacilar son los principales diagnósticos diferenciales en
pacientes con VIH y recuento bajo de linfocitos CD4. Ambas enfermedades presentan manifestaciones
cutáneas similares, lo que las hace clínicamente indistinguibles (8). La
especie responsable puede sospecharse según los factores de riesgo epidemiológico y la predilección por
algún órgano. La infección por Bartonella Quintana se encuentra en pacientes con bajo nivel
socioeconómico, alcoholismo crónico y pediculosis corporal, y sus manifestaciones clínicas se asocian
con angiomatosis bacilar, compromiso óseo y subcutáneo. Por otro lado, Bartonella Henselae, asociada a
mordeduras o rasguños de gatos y picaduras de pulgas, causa principalmente enfermedad de arañazo de gato
(EAG) con linfoadenopatías regionales y compromiso extra-ganglionar, principalmente relacionado con
peliosis hepática. Histopatológicamente, ambas enfermedades se caracterizan por lesiones vasculares
proliferativas que se manifiestan como pequeñas pápulas que pueden evolucionar a nódulos friables, rojo
violáceos, con variadas formas como nodulares, pedunculares o verrugosas(8).
Es infrecuente la presencia de coinfección y mucho menos aún los procesos patológicos duales o múltiples
en piel, sin embargo, pueden existir (9).
CASO CLINICO
Se presenta el caso de un paciente varón de 48 años proveniente de Tumbes con antecedente de VIH en
tratamiento con TARGA con Tenofovir, Lamivudina y Efavirenz desde el 2009, Neumocistosis en el 2009,
VHB, psoriasis, HTA y apendicectomizado. Refiere tiempo de enfermedad de 13 meses aproximadamente cuando
presento lesión única tipo placa puntiforme oscura y pruriginosa de 1 cm en MMII derecho que evoluciono
a lesiones en ambos miembros inferiores. Siete días antes del inicio de las lesiones presento picadura
en región supracondílea de MMII derecho que refiere haberse “infectado”, razón por la cual acudió a
Hospital de Tumbes donde recibió tratamiento antibiótico. Ocho meses después presento lesiones tipo
placas violáceas oscuras no pruriginosas de bordes irregulares de 3cm en dorso de pie derecho que
progresaron a lesiones nodulares. Cuatro meses antes del ingreso a nuestro nosocomio, evidenció las
mismas lesiones en ingle y cuerpo del pene adyacente al prepucio. A las pocas semanas nota aumento de
volumen y eritema pruriginoso en párpado superior izquierdo que progreso a lesión nodular violácea de
1cm aproximadamente y sensación de cuerpo extraño de crecimiento progresivo en orofaringe.
Posteriormente presenta escalofríos con picos febriles no cuantificados asociado a tos y congestión
nasal que progresa a disnea motivo por el cual acude a emergencia donde posterior a evaluación y
tratamiento sugieren evaluación por Infectología quienes solicitan evaluación por oncología y exámenes
para descartar infección por bartonella. Infectología evalúa con Informe verbal de hemocultivo que
indican Bartonelosis y sugieren hospitalización para manejo de la infección.
Examen físico de ingreso: Funciones vitales: PA 100/70, FC 88 x´, FR 16x´, T 36,5 ºC, SatO2 98 %, Cabeza
y cuello: Normocéfalo, cuello cilíndrico. Piel y faneras: tibia, elástica, llenado capilar 2 segundos,
adenopatías blandas no dolorosa en región maxilofacial. Nódulos violáceos de bordes definidos y
consistencia semiblanda en ingle, glúteo derecho. Tórax y pulmones: Ruidos cardiacos rítmicos de buena
intensidad, no soplos, murmullo vesicular pasa bien en ambos campos pulmonares, no ruidos agregados.
Abdomen Globoso, RHA (+) blando, depresible, no doloroso a la palpación. Neurológico: LOTEP, Escala de
Glagow:15 puntos, no signos meníngeos.
En la región plantar (Figura 1) se aprecian nódulos hiperpigmentados de bordes definidos de consistencia
dura descamativo distribuido en región plantar 1/3 medio y parte del inferior en MMII I, 1/3 medio en
MMII derecho. En la región palpebral izquierda (Figura 2a) se aprecia formación multinodular
hiperpigmentada violácea semiblanda; así también se aprecia en región de orofaringe (Figura 2b) lesión
con similares características ubicada en línea media sin signos inflamatorios.
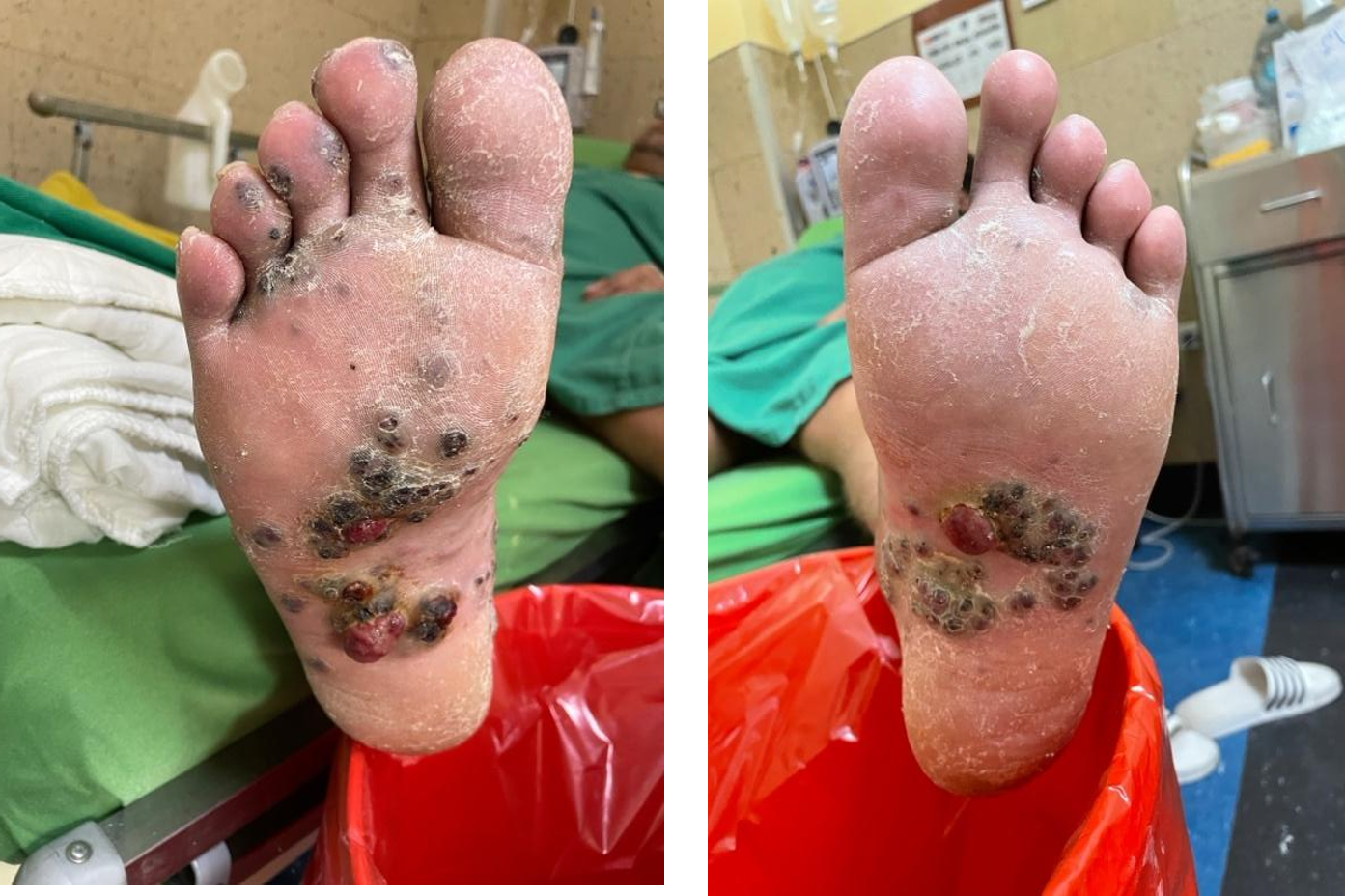
Figura 1: lesiones nodulares de color azul violáceo o negro en miembro inferior derecho e izquierdo
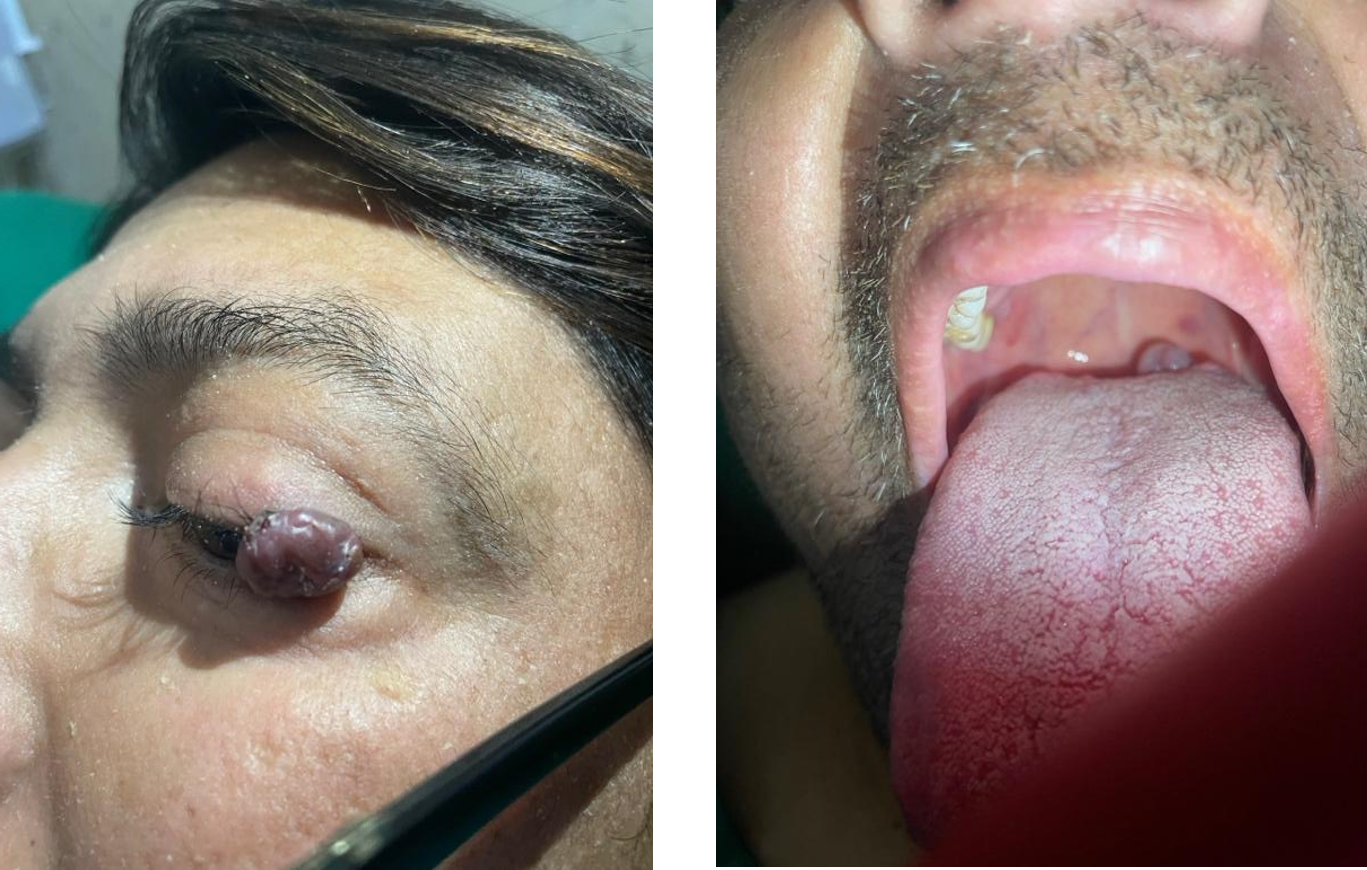
Figura 2: a) lesión multinodular purpura en parpado izquierdo. 2b) lesión multinodular purpura en cavidad oral
Exámenes de laboratorio: Leucocitos 11150, Segmentados 69, Linfocitos 22, Abastonados 0, eosinófilos 2,
Hematíes 4880000, Hb 13,9, Hematocrito 42, HCM 29, CHCM 33, VCM 87, Plaquetas 365000, Glucosa 88, Urea
45, TGO 25, TGP 37, Creatinina 0,85. Carga viral 387000. VDRL Reactivo 8 diluciones, Sífilis IgG IgM
Reactivo, Anti HBc total Reactivo. Biopsia de lesión nodular de miembro inferior que trae el paciente,
realizada en otro nosocomio un mes antes del ingreso, reporta Sarcoma de Kaposi. Borde profundo
comprometido.
Durante hospitalización se obtiene informe del Instituto de medicina Tropical que reporta en Gram de
hemocultivo formas coccobacilares positivo para Bartonella (Figura 3). Se realiza endoscopia digestiva
alta que reporta Sarcoma de Kaposi en antro gástrico y esófago, ulceras gástricas y gastritis
eritematosa antral. También se realiza TAC de abdomen y pelvis c/c que informa adenopatías
retroperitoneales de aspecto inflamatorio de hasta 10 mm de eje corto y múltiples ganglios mesentéricos
de 10-11 mm de eje corto, la mayoría con hilio graso presente. TAC de tórax c/c (Figura 4) informa
nódulos dispersos el mayor de 13x8 mm de distribución peribroncovascular en lóbulo superior izquierdo
con morfología “en flama” y otros más pequeños en ambos lóbulos superiores y bases, rodeados de halos de
vidrio esmerilado y fibroatelectasia en língula.

Figura 3: Resultado de hemocultivo
Figura 3: TAC c/c de tórax
Con base a las manifestaciones clínicas del paciente, resultados de biopsia, hemocultivo y
procedimientos realizados se concluye que el paciente presenta los siguientes diagnósticos: Sarcoma de
Kaposi sistémico o diseminado con compromiso visceral y cutáneo, Bacteriemia por Bartonella spp,
Infección por VIH Estadio SIDA con fracaso TARGA, Sífilis Latente indeterminada y Hepatitis B. Por lo
cual se indica tratamiento con Ciprofloxacina, Ceftriaxona, Azitromicina y Penicilina Benzatínica.
Dermatología solicita PCR, cultivo y serología para Bartonella quintana y Bartonella baciliformes.
Infectología sugiere evaluación por oncología para inicio de quimioterapia debido a que hay compromiso
sistémico y progresión de la enfermedad podría afectar administración de antirretrovirales la cual es
vía oral. Oncología indica que paciente es no tributario de tratamiento con quimioterapia por carga
viral, solicita CD4 y control de infecciones, por esta razón se realiza junta médica donde se concluye
continuar TARGA esquema previo hasta obtener resultados de Genotipo y alta médica para control
ambulatorio por oncología médica para inicio de quimioterapia.
Posteriormente se obtiene resultados de ELISA IgG e IgM para Enfermedad de Carrión que reporta no
reactivo e Inmunofluorescencia indirecta IgG e IgM para Bartonella hanselae negativo. No realizaron
serología ni PCR Bartonella quintana solicitada. ELISA Anti HBc total, HBeAg, Anti HBe y Anti HBs no
reactivos. Paciente cumple 16 ciclos de quimioterapia con Paclitaxel mostrando buena respuesta y
evidente mejoría.
DISCUSIÓN
En los últimos años, la epidemiologia y el pronóstico de la infección por VIH han experimentado cambios
significativos gracias al tratamiento antirretroviral para las personas infectadas, al desarrollo de
fármacos más eficaces y mejor tolerados y a medidas preventivas como la profilaxis preexposición. La
evolución de la terapia antirretroviral ahora con opciones orales simples e inyectables, también a
contribuido a la mejora del tratamiento y la atención integral del VIH. Con diagnósticos precoces e
inicio temprano de la terapia antirretroviral la esperanza de vida de las personas con VIH se ha
equiparado a la de la población general. Sin embargo, muchas personas permanecen sin diagnosticar o son
diagnosticadas tardíamente y existen grupos de población sometidos a situaciones de mayor vulnerabilidad
que afectan la salud individual y colectiva.
El sarcoma de Kaposi se considera la neoplasia asociada con más frecuencia al VIH, afectando a pacientes
con SIDA de una forma mucho más severa, agresiva y fulminante en comparación con otros grupos de
pacientes inmunodeficientes. Su diagnóstico es principalmente clínico se caracteriza por la presencia de
maculas que progresan a nódulos de color violáceo o marrón(4).
Procedimientos como la endoscopia y
tomografía son útiles para visualizar las lesiones si hay compromiso visceral, así como también para
determinar el estadio de la enfermedad, pero cuando hay duda diagnostica con angiomatosis bacilar pues
clínicamente pueden ser indistinguibles(7, 8), como ocurrió
en este caso, el uso de la biopsia que es el Gold
estándar para el diagnóstico, es de gran utilidad y permite confirmar el diagnóstico; sin dejar de tener
en cuenta que ambos cuadros pueden presentarse concomitantemente en casos muy aislados.
La aparición de cepas resistentes al tratamiento antirretroviral puede depender de diferentes factores
tanto del hospedero como del virus(6). La no adherencia al tratamiento es la
principal causa de falla
virológica y ha sido fuertemente asociada con la aparición de mutaciones de resistencia específicas para
las diferentes clases de medicamentos(8). En nuestro caso clínico
presentado, se observa que el paciente
había estado en tratamiento con TARGA (Terapia Antirretroviral Altamente Activa) desde el año 2009, lo
que indica que ha estado recibiendo tratamiento para su infección por VIH durante un período
prolongado(10).
Sin embargo, se identificó que el paciente tenía un alto nivel de resistencia al Efavirenz, uno de los
medicamentos utilizados en su régimen de TARGA anterior. El cambio a un nuevo esquema de tratamiento con
Tenofovir, Lamivudina y Dolutegravir parece haber sido efectivo, ya que dos meses después de iniciado,
el paciente mostró una carga viral indetectable
La reducción de la inmunosupresión puede causar la remision del Sarcoma de Kaposi, lo que pone de
relieve el papel fundamental de la respuesta inmunitaria en esta infección. Del mismo modo el Sarcoma de
Kaposi epidémico o relacionado al VIH suele responder a la estimulación de la respuesta inmunitaria con
TAR(9). El sarcoma de Kaposi epidémico suele ser agresivo y afecta en
especial la piel, el aparato
digestivo y el sistema respiratorio. El Sarcoma de Kaposi pulmonar suele producir lesiones en la mucosa
bronquial, pero puede asociarse a diversas manifestaciones radiográficas como nódulos, adenopatías y
derrames pleurales. A diferencia de las lesiones del Sarcoma de Kaposi clásico que afecta a ancianos y
aparece en piel de extremidades inferiores, las del sarcoma de Kaposi epidémico suele afectar la cara
con frecuencia la nariz, los genitales y la cavidad oral (paladar y encías), además de las extremidades
inferiores (1). El caso clínico presenta similitudes con la presentación
típica del Sarcoma de Kaposi epidémico relacionado con el VIH, incluyendo la distribución de las
lesiones cutáneas y el compromiso de otros sistemas, pero no proporciona información específica sobre la
remisión del Sarcoma de Kaposi con la reducción de la inmunosupresión. Sin embargo, la respuesta al
cambio en el tratamiento antirretroviral y la quimioterapia sugiere una mejora en el control de la
enfermedad.
El sarcoma de Kaposi se manifiesta en forma de lesiones que aumentan de tamaño, pasando de manchas a
placas y más tarde a nódulos. Las lesiones suelen tener un color violáceo al principio y luego adquieren
un color marrón debido al depósito de hemosiderina(1). Las lesiones del
sarcoma de Kaposi están compuestas
de espacios vasculares, eritrocitos extravasados y distintos tipos de células, entre las que se
encuentran, las células malignas fusiformes y células mononucleares infiltrantes como los macrófagos
cargados de hemosiderina. La naturaleza hipervascular le confiere su color purpura. En el estadio
nodular, casi todas las células fusiformes están infectadas por HHV-8 (1).
En el caso clínico las lesiones evolucionan a placas y luego a nódulos violáceos en miembros inferiores,
genitales, y otras áreas. La progresión de nuestro caso clínico concuerda con la descripción clásica del
Sarcoma de Kaposi. Histológicamente, las lesiones muestran espacios vasculares, eritrocitos extravasados
y células malignas fusiformes. La infección por HHV-8 está asociada, destacando la naturaleza viral del
Sarcoma de Kaposi. El tratamiento incluyó quimioterapia y cambio de régimen antirretroviral debido a
resistencia.
Tanto el SK como la AB se presentan en pacientes infectados por VIH con bajo recuento de LT CD4. La AB
puede tener lesiones orales que imitan las del SK. Aunque un clínico experimentado suele reconocer el
sarcoma de Kaposi, la biopsia confirma el diagnostico con facilidad, por lo cual el estudio
anatomopatológico es fundamental para el diagnóstico definitivo y así diferenciar sarcoma de Kaposi de
angiomatosis bacilar (9). Es por ello la necesidad de aplicar en conjunto
los exámenes auxiliares histopatológicos, para el sustento adecuado de la patología brindada.
CONCLUSIÓN
El diagnostico diferencial del sarcoma de Kaposi se debe hacer con la angiomatosis bacilar que esta
causada por especies de Bartonella. Es infrecuente la presencia de procesos patológicos duales o
múltiples en una biopsia de piel, a lo que se suma que la existencia de dos enfermedades en una misma
muestra de biopsia puede ser pasada por alto, en especial cuando hay predominio histológico de un tipo
de lesión. Por este motivo, es muy importante mantener un alto índice de sospecha clínica en pacientes
VIH/SIDA severamente inmunosuprimidos sin TARGA (13).
El tratamiento del Sarcoma de Kaposi en la infección por VIH es paliativo, mas no curativo. Según la
gravedad de la enfermedad las opciones terapéuticas pueden incluir Terapia antirretroviral combinada
como primera línea de tratamiento en la manifestación cutánea y en caso de compromiso visceral o
enfermedad rápidamente progresiva está indicada la quimioterapia conjuntamente con la terapia
antirretroviral. En el caso presentado al haber evidente fracaso del tratamiento fue necesario realizar
estudio de genotipo VIH, con los resultados se determinó resistencia a antirretrovirales, por lo cual se
realizó el cambio de medicamentos antirretrovirales y al tener el paciente compromiso visceral se vio
beneficiado de uso de quimioterapia más ajuste del TARGA resultando en evidente mejoría.
Contribuciones de Autoría:
ODC ha participado como único autor en la concepción del artículo, búsqueda de información,
redacción y aprobación de la versión final.
Financiamiento:
Autofinanciado
Declaración de conflictos de intereses:
El autor declara no tener conflicto de interés.
Recibido:
14 de Marzo del 2023
Aprobado:
12 de Junio del 2024
Correspondencia:
Roger Sernaque Mechato
Dirección:
Hospital Santa Rosa, Lima Perú
Teléfono:
(+51) 998995740
Correo electrónico:
internistagg@gmail.com
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/4.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
