ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2024 - Universidad Ricardo Palma10.25176/RFMH.v24i3.6679
IMPACTO DEL ÍNDICE NEUTRÓFILO/LINFOCITO EN EL MELANOMA LENTIGINOSO ACRAL
IMPACT OF NEUTROPHIL-LYMPHOCYTE RATIO IN ACRAL LENTIGINOUS MELANOMA
Joseph Alburqueque-Melgarejo
 1,a
1,a
Martha Eugenia Aguirre Coronado
 2,b
2,b
Brady Beltrán Gárate
 3,c
3,c
1 Universidad Cientifica del Sur, Lima, Perú
2 Hospital de emergencias José Casimiro Ulloa, Lima, Perú
3 Instituto de investigaciones en ciencias Biomédicas. Facultad de medicina humana. Universidad
Ricardo Palma, Lima, Perú
a Magister en Medicina
b Medicina interna
c Oncólogo médico
RESUMEN
Introducción: El melanoma lentiginoso acral (MLA) es el cuarto tipo de melanoma cutáneo y es el
subtipo más común en algunos países de América Latina y Asia. El índice neutrófilo-linfocito (NLR) es un
marcador inflamatorio que ha demostrado tener utilidad como herramienta pronóstica en varias neoplasias
malignas.
Objetivo: El objetivo del estudio fue evaluar si el NLR tiene valor pronóstico en la MLA. Se
realizó un estudio retrospectivo que incluyó pacientes con MLA entre 2010 y 2015.
Métodos: Se empleó un diseño observacional, analítico, y de tipo cohorte retrospectiva. Se
trabajó con una población total de 69 pacientes con el diagnóstico de melanoma acral lentiginoso. Para
el análisis estadístico se empleó el paquete estadístico SPSS versión 26. Se realizaron modelos de
regresión proporcional de Cox univariados y multivariados.
Resultados: Se incluyeron un total de 69 pacientes con MLA. La mediana de edad fue 68 años, con
predominio del sexo femenino (55%). La mayoría de los pacientes tenían T4 (34%), compromiso ganglionar
(57,1%) y Clark III (34,4%). En el análisis univariado, el nivel de Clark III/IV, la anaplasia, la
infiltración linfocitaria, el estadio III-IV y el NLR se asociaron con el pronóstico. En el análisis
multivariado, el NLR >3,5 (HR 3,9, IC 95% 1,5-10,3, p=0,005) y el nivel de Clark III-IV (HR 3,5, IC 95%
1,6-7,8, p= 0,002) se asociaron con mala supervivencia general (SG).
Conclusiones: El NLR es un factor pronóstico independiente de supervivencia en la MLA.
Palabras clave (DeCS): Melanoma Acral Lentiginoso, Factor pronóstico, Sobrevida, Radio
Neutrófilo-Linfocito.
ABSTRACT
Introduction: Acral lentiginous melanoma (ALM) is the fourth type of cutaneous melanoma and is
the most common subtype in some countries in Latin America and Asia. The neutrophil-lymphocyte ratio
(NLR) is an inflammatory marker that has been shown to be useful as a prognostic tool in several
malignant neoplasms.
Objective: The objective of the study was to evaluate whether NLR has prognostic value in ALM. A
retrospective study was conducted that included patients with ALM between 2010 and 2015.
Methods: An observational, analytical and retrospective cohort design was used. We worked with a
total population of 69 patients with the diagnosis of acral lentiginous melanoma. For the statistical
analysis, the SPSS statistical package version 26 was used. Univariate and multivariate Cox proportional
regression models were performed.
Results: A total of 69 patients with ALM were included. The median age was 68 years, with a
predominance of females (55%). Most patients had T4 (34%), lymph node involvement (57.1%), and Clark III
(34.4%). In univariate analysis, Clark level III/IV, anaplasia, lymphocytic infiltration, stage III-IV,
and NLR were associated with prognoses. In the multivariate analysis, NLR >3.5 (HR 3.9, 95% CI 1.5-10.3,
p=0.005) and Clark level III-IV (HR 3.5, 95% CI 1.6-7.8, p= 0.002) were associated with poor overall
survival (OS).
Conclusions: NLR is an independent prognostic factor for survival in ALM.
Key words (MeSH): Acral Lentiginous melanoma, Prognostic factor, Survival, Neutrophil-Lymphocyte
Ratio.
Introducción
El melanoma maligno (MM) es la forma de cáncer de piel más mortal en todo el mundo(1). Según GLOBOCAN 2018, el MM ocupa el decimotercer lugar en prevalencia a nivel mundial y según este informe, Estados Unidos de América, Alemania, Reino Unido y Australia albergan el mayor número de casos(2,3). Los principales subtipos histológicos de melanoma cutáneo son el melanoma de extensión superficial, nodular, lentigo maligno y acral. El melanoma acral es una denominación por su localización que fue descrita por primera vez por Reed en 1976 y el subtipo histológico más frecuente es el melanoma lentiginoso acral (MLA)(4).
Si bien la génesis del melanoma no acral está relacionada con la exposición intermitente al sol, la patogénesis del MLA no está completamente definida(1). Algunos estudios lo han asociado con lesiones traumáticas, exposición a luz ultravioleta y exposición a sustancias químicas como factores de riesgo; mientras que otros no están relacionados con ellos(5-8). Los factores pronósticos clínicamente relevantes del melanoma maligno cutáneo incluyen la profundidad del tumor, seguido de los márgenes seguros, la biopsia del ganglio centinela y la ulceración. El recuento de mitosis ya no se considera relevante para el pronóstico. En el subtipo MLA se ha reportado que los factores pronósticos clínicos relevantes incluyen la profundidad del tumor y el estadio clínico(9).
Desde un punto de vista fisiopatológico el uso del NLR se sustenta en el rol de ambas poblaciones celulares. Por un lado los neutrófilos, que al tener fenotipo protumoral favorecen el crecimiento, angiogénesis e invasión tumoral. Mientras que por otro lado, los linfocitos, particularmente los linfocitos T, juegan un papel crucial en la vigilancia y respuesta inmune contra cáncer. Un NLR elevado sugiere un ambiente proinflamatorio que puede favorecer la progresión tumoral y exhibir una respuesta inmune ineficaz contra el cáncer. En la actualidad han surgido nuevos parámetros pronósticos como el ratio neutrófilos-linfocitos (NLR), que ha sido ampliamente utilizado en otro tipo de neoplasias y previamente hemos reportado que el NLR se relaciona con la supervivencia en pacientes con linfomas agresivos de células B y células T(10,11).
La relevancia clínica del uso de NLR en pacientes con MLA en población peruana reside en que este representa una herramienta no invasiva y de fácil acceso que permite estimar el pronóstico y estratificar el riesgo desde una etapa temprana. Por lo expuesto, el objetivo del presente estudio es demostrar el valor pronóstico del NLR en pacientes con MLA, que es el melanoma cutáneo más frecuente en el Perú.
MétodosDiseño y área de estudio
El presente estudio empleó un diseño cuantitativo, observacional y de tipo cohorte retrospectiva. Se aplicó la lista de verificación STROBE para estudios de cohorte(12).
Población y muestraLa población de estudio estuvo constituida por pacientes con diagnóstico de Melanoma Lentiginoso Acral atendidos en el Hospital Edgardo Rebagliati Martins durante los años 2010 y 2015. Dentro de los criterios de inclusión destacan pacientes con diagnóstico histopatológico de Melanoma Lentiginoso Acral, edad mayor a 18 años, historia clínica con información clínica completa y la presencia de un seguimiento adecuado. Se excluyeron pacientes con la presencia de una segunda neoplasia, y aquellos que presenten información clínica incompleta.
Variables e instrumentosLos datos de las variables de estudio fueron recolectados a partir de las historias clínicas de los pacientes. Las características clínicas de los pacientes fueron clasificadas de acuerdo a su tipo. La variable sexo fue evaluada como una variable cualitativa dicotómica. La variable sitio primario del tumor fue definida como una variable cualitativa politómica. La variable edad fue evaluada como una variable cuantitativa continua y posteriormente fue dividida en una variable cualitativa dicotómica de acuerdo a si los pacientes eran considerados o no adultos mayores.
Las características patológicas del tumor fueron evaluadas como variables cualitativas e incluyeron los niveles de Clark (I-IV), el espesor de Breslow (0.01-1, 1.01-2, 2.01-4, >4), la presencia de anaplasia (presente, ausente, desconocido), la presencia de ulceración (presente, ausente, desconocido), la presencia de microsatelitosis (presente, ausente, desconocido), la infiltración perineural (presente, ausente, desconocido), la infiltración linfocitaria (presente, ausente, desconocido), la invasión vascular (presente, ausente, desconocido), el compromiso ganglionar (presente, ausente, desconocido), el número de ganglios comprometidos (1-2, 3-5, >6), el estadio patológico de acuerdo a la 7° edición del Comité Conjunto Americano del Cáncer (AJCC 7° edición) (I, II, III, IV, desconocido).
La variable índice neutrófilo linfocito (NLR) fue definida como el cociente del recuento absoluto de neutrófilos y el recuento absoluto de linfocitos (NLR = ANC/ALC). Las variables hematológicas (recuento absoluto de neutrófilos, linfocitos, monocitos, plaquetas) fueron medidas utilizando un analizador hematológico de la marca Sysmex modelo XN-1000 y la técnica empleada fue la citometría de flujo. La supervivencia total (OS) fue calculada desde el diagnóstico de la enfermedad (evento) hasta la fecha de último seguimiento (censurado).
Análisis estadísticoLos datos recolectados fueron ingresados a una base de datos del paquete estadístico SPSS versión 26 para su análisis estadístico. La información clínico-patológica se analizó empleando herramientas de estadística descriptiva dentro de las que se incluyeron frecuencias absolutas y relativas para las variables cualitativas. Se utilizó un punto de corte de 3.5 para NLR de acuerdo a con el estudio de Vano Y et al, para la estratificación de los grupos de pacientes(13). Para el análisis inferencial se empleó un análisis de supervivencia que utilizó el método de Kaplan-Meier para generar curvas de supervivencia, las cuales se compararon mediante la prueba de rangos logarítmicos (Log rank). Asimismo, se realizó un modelo de regresión proporcional de Cox para establecer los modelos de supervivencia univariados y multivariados. Los resultados del modelo de regresión proporcional de Cox se informaron con un índice de riesgo (HR) con sus respectivos intervalos de confianza (IC) del 95%. El valor p se consideró significativo si era inferior a 0,05.
Aspectos éticosPara la ejecución del presente proyecto de investigación se obtuvo la aprobación (Carta N° 387-GRPR ESSALUD-2023) del Comité de Ética del Hospital Edgardo Rebagliati Martins. Se respetó la confidencialidad y los derechos de los pacientes de acuerdo a lo establecido en los principios bioéticos y en la Declaración de Helsinki.
ResultadosSe analizó un total de 69 pacientes, de los cuales se encontró un predominio importante del sexo femenino (51.1%). La edad media fue de 68 años y el 68% de los pacientes presentaba una edad mayor de 60 años. La localización plantar fue el sitio más frecuentemente afectado en la ALM, con 88,4%, seguido de la localización palmar en 8,6% y la subungueal fue solo de 2,9% de los casos (Tabla 1).
|
N |
% |
|
|---|---|---|
| Pacientes | 69 | |
| Edad | ||
| Mediana (RIQ) | 68 (16, 89) | |
| <60 | 22 | 31.9 |
| >60 | 47 | 68.1 |
| Sexo | ||
| Femenino | 38 | 55.1 |
| Masculino | 31 | 44.9 |
| Sitio primario | ||
| Plantar | 61 | 88.4 |
| Palmar | 6 | 8.6 |
| Subungueal | 2 | 2.9 |
RIQ: Rango intercuartilico
En relación a las características patológicas, se encontró que un espesor de Breslow entre 0,01 a 1 mm estuvo presente en el 18,8% de los pacientes, 1,01-2 mm en el 21,7%, 2,01-4 mm en el 13% y más de 4 mm en el 37,7% de los pacientes. La ulceración no estuvo presente en más de la mitad de los pacientes (58,0%) y la mayoría de los pacientes no presentaron infiltración perineural, infiltración linfocitaria e invasión vascular (89,9%, 82,6% y 89,9% respectivamente). La anaplasia y la microsatellitosis estuvieron presentes en el 5,8% y 1,4%, respectivamente. No se encontró regresión tumoral. El compromiso ganglionar estuvo presente en el 17,4%. El estadio patológico I estuvo presente en el 28,9% de los pacientes, el estadio II en el 34,8%, el estadio III en el 24,6% y el estadio IV en el 5,8% (Tabla 2).
|
N |
% |
|
|---|---|---|
| Pacientes | 69 | |
| Niveles de Clark | ||
| I | 7 | 10.1 |
| II | 14 | 20.3 |
| III | 21 | 30.4 |
| IV | 13 | 18.8 |
| V | 6 | 8.7 |
| Desconocido | 8 | 11.6 |
| Breslow | ||
| 0.01-1 | 13 | 18.8 |
| 1.01-2 | 15 | 21.7 |
| 2.01-4 | 9 | 13.0 |
| > 4 | 26 | 37.7 |
| Desconocido | 6 | 8.7 |
| Anaplasia | ||
| No | 59 | 85.5 |
| Si | 4 | 5.8 |
| Desconocido | 6 | 8.7 |
| Ulceración | ||
| No | 40 | 58.0 |
| Si | 25 | 36.2 |
| Desconocido | 4 | 5.8 |
| Microsatellitosis | ||
| No | 64 | 92.8 |
| Si | 1 | 1.4 |
| Desconocido | 4 | 5.8 |
| Infiltración perineural | ||
| No | 62 | 89.9 |
| Si | 3 | 4.3 |
| Desconocido | 4 | 5.8 |
| Infiltración linfocitaria | ||
| No | 57 | 82.6 |
| Si | 8 | 11.6 |
| Desconocido | 4 | 5.8 |
| Invasión vascular | ||
| No | 62 | 89.9 |
| Si | 3 | 4.3 |
| Desconocido | 4 | 5.8 |
| Compromiso ganglionar | ||
| No | 53 | 76.8 |
| Si | 12 | 17.4 |
| Desconocido | 4 | 5.8 |
| N° ganglios linfáticos (+) | ||
| 1-2 | 7 | 58.3 |
| 3-5 | 4 | 33.3 |
| >6 | 1 | 8.3 |
| Regresión | ||
| No | 65 | 94.2 |
| Si | 0 | 0.0 |
| Desconocido | 4 | 5.8 |
| Estadio (7th Edition AJCC) | ||
| I | 20 | 28.9 |
| II | 24 | 34.8 |
| III | 17 | 24.6 |
| IV | 4 | 5.8 |
| Desconocido | 4 | 5.8 |
*AJCC: Comité Conjunto Americano del Cáncer
El 82,6 % de los pacientes con estadio clínico I a III fueron intervenidos quirúrgicamente y en el 76,9 % de los pacientes se realizó una disección ganglionar completa (CLND). El tratamiento adyuvante se realizó en el 32,3% de los pacientes con estadio IIB a IIIC. Todos los pacientes con estadio IV recibieron la mejor atención de apoyo y ningún tratamiento sistémico debido a un estado funcional deficiente. La tasa de supervivencia total a los 5 años fue del 54,3 % con una mediana de 6,3 meses.
El análisis univariado empleando un modelo de regresión proporcional de Cox mostró que las variables niveles de Clark IV-IV (HR:1,8, IC 95%, 1,1-3,2, p=0,016), anaplasia (HR: 3,0, IC 95%, 1,5-5,7, p=0,022), infiltración de linfocitos (HR: 2,8, IC 95%, 1,6-5,0, p=0,035), estadio clínico avanzado (HR:2,5, IC 95%, 1,5-4,1, p=0,030) y NLR > 3,5 (HR 2,1; IC 95%, 1,1-4,19, p=0,002), se asociaban con mal pronóstico. (Tabla 3).
| Mediana | ST a 5 años (%) | HR | p-valor | |
|---|---|---|---|---|
|
Supervivencia total |
63 |
54.3 |
||
| Edad | ||||
| <60 | NR | 52.8 | Referencia | vacio |
| >60 | 5.4 | 55.1 | 1.2 (0.7, 2.1) | 0.867 |
| Sexo | ||||
| Femenino | 6.8 | 63.6 | Referencia | |
| Masculino | 3.5 | 45.1 | 2.1 (1.3, 3.5) | 0.130 |
| Niveles de Clark | ||||
| I-III | 6.7 | 58.7 | Referencia | |
| IV-V | 2.5 | 32.3 | 1.8 (1.1, 3.2) | 0.016 |
| Espesor de Breslow | ||||
| <1 | 6.3 | 54.3 | Referencia | |
| >1 | 4.4 | 42.0 | 1.2 (0.6, 2.4) | 0.644 |
| Anaplasia | ||||
| No | 5.4 | 53.6 | Referencia | |
| Si | 0.4 | 25.0 | 3.0 (1.5, 5.7) | 0.022 |
| Ulceración | ||||
| No | 6.3 | 61.1 | Referencia | |
| Si | 3.2 | 41.8 | 1.8 (1.1, 3.0) | 0.453 |
| Infiltración linfocitaria | ||||
| No | 6.3 | 57.4 | Referencia | |
| Si | 2.2 | 25.0 | 2.8 (1.6, 5.0) | 0.035 |
| Estadio clínico | ||||
| I-II | 6.7 | 65.2 | Referencia | |
| III-IV | 2.5 | 30.9 | 2.5 (1.5, 4.1) | 0.030 |
| NLR | ||||
| <3.5 | 6.6 | 57.6 | Referencia | |
| >3.5 | 1.7 | 31.7 | 2.1 (1.1, 4.19) | 0.002 |
| LMR | ||||
| >0.2 | 6.8 | 62.5 | Referencia | |
| <0.2 | 4.4 | 49.6 | 1.7 (1.0, 3.1) | 0.064 |
| PLR | ||||
| <170 | 6.6 | 58.7 | Referencia | |
| >170 | 4.3 | 43.6 | 2.1 (1.2, 3.4) | 0.085 |
*ST: Supervivencia total, NLR: Indice Neutrofilo-Linfocito , LMR: Indice Linfocito-Monocito , PLR: Indice Plaqueta-Linfocito
El análisis multivariado empleando un modelo de regresión proporcional de Cox mostró que las variables niveles de Clark IV-V (HR 3,5; IC 95%, 1,6-7,8, p=0,002) y NLR >3,5 se asocia con una menor supervivencia total (HR: 3,9, IC 95%, 1,5-10,3, p=0,005) (Tabla 4).
| IC 95% | |||||
|---|---|---|---|---|---|
| p-valor | HR | Inferior | Superior | ||
| Nivel de Clark | |||||
| I-III | Referencia | ||||
| IV-V | 1.2 | 0.002 | 3.5 | 1.6 | 7.8 |
| NLR | |||||
| <3.5 | Referencia | ||||
| >3.5 | 1.4 | 0.005 | 3.9 | 1.5 | 10.3 |
*HR: Hazard Ratio, IC 95%: Intervalos de confianza al 95%
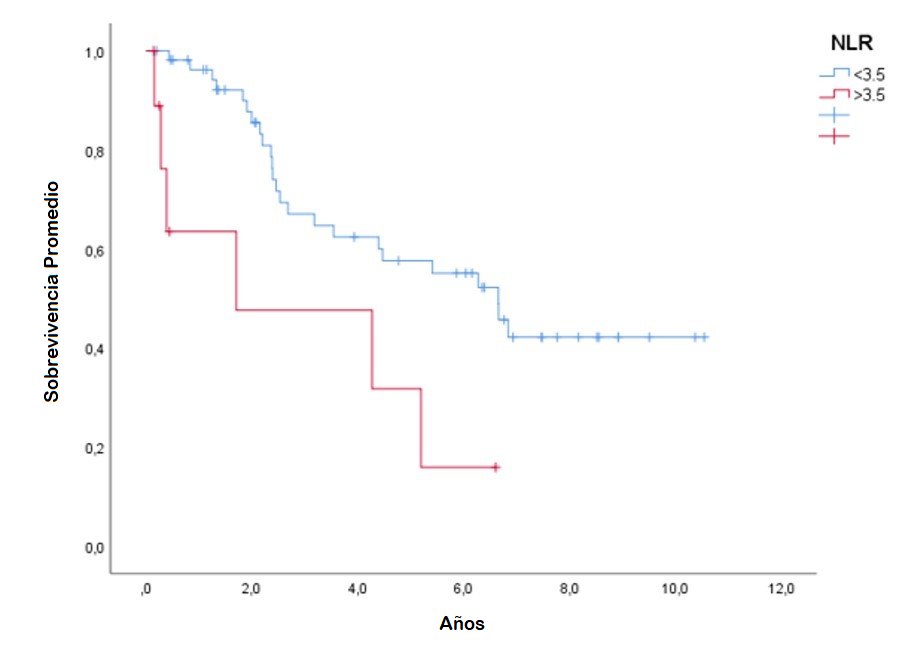
Las curvas de supervivencia de Kaplan-Meier para los niveles de NLR de acuerdo al punto de corte de 3,5 para evaluar la supervivencia total en pacientes con diagnóstico de melanoma lentiginoso acral mostraron diferencias estadísticamente significativas entre los grupos de NLR alto y NLR bajo, de acuerdo a la prueba de rangos logarítmicos log rank (p<0,001). (Figura 1)
Figura 1: Curva de Kaplan-Meier para NLR con un punto de corte de 3,5 para evaluar el pronostico en pacientes con diagnóstico de melanoma lentiginoso acral
Discusión
Este es el primer informe en América Latina que estudia el papel del NLR en MLA. En nuestra cohorte de 135 pacientes con melanoma cutáneo, se encontró que el 51,1% de los pacientes presentaban MLA (69 casos). En un estudio peruano previo se encontró que el MLA es el subtipo de melanoma más frecuente con un 61,2% que en los melanomas no acral(14).
En melanoma no acrocutáneo existen algunos estudios que demuestran el valor pronóstico del NLR, además se han publicado tres metaanálisis que confirman su papel predictivo con inhibidores de puntos de control o tratamiento anti BRAF(15, 16, 17). Recientemente, Cocorocchio et al. encontraron que el estadio clínico, la LDH sérica elevada y el NLR > 5 eran pronósticos de SG en pacientes con melanoma avanzado que recibieron la combinación de tratamiento con BRAFi solo o combinado con un inhibidor de MEK (MEKi) en las dosis recomendadas. Estos datos sugieren que existe un efecto inmunomodulador de la terapia sobre el microambiente tumoral además del efecto directo del tratamiento y podría haber algunos posibles biomarcadores clínicos para ello(18). Finalmente, Bartlett et al, realizaron un estudio prospectivo con pacientes con melanoma cutáneo metastásico que recibían tratamiento anti-PD1, describiendo que los pacientes con NLR>5 tenían una mayor carga de enfermedad y un menor estado funcional, también en el análisis univariado y multivariado, se relacionaba con una peor SG(19).
El fundamento del NLR es que está destinado a medir la respuesta inflamatoria del tumor (neutrofilia) y la respuesta inmune del huésped (linfopenia). Uno de sus puntos fuertes es su simplicidad de cálculo, definida como el número de neutrófilos circulantes absolutos dividido por el recuento absoluto de linfocitos(18, 19, 20, 21). Los neutrófilos tienen un comportamiento dual en el microambiente tumoral. Se han establecido dos subtipos o fenotipos: el subtipo de neutrófilos de alta densidad (HDN) y el subtipo de neutrófilos de baja densidad (LDN)(14).
El subtipo HDN tiene actividad antitumoral y efecto directo sobre la célula tumoral o estimula indirectamente la inmunidad mediada por células T. Por otro lado, el subtipo LDN ejerce una actividad protumoral que favorece la progresión. Esto está mediado por dos mecanismos. Los LDN promueven la activación de células T supresoras mediante la secreción de Arginina, que se encarga de regular la angiogénesis mediante la estimulación de los factores de crecimiento endotelial vascular (VEGF). Al inicio de la inflamación, los neutrófilos tienen el fenotipo HDN, pero al resolver esta inflamación aguda se acumula el fenotipo LDN. En el cáncer se sabe que existe inflamación crónica, por lo que se genera y acumula el fenotipo LDN, dando como resultado el fenotipo desfavorable de los neutrófilos. Esta proporción de neutrófilos LDN aumenta en relación con la carga tumoral(14).
Por otro lado, la linfopenia se asocia con una inmunidad reducida del huésped e indirectamente con la estimulación de las células T supresoras(20). Este tipo de células contribuyen a la disminución de la actividad inmune antitumoral. Las más conocidas son las células T reguladoras (Treg) CD4+ CD25+ FOXP3+. Estas células están implicadas en la prevención de la respuesta inmune y la inhibición de la respuesta inmune antitumoral, produciendo de esta forma un equilibrio normal en el organismo. Sin embargo, se ha encontrado acumulación de Tregs en el cáncer y se relaciona con malos resultados en algunos tipos de cáncer(21, 22).
La importancia del NLR en MLA no está bien estudiada. Sin embargo, existen escasos estudios en el continente asiático que han investigado su valor pronóstico(23, 24). Yu et al. evaluaron biomarcadores basales de sangre periférica para predecir el resultado de la MLA en etapa temprana tratada con IFNα-2b y encontraron que NLR ≥2,35 se asocia con una supervivencia libre de recurrencia y una SG deficientes(25). Por el contrario, Jung et al. realizaron un estudio retrospectivo en población asiática donde el objetivo fue evaluar la eficacia de Ipilimumab en melanoma. Entre sus hallazgos, el 31% tenía MLA en estadío avanzado. Se encontró que los niveles de NLR superiores a 5 representaban un factor de mal pronóstico independiente para la supervivencia. Asimismo, se encontraron niveles elevados de NLR en pacientes que experimentaron enfermedad progresiva y un NLR bajo fue un predictor de progresión más prolongada supervivencia libre (SSP) y SG(26). Por otro lado, Lee et al. realizaron una cohorte retrospectiva de 152 pacientes, de la cual 58 pacientes (38%) presentaban con MLA. Los niveles de NLR > 2,1 se encontraban asociados con una peor supervivencia libre de progresión (mediana 6,9 vs. 2,4 meses, p = 0,015) y una supervivencia total (mediana no alcanzada vs. 10,4 meses, p < 0,001)(27, 28). De acuerdo con estos hallazgos, nuestro estudio también confirma el papel pronóstico del NLR en la supervivencia de la MLA en población sudamericana.
El presente estudio presenta limitaciones. En relación al diseño empleado, al tratarse de una cohorte retrospectiva con una población pequeña en comparación con otras series, se encuentra una limitación el poder y la validez externa del estudio. Por otro lado, se trató de un estudio unicéntrico, realizado en una sola institución en la que los pacientes fueron remitidos para tratamiento quirúrgico, adyuvante o de primera línea, por lo que la extrapolación de los resultados del estudio debe realizarse de manera cuidadosa. Por otro lado, la recolección de datos se basó en la revisión de historias clínicas, lo que supone la posibilidad de haber incurrido en un sesgo de selección.
Este estudio reporta que el MLA es un subtipo frecuente y agresivo de melanoma cutáneo en nuestro país. Este es el primer informe latinoamericano que investiga el valor pronóstico del NLR en MLA, como un primer paso para una mejor comprensión de su microambiente tumoral. Además, tiene potencial para abordar nuevas dianas terapéuticas en el futuro. Es necesario realizar más investigaciones en ensayos prospectivos.
ConclusiónEn presente estudio mostró que los niveles de NLR superiores a 3.5 se asocian con una menor supervivencia total independientemente de otras variables en pacientes con melanoma lentiginoso acral, y que por tanto el NLR representa un notable marcador pronóstico en esta población.
Declaración de conflictos de interés: Los autores niegan conflictos de intereses.
Contribuciones de autoría: Todos los autores contribuyeron significativamente a la
realización del trabajo de investigación. Conceptualización, J.A.M, B.B.G, M.E.A.C; metodología,
B.B.G, M.E.A.C; análisis, J.A.M, B.B.G; investigación, M.E.A.C, J.A.M, B.B.G; limpieza de datos,
J.A.M, B.B.G, M.E.A.C; redacción – preparación del borrador, B.B.G, M.E.A.C; redacción –
revisión y edición, J.A.M, B.B.G, M.E.A.C; visualización, J.A.M, B.B.G, M.E.A.C; supervisión,
J.A.M, B.B.G, M.E.A.C. Todos los autores han leído y acordado la versión publicada del
manuscrito.
Financiamiento: Autofinanciado.
Recibido: 05 de julio del 2024
Aprobado: 27 de julio del 2024
Autor corresponsal: Joseph Alburqueque-Melgarejo
Dirección: Callao, Lima, Perú
Teléfono: +51-979 862 474
Correo electrónico: jalburqueque@cientifica.edu.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/4.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.