ARTÍCULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2024 - Universidad Ricardo Palma10.25176/RFMH.v24i3.6682
EFECTO DEL CONSUMO DEL EXTRACTO DEL FRUTO DE “camu camu” EN LA INTEGRIDAD DEL ADN ESPERMÁTICO DE RATONES PRETRATADOS CON DOSIS UNICA DE CICLOFOSFAMIDA
EFFECT OF CONSUMPTION OF THE FRUIT EXTRACT OF “camu camu” ON THE INTEGRITY OF THE SPERM DNA OF MICE PRETREATED WITH UNIQUE DOSE OF CYCLOPHOSPHAMIDE
Jose Luis Pino Gaviño
 1,2,a,
Carlos Bell Cortez
1,2,a,
Carlos Bell Cortez
 3,b,
Pilar Valeria Pino Velásquez
3,b,
Pilar Valeria Pino Velásquez
 1,d,
1,d,
Jacquelyne Zarria Romero
 1,c
Nilda Oliveros Rodríguez
1,c
Nilda Oliveros Rodríguez
 4,a,
Betty Shiga Oshige
4,a,
Betty Shiga Oshige
 1,2,e
1,2,e
1 Laboratorio de Reproducción y Biología del Desarrollo, Instituto de Investigación de Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas Universidad Nacional Mayor de San Marcos (UNMSM). Lima - Perú.
2 Centro de Investigación de Recursos NAturales (CIRNA). Vicerrectorado de Investigación y Posgrado. UNMSM.
3 Laboratorio de Química y Analítica, Instituto de Ciencias Farmacéuticas Y Recursos Naturales "Juan de Dios Guevara". Facultad de Farmacia y Bioquímica. (UNMSM). Lima - Perú.
4 Laboratorio de Radiobiología, Instituto de Investigación de Ciencias Biológicas Antonio Raimondi, Facultad de Ciencias Biológicas (UNMSM). Lima - Perú.
a Biólogo.
b Doctor en Farmacia y Bioquímica.
c Doctor en Ciencias Biológicas.
d Magíster en Procedimientos en Reproducción Asistida.
RESUMEN
Introduccion: Myrciaria dubia conocido como “camu camu” es una fruta que crece en la Amazonía y
tiene como principal característica su alto contenido de vitamina C o ácido ascórbico, el cual tiene el
rol de protección en la espermatogénesis por ser un compuesto con excelente acción reductora. El
proposito de esta investigacion fue evaluar la capacidad citoprotectora in vivo del extracto acuoso del
fruto de Myrciaria dubia (Kunth) McVaugh “camu-camu” frente al daño mutagénico producido por el
antineoplásico ciclofosfamida (CP) sobre la línea germinal masculina.
Metodología: Se utilizaron ratones (n= 60) divididos en cinco grupos tratamiento: T1= control
negativo (sin tratamientos); T2 ingirió el extracto acuoso (10mgkg-1), T3 ingirió el extracto acuoso
(50mgkg-1), T4 ingirió el extracto acuoso (100mgkg-1); T5 es el control positivo (se le administró
solamente CP). A todos se inyectaron una dosis única de CP (50 mgkg-1) vía intraperitoneal., El
tratamiento con camu-camu continúo por 45 días, luego los ratones fueron eutanizados para determinar la
calidad espermática y la frecuencia del daño al ADN mediante el protocolo de índice de fragmentación de
ADN espermático – protocolo Halomax.
Resultados: Se observó en todos los ensayos el efecto del extracto de camu-camu (p< 0,05)
respecto al control. El grupo T4, el cual se administró la mayor concentración del extracto acuoso del
fruto (100 mgkg-1), evidenció el mayor efecto citoprotector del camu-camu (p< 0,05).
Conclusión: El efecto dañino al ADN por la acción oxidativa del CP podría estar siendo inhibido o
modulado por el extracto acuoso del fruto de “camu camu”.
Palabras clave: camu-camu, Myrciaria dubia, ciclofosfamida, fragmentación del ADN, ratón, semen.
(fuente: DeCS-BIREME)
ABSTRACT
Introduction: Myrciaria dubia known as “camu camu” is a fruit that grows in the Amazon and its
main characteristic is its high content of vitamin C. Ascorbic acid has a protective role in
spermatogenesis as it is a compound that has excellent reducing action. The purpose of this research was
to evaluate in vivo the cytoprotective capacity of the aqueous extract of the fruit of Myrciaria dubia
(Kunth) McVaugh “camu-camu” against the mutagenic damage produced by the antineoplastic drug
cyclophosphamide (CP) on the male germ line.
Methodology: Mice (n= 60) were divided into five treatment groups: T1= negative control (without
treatment); T2 ingested the aqueous extract (10mgkg-1), T3 ingested the aqueous extract (50mgkg-1), T4
ingested the aqueous extract (100mgkg-1); T5 is the positive control. All of them were injected with a
single dose of CP (50 mgkg-1) intraperitoneally. Treatment with camu-camu continued for 45 days, then
the mice were euthanized to determine sperm quality and the frequency of DNA damage using the Index
protocol. Sperm DNA fragmentation – Halomax protocol.
Results: The effect of camu-camu extract was observed in all trials (p< 0.05) compared to the
negative control. Group T4, which was administered the highest concentration of the aqueous extract of
the fruit, evidenced the cytoprotective effect of camu-camu (p< 0.05).
Conclusion: The damaging effect on DNA due to the oxidative action of CP could be inhibited by
the aqueous extract of the “camu camu” fruit.
Keywords: Camu-camu, Myrciaria dubia, Cyclophosphamide, DNA fragmentation, mouse, semen. (source:
MeSH NLM)
INTRODUCCIÓN
La infertilidad es definida por la Organización Mundial de la Salud como una enfermedad del sistema
reproductivo entendida como la incapacidad de lograr un embarazo clínico después de 12 meses o más de
relaciones sexuales sin el empleo del algún método anticonceptivo(1). E Esta condición afecta a casi un
20% de las parejas en edad reproductiva y se considera que el factor masculino contribuye con el 50% de
los casos. El primer análisis que se hace un varón que acude a un centro de reproducción asistida para
poder predecir su potencial fértil es el espermatograma que en resumen consiste en el análisis
macroscópico y microscópico del fluido seminal. Adicionalmente hoy en día se están tomando en cuenta
nuevas pruebas complementarias que evalúan otros aspectos de los espermatozoides como por ejemplo la
integridad de su material genético(2).
La importancia del análisis del ADN del espermatozoide radica en que diversos estudios han demostrado
que la integridad del ADN en el espermatozoide afectaría los resultados clínicos en los tratamientos de
reproducción asistida y que a pesar de los datos que brinda el espermatograma para evaluar la calidad
espermática, aproximadamente un 10% a 15% de los varones diagnosticados con infertilidad presentan
parámetros del espermatograma dentro de rangos normales aunque podrían presentar defectos en el ADN de
los espermatozoides. La rotura de la hebra de ADN en los espermatozoides se atribuye a diversos motivos
dentro de los cuales se encuentran la producción excesiva de radicales libres en el eyaculado, así como
la exposición a factores ambientales, ocupacionales, y hábitos tóxicos(3). Un alto daño del ADN
espermático se ha correlacionado a infertilidad, desarrollo embrionario defectuoso, falla en la
implantación y un incremento de abortos recurrentes(4).
Ciclofosfamida (CP) [N, N-bis (2-cloroetil) tetrahidro-2H-1, 3,2 oxaza - fosforin-2-amino 2-oxido] es un
agente alquilante comúnmente utilizado como fármaco antineoplásico e inmunosupresor. La citotoxicidad de
la CP es mediada por la alquilación del ADN en la posición N7 de guanina y la formación de cross-links
del tipo ADN-ADN y ADN-proteína, así como quiebres en una de las hebras del ADN(5-7). La ciclofosfamida
produce infertilidad al interrumpir la meiosis antes de la etapa de paquiteno produciendo así daño
genotóxico en la línea germinal y deterioro en las células de Leydig(8-10). Las células eucariotas para
mantener la estabilidad genética detienen su ciclo celular, lo cual, permite la activación de mecanismos
de reparación del ADN(11), pero cuando el daño es severo se activan vías de muerte celular tal como la
apoptosis(12). La apoptosis describe un patrón morfológico único de muerte celular caracterizado por
condensación de la cromatina, formación de rupturas en la membrana, y la fragmentación del ADN; este
mecanismo, juega un papel importante en la homeostasis de organismos multicelulares. La función anormal
de apoptosis se ha asociado a varias enfermedades humanas, incluyendo trastornos neurodegenerativos y
cánceres.
“Camu camu” (Myrciaria dubia) es una fruta que crece en la Amazonía y tiene como principal
característica su alto contenido de vitamina C o ácido ascórbico(13). Se ha reportado que el ácido
ascórbico tiene rol de protección en la espermatogénesis al ser un compuesto que tiene excelente acción
reductora, en consecuencia se convierte en un buen antioxidante(14-16). Hay reportes en los cuales se
comprobó mediante el ensayo in vivo de micronúcleos en médula ósea de ratón, que el extracto acuoso del
fruto de Myrciaria dubia H. B. K. Mc Vaugh “camu camu”, posee un efecto antimutagénico contra el daño
producido por sales con fluor y que cuando se suministra anticipadamente tiene un efecto citoprotector
en la misma linea celular(17). Otro trabajo hecho en nuestro laboratorio comprobo el efecto protector de
camu-camu de 3 líneas celulares tratadas previamente in vivo con bromato de potasio(18). Basados en la
evidencia científica reportada se plantea como objetivo del presente trabajo de investigación,
determinar si el “camu camu” puede revertir el efecto negativo de la CP sobre la línea germinal
masculina en ratones, enfocando esta evaluación en el índice de fragmentación del ADN de los
espermatozoides, los resultados logrados podrían ser extrapolados para su uso en humanos y de esa manera
restablecer la fertilidad en pacientes que hallan requerido el uso de esta droga en su tratamiento
contra el cáncer.
El test Halomax es una técnica empleada para identificar y evaluar los espermatozoides que presentan
daño en su ADN. Es decir, permite identificar aquellos espermatozoides que tienen su material genético
(ADN) dañado y así diferenciarlos de los que no lo tienen. Este test permite establecer la proporción de
espermatozoides con ADN fragmentado en el total de muestra analizada. Se estima que, utilizando métodos
de reproducción normales, un porcentaje de espermatozoides con ADN fragmentado superior al 30 % reduce o
en algunos casos elimina la posibilidad de conseguir en embarazo a término.
El propósito de esta investigacion fue evaluar in vivo la capacidad citoprotectora del extracto acuoso
del fruto de Myrciaria dubia (Kunth) McVaugh “camu-camu” frente al daño mutagénico producido por el
antineoplásico ciclofosfamida (CP) sobre la línea germinal masculina en ratones.
MÉTODOS
DISEÑO Y ÁREA DE ESTUDIO
Estudio preclínico experimental en el área de biología experimental.
POBLACIÓN Y MUESTRA.
La muestra estuvo conformada por 60 ratones machos (Mus musculus) de la cepa albina BALB/c (entre 6 y 8
semanas de edad) obtenidos del bioterio del Instituto Nacional de Salud, en Lima-Perú. A los grupos
tratamiento de dosis de camu camu, se les administró el extracto acuoso mediante sonda nasogástrica N°18
(Fisher Scientific, Pittsburgh, PA, USA). Los ratones fueron mantenidos a condiciones estándar de
bioterio: fotoperiodo de 14 horas (h) luz y 10h oscuridad, temperatura de 25°-27° C, humedad relativa:
90%, acceso libre a una dieta con pellets (Bedoce, Perú) y agua ad libitum. Los ratones luego de un
periodo de aclimatación en el bioterio de la Facultad, fueron distribuidos aleatoriamente en jaulas, en
cinco grupos de tratamiento (n=12). El día de inicio del estudio, se les administró CP (50
mgKg-1) por única vez vía intraperitoneal, excepto al grupo control negativo.
VARIABLES DE ESTUDIO
En el presente trabajo se evaluaron los pesos de órganos reproductivos, los espermatogramas, análisis de
la motilidad, análisis de la vitalidad, análisis de la morfología espermática, recuento espermático
preciso, integridad de la membrana plasmática y la evaluación del Índice de Fragmentación de ADN
espermático.
PROCEDIMIENTOS:
Plantas
Frutos de “camu-camu”, Myrciaria dubia (Kunth) McVaugh fueron colectados en la ciudad de Pucallpa en
Perú; transportados vía aérea a Lima y trasladado inmediatamente al laboratorio de Reproducción y
Biología del Desarrollo de la Universidad Nacional Mayor de San Marcos (UNMSM). Las plantas fueron
certificadas por el Departamento de Botánica de la UNMSM. En el laboratorio, el fruto fue pesado y
licuado; la pulpa de los frutos de “camu-camu” fue extraído y secado a 60º C por 24 horas en una estufa
de convección de aire seco.
Posteriormente, se preparó un extracto acuoso al 10% (p/v) por 24 horas a 60º C. Después de las 24 horas
el extracto fue decantado, filtrado, cuantificado y guardado a -20 °C; con este extracto se preparó otro
extracto acuoso final al 2% (p/v). El fruto de “camu camu” fue liofilizado y almacenado para su
posterior uso. La distribución del liofilizado de “camu camu” fue resuspendido en agua destilada como
vehículo, en tres dosis diferentes (10 mgKg-1,50 mgKg-1 y 100 mgKg-1). Se administró el “camu camu” vía
sonda nasogástrica de Fisher n° 18 diariamente durante 45 días.
Diseño experimental
Los ratones separados en jaulas tuvieron la siguiente distribución; un grupo control negativo CN (n=12)
que se administró vía ip solución salina durante el mismo periodo de tiempo; un grupo T2 (n=12) el cual
se le administró extracto de camu – camu (10 mgkg-1 de PC) por 45 días; un grupo T3 (n=12) el cual se le
administró extracto de camu – camu (50 mgkg-1 de PC) por 45 días; un grupo T4 (n=12) el cual se le
administró extracto de camu – camu (100 mgkg-1 de PC) por 45 días; un grupo T5 (Control positivo), el
cual se le administró via ip Sólo ciclofosfamida (50 mgKg-1 PC) por única vez.
Durante el transcurso de los tratamientos se obtendrán los pesos corporales diariamente y al finalizar
todos los especímenes de cada grupo fueron sometidos a dos evaluaciones. La primera es la evaluación de
espermatogramas y la segunda es la evaluación del Índice de Fragmentación del ADN espermático.
Finalizados los tratamientos los ratones fueron eutanizados y diseccionados para separar los órganos
reproductivos, aislarlos de los cuerpos grasos y colocarlos en suero fisiológico a 37° C para realizar
los espermatogramas respectivos acorde con los parámetros aprobados por la OMS(19), en donde se incluye
el Análisis de la motilidad, análisis de la vitalidad, análisis de la morfología espermática, recuento
espermático preciso, integridad de la membrana plasmática y la evaluación del Índice de Fragmentación de
ADN espermático.
Obtención de órganos reproductivos.
Con ayuda del estereoscopio se separaron los siguientes órganos del sistema reproductivo masculino (del
lado derecho e izquierdo): testículo, cabeza y cuerpo del epidídimo, cola del epidídimo y conducto
deferente, a continuación, fueron pesados y mantenidos en suero fisiológico a 37° C durante la
aplicación del protocolo para espermatogramas. Se tomó la cola del epidídimo para seccionarlo en 0.5 de
Buffer fosfato salino (PBS) a 37° C. para el análisis de la fragmentación del ADN espermático tal cual
indica el protocolo del Kit Halomax (HALOTECH DNA SL). Se considera espermatozoides con ADN fragmentado
aquellos con un halo grande y con manchas de dispersión de la cromatina y espermatozoides sin ADN
fragmentado aquellos con un pequeño y compacto halo de dispersión de la cromatina.
ANÁLISIS ESTADÍSTICO.
Los resultados fueron tabulados adecuadamente e ingresados en el software Excel 2007 para ser procesados
en el paquete estadístico SPSS versión 17.0 para Windows. Los resultados serán mostrados como media ±
desviación estándar (DE) y contrastados mediante ANOVA utilizando el test de Levene (para evaluar
homogeneidad de varianzas), test de Kolmogorov-Smirnov (distribución normal de los pesos y concentración
espermática) y el test de Tukey y de Bonferroni para datos paramétricos (morfología, vitalidad e
integridad espermática) con niveles de significancia p<0.05 y p<0.01.
Aspectos éticos
El cuidado y manejo de los animales se realizó de acuerdo con las pautas éticas de la Universidad
Nacional Mayor de San Marcos y del Consejo Nacional de Investigación para el cuidado y uso de animales
de laboratorio(20).
RESULTADOS
No se observaron diferencias significativas en el incremento del peso corporal, peso de los testículos,
epidídimos y próstata (p>0,05) (Tabla I); así como, en la morfología del espermatozoide (no se incluye
en las tablas), entre los grupos analizados durante el experimento. Asimismo, los resultados de la
vitalidad, motilidad, integridad de la membrana y el conteo espermático, se detallan en la Tabla II.
Las diferencias citológicas entre espermatozoides fragmentados y no fragmentados se muestran en la Fig.
1 y 2. En la Fig. 1, que representa al grupo control positivo (solo ciclosfosfamida, 50 mgKg-1 PC) se
observan halos grandes, evidencia de daño al ADN del espermatozoide de ratón en un valor superior a los
de la Fig. 2, donde se ven espermatozoides del grupo 4 (solo ciclofosfamida, 50 mgkg-1 de PC) + extracto
de camu camu (100 mgkg-1 de PC), donde se ven escasos espermatozoides con halo grande. Hay que destacar
que la presencia de flagelo diferencia los espermios de otras posibles células involucradas.
|
GRUPO |
PESO TESTICULAR |
PESO DEL EPIDIDIMO |
PESO DE LA PROSTATA |
|---|---|---|---|
|
Control negativo |
0,1277 ± 0,0025 |
0,0413 ± 0,0012 |
0,0513 ± 0,0022 |
|
Tratamiento 1 |
0,1066 ± 0,0054 |
0,0401 ± 0,0012 |
0,0510 ± 0,0016 |
|
Tratamiento 2 |
0,1121 ± 0,0046 |
0,0219 ± 0,0239 |
0,0500 ± 0,0008 |
|
Tratamiento 3 |
0,1123 ± 0,0033 |
0,0377 ± 0,0021 |
0,0459 ± 0,0017 |
|
Control positivo |
0,0899 ± 0,0691 |
0,0338 ± 0,0028 |
0,0428 ± 0,0029 |
p<0,05 Tratamientos vs control
|
Tratamiento |
Motilidad |
Vitalidad (viables) |
Integridad de la membrana (viables) |
Conteo espermático (millones por ml)a |
|||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
MP |
MNP |
IM |
|||||||||||||||||||||||
|
CN |
54.399±14.311 |
11.623±8.096 |
33.978±10.749 |
60.944±20.221 |
60.342±13.745 |
1.079x106±51.563 |
|||||||||||||||||||
|
CP |
49.564±11.361 |
12.558±9.965 |
37.878±10.624 |
65.722±18.777 |
56.978±14.844 |
1.310x106±25.797 |
|||||||||||||||||||
|
10mgkg-1 |
42.121±20.103 |
12.476±9.508 |
45.403±18.788 |
46.401±31.631 |
51.555±20.636 |
1.059x106±25.658 |
|||||||||||||||||||
|
50mgkg-1 |
29.391±12.306** |
14.559±7.600 |
56.050±14.123** |
40.714±13.082 |
49.289±18.396 |
0.795x106±30.568** |
|||||||||||||||||||
|
100mgkg-1 |
46.297±7.147 |
18.446±7.692 |
35.257±5.886 |
56.787±14.220 |
58.867±9.421 |
1.646x106±29.698 |
|||||||||||||||||||
CN=control negativo; CP=control positivo. MP (Motilidad progresiva rápido y Motilidad progresiva
lenta) Espermatozoide moviéndose activamente en línea recta o círculos sin tomar en cuenta la
velocidad. MNP (Motilidad no progresiva) Espermatozoides que muestren motilidad sin locomoción.
IM (Inmotilidad) Ausencia absoluta de motilidad.
Los valores son expuestos como Media ± SD
**Significativos para p<0.05 en comparación con el control positivo

Figura 1. Resultados del Test Halomax en espermatozoides de ratón tratados con ciclofosfamida (50 mgKg-1 PC). La presencia de halos grandes, evidencia daño en el ADN, signo de fragmentación 400x
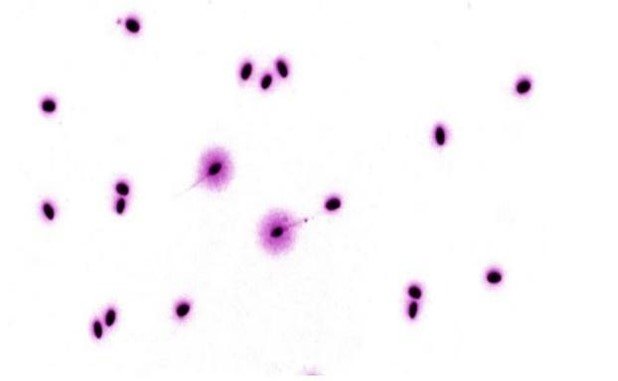
Figura 2. Resultados del Test Halomax en espermatozoides de ratón tratados con ciclofosfamida (50 mgKg-1 PC) y extracto acuoso de camu camu (100mgKg-1 PC). La presencia de opocos espermatozoides fragmentados sugiere el efecto protector del fruto. 400x
DISCUSIÓN
La reproducción y la fertilidad son la base de la continuidad de las especies. Sin embargo, cuando nos
referimos a nuestra propia especie esta premisa va más allá de simplemente cumplir nuestro fin
biológico, puesto que, si bien es cierto, la infertilidad como enfermedad no ocasiona la muerte de los
individuos, sí ocasiona por lo general situaciones que podrían establecerse como carentes de bienestar
psicológico y social(1). Visto desde esta óptica, todo esfuerzo en generar conocimientos que permitan
ayudar a las personas en el objetivo de lograr la concepción deberían ser consideradas prioritarias
desde el punto de vista biológico y clínico.
El efecto protector de las sustancias antioxidantes contra la genotoxicidad puede realizarse de tres
maneras disminuyendo la asimilación de genotoxicantes prooxidantes, previniendo su formación en la dieta
misma; como agente reductor en los lugares de acción de los pro oxidante, induciendo enzimas de
detoxicación capaces de reducir a los intermediarios activos de oxígeno(3-16).
Al analizar el efecto protector del extracto acuoso del fruto de Myrciaria dubia mediante el test de
integridad del ADN espermático se evidenció que no existen diferencias significativas entre CN y los
grupos tratamiento; estos resultado sugiere un efecto protector del extracto acuoso del fruto del
camu-camu frente al daño oxidativo de CP. Por otra parte, se determinó que el suplemento oral con
vitamina C en humanos disminuye el daño al DNA inducido por el peróxido de hidrogeno (H2O2). Estudios in
vivo en células humanas e in vivo en roedores demostraron que altas concentraciones intracelulares de
ácido ascórbico reducen las mutaciones causadas por el estrés oxidativo del KBrO3(20); es probable que
el alto contenido de Acido Ascórbico (vitamina C) presente en el fruto de “camu-camu”, sea la
responsable del efecto protector evidenciado en los resultados al encontrarse un número similar de
células de grado 0 entre T1 y T4.
Es conocido que el CP induce alteraciones permanentes a partir de diferentes tipos de daños que pueden
ser detectados en un test de micronúcleo mediante el bloqueo de citocinesis (22, 23). Estos hallazgos
indicarían que el CP induce a un daño del DNA por una serie de diferentes mecanismos además del estrés
oxidativo.
CONCLUSIÓN
Se concluye que la administración oral de extracto acuoso de “camu camu” podría contrarrestar, modular y
neutralizar los efectos del CP, evidenciado esto en la disminución de la tasa de espermios con daño en
el ADN nuclear en las muestras tratadas.
LIMITACIONES DEL ESTUDIO
Las limitaciones del estudio fueron de naturaleza logística en la institución donde se desarrolló el
trabajo; principalmente de índole de suspensiones de actividades no planificadas durante los fines de
semana (a veces desde el viernes) que perjudico la dosificación y la continuidad del seguimiento de los
animales. Además, la imposibilidad de ingreso los días domingo al pabellón de investigación por falta de
personal de vigilancia. Todo esto ocasiono retrasos y repetición del diseño experimental.
Contribuciones de Autoría:
Los autores participaron en la génesis de la idea, diseño del proyecto, desarrollo,
recolección e interpretación de data, análisis de resultados y preparación del manuscrito.
Financiamiento:
Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos (proyecto con
fondos monetarios, código 151001171)
Declaración de conflictos de intereses:
Los autores declaran no tener conflicto de interés en la publicación de este artículo.
Recibido:
12 de Mayo del 2024
Aprobado:
11 de Julio del 2024
Correspondencia:
José Luis Rafael Pino Gaviño
Dirección:
Av. German Amézaga 375, Cercado Lima-Perú
Teléfono:
992169186
Correo electrónico:
jpinog@unmsm.edu.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/4.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.
