ARTICULO ORIGINAL
REVISTA DE LA FACULTAD DE MEDICINA HUMANA 2024 - Universidad Ricardo Palma10.25176/RFMH.v24i3.6703
CINÉTICA DE LA LIBERACIÓN DEL FACTOR DE CRECIMIENTO DERIVADO DE PLAQUETAS (PDGF-BB) DERIVADO DEL PLASMA RICO EN PLAQUETAS DE CORDÓN UMBILICAL HUMANO
KINETICS OF THE RELEASE OF PLATELET-DERIVED GROWTH FACTOR (PDGF-BB) DERIVED FROM HUMAN UMBILICAL CORD PLATELET-RICH PLASMA
Pedro Aro
 1,2,4,a
1,2,4,a
Ana Peralta
 2,b
2,b
Andrea Rodriguez
 2,b
2,b
Christian Lezama
 2,c
2,c
Carmen Palomino
 2,c
2,c
William Bocangel
 3,d
3,d
Rodrigo Paredes
 4,a
4,a
José Aguilar
 5,e
5,e
1 Servicio de Hemoterapia y Banco de Sangre del Hospital Nacional Cayetano Heredia, Lima, Perú.
2 Universidad Peruana Cayetano Heredia, Lima, Perú.
3 Universidad Científica del Sur, Lima, Perú.
4 Internal Medicine Unit, Mount Sinai Beth Israel Hospital, New York, USA.
5 Laboratorios de Inmunología de la Universidad Peruana Cayetano Heredia, Lima, Perú.
a Médico Cirujano
b Químico Farmacéutico
c Tecnólogo Médico
d Estudiante
e Médico Reumatólogo
RESUMEN
Introducción: El uso de sangre de cordón umbilical (CU) tiene muchas ventajas en la medicina regenerativa. El plasma rico en plaquetas (PRP) es una fuente de factores de crecimiento en donde su dinámica en el tiempo ha sido evaluada en sangre periférica, sin embargo, su evaluación en sangre de CU no ha sido estudiada.
Objetivo: Evaluar la cinética de la liberación del PDGF-BB del PRP obtenido de sangre de CU.
Materiales y métodos: Se realizó un estudio experimental in vitro. Se recolectaron muestras de sangre de CU de 6 partos a término de gestantes sanas que tenían entre 18 y 36 años y que acudieron al Hospital Cayetano Heredia en Lima-Perú. Las muestras obtenidas se centrifugaron a 900 g durante 10 minutos para preparar el PRP. La activación se realizó con gluconato de calcio (GLu.Ca) al 10% y se dividió en 4 alícuotas: (i) sin activador; (ii) 1 hora; (iii) 24 horas; (iv) 48 horas. La cuantificación del PDGF-BB fue evaluada mediante el método de ELISA.
Resultados: La media (desviación estándar) de la concentración de PDGF-BB medida a la hora, 24 horas y 48 horas fue 6127.9 ± 101.6 pg/mL, 6197.5 ± 34 pg/mL y 6176.8 ± 63.3 pg/mL, respectivamente. La cinética del PDGF-BB liberado por el PRP mostró valores constantes durante las 48 horas.
Conclusiones: La liberación de PDGF-BB del PRP obtenido de sangre de CU se indujo rápidamente y se mantuvo constante y de forma mantenida durante las primeras 48 horas luego de su activación.
Palabras clave: Plasma rico en plaquetas; factor de crecimiento derivado de plaquetas; cinética; sangre de cordón umbilical.
ABSTRACT
Introduction: The use of umbilical cord blood (UC) has many advantages in regenerative medicine. Platelet-rich plasma (PRP) is a source of growth factors where its dynamics over time has been evaluated in peripheral blood, however, its evaluation in UC blood has not been studied.
Objective: To evaluate the kinetics of PDGF-BB release from PRP obtained from UC blood.
Materials and methods: An in vitro experimental study was conducted. UC blood samples were collected from 6 term deliveries of healthy pregnant women between 18 and 36 years of age who attended the Cayetano Heredia Hospital in Lima-Peru. The samples obtained were centrifuged at 900 g for 10 minutes to prepare the PRP. Activation was performed with 10% calcium gluconate (GLu.Ca) and divided into 4 aliquots: (i) without activator; (ii) 1 hour; (iii) 24 hours; (iv) 48 hours. PDGF-BB quantification was evaluated by the ELISA method.
Results: The mean (standard deviation) of PDGF-BB concentration measured at 1 hour, 24 hours, and 48 hours were 6127.9 ± 101.6 pg/mL, 6197.5 ± 34 pg/mL, and 6176.8 ± 63.3 pg/mL, respectively. The kinetics of PDGF-BB released by PRP showed constant values during the 48 hours.
Conclusions: PDGF-BB release from PRP obtained from UC blood was rapidly induced and remained constant and sustained during the first 48 hours after activation.
Keywords: Platelet-rich plasma; platelet-derived growth factor; kinetics; umbilical cord blood.
INTRODUCCIÓN
Las plaquetas son componentes sanguíneos que juegan un rol importante en la regeneración celular lo que lleva a cabo a través de la liberación de factores de crecimiento (FC), citoquinas y respuesta inflamatoria(1,2). Los principales FC liberados por los gránulos alfa de las plaquetas son el factor de crecimiento derivado de plaquetas (PDGF) y el factor de crecimiento transformante-β (TGF-β), responsables de la quimiotaxis celular y angiogénesis y producción de matriz extracelular(3,4). El factor de crecimiento epidérmico (EFG, proliferación de fibroblastos) y el Factor decrecimiento vasculo endotelial (VEGF, angiogénesis) son otros factores liberados por las plaquetas que en su conjunto van a cumplir una función importante en la hemostasia, proliferación y remodelación de las diferentes fases dela cicatrización de heridas(5).
La terapia con plasma rico en plaquetas (PRP) debido a su potencial de proporcionar una gran cantidad de FC, ha ganado popularidad en la medicina regenerativa(6). El PRP es un tipo un componente sanguíneo de sangre autóloga que contiene una alta cantidad de plaquetas y habitualmente es obtenido de sangre periférica(7); además es utilizado en diferentes campos clínicos como traumatología, oftalmología, odontología, cirugía estética y curación de heridas siendo usado como terapias para mejorar la regeneración de tejidos(8). A pesar de esto, su uso tiene algunos inconvenientes por ejemplo en la forma de obtención, ya que puede provocar dolor o lesión en nervios o vasos sanguíneos en la zona de punción(9,10), además en pacientes con enfermedades cuyo sistema inmune está comprometido existe una expresión anormal de factores de crecimiento y podría no cumplir con su función de regeneración(11).
El PRP también se puede obtener fácilmente de cordón umbilical (CU), la comparación entre la obtención de sangre periférica y CU van a diferir tanto en el tipo como en la cantidad de factores de crecimiento que contienen(12). Estudios mencionan que el PRP obtenido de CU, tiene ventajas terapéuticas sobre el obtenido de sangre periférica ya que contiene mayor cantidad de FC. Buzzi et al(13), comparó el contenido de FC de sangre de CU y periférica encontrando niveles más altos de EFG, TGF-β, PDGF y VEGF en muestras de CU, esto es demostrado de la misma forma por Murphy et al(3) y Parazzi et al(14), el primero mostró valores más elevados de PDGF-BB y VEGF (p<0.01) en el PRP de sangre de CU mientras que el segundo reportó concentraciones elevadas de factores angiogénicos (VEGF, hormona de crecimiento, eritropoyetina y resistina) en gel plaquetario preparado de sangre de CU a diferencia de sangre periférica.
La concentración de los FC liberados del PRP varían con el tiempo, siendo el estudio de la cinética la que determina la rapidez en llegar a su máxima concentración(15). Roh et al(2), utilizando PRP de sangre periférica observó que los niveles de factores como el PDGF-BB y VEGF se mantuvieron constantes durante 7 días mencionando que estos hallazgos serían útiles al indicar el tratamiento con PRP en medicina regenerativa. A pesar del uso difundido del PRP con FC para mejorar la cicatrización y la regeneración de tejidos se conoce poco sobre su cinética obtenido de sangre de CU. Este estudio podría dar luces sobre su comportamiento y su posible utilidad terapéutica, por lo que el objetivo de este estudio es evaluar la liberación del PDGF-BB del PRP obtenido de sangre de CU en diferentes momentos tiempo
MÉTODOS
Diseño y área de estudio
Se realizó un estudio experimental in vitro para evaluar la cinética
de la
liberación del factor de crecimiento PDGF-BB en el PRP obtenido de sangre de CU de partos a término
atendidos en el Servicio de Obstetricia y Ginecología del Hospital Nacional Cayetano Heredia durante el
mes de mayo del 2023.
Población y muestra
Se recolectaron muestras de sangre de CU de 6 partos a término de
gestantes que tenían entre 18 y 36 años sanos y que previamente aceptaron su participación y firmaron un
consentimiento informado. Las gestantes con antecedente de trastornos sanguíneos, trastornos metabólicos
(diabetes mellitus, obesidad, etc.), hemoglobina < 11gr/dl, plaquetas < 150 x 103 uL, enfermedades
autoinmunes, medicación concomitante como antiagregantes plaquetarios, uso de corticoesteroides o
antinflamatorios no esteroideos en los últimos 15 días, proceso inflamatorio o infeccioso por historia
clínica fueron excluidos del estudio.
Procedimientos
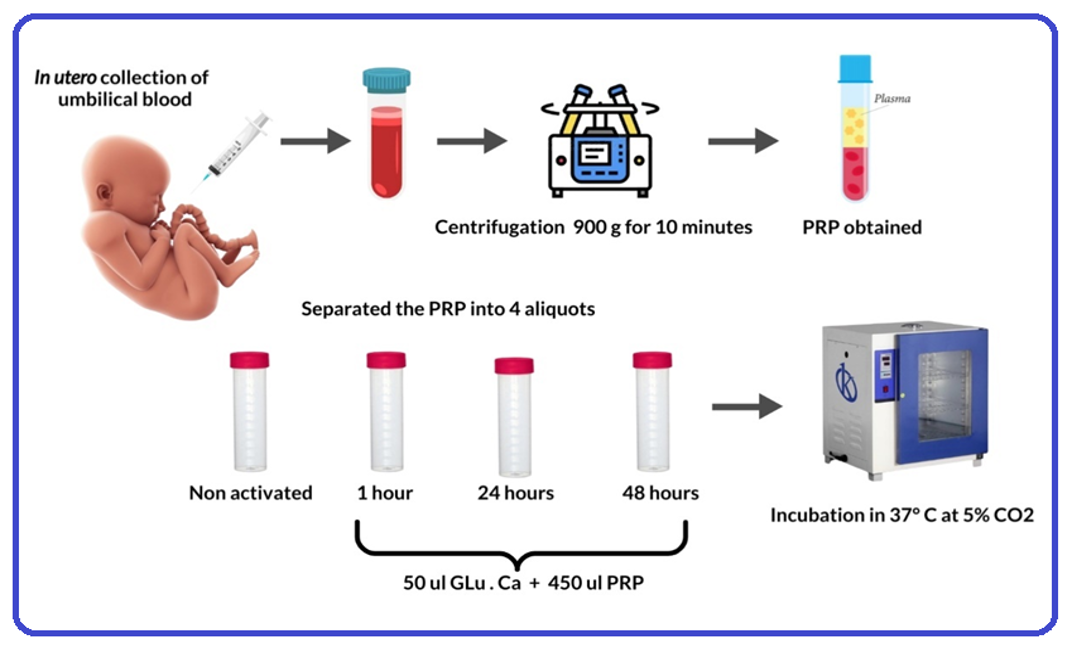
Obtención de la sangre de cordón umbilical
Se realizó una
recolección in útero, en donde una vez que el recién nacido nace y es evaluado; se pinza y se corta el
cordón realizando la recolección. Se recolectaron 7cc de sangre de cordón umbilical en tubos con
anticoagulante citrato de sodio 3.2% tras punción con una jeringa en la vena umbilical, este
procedimiento duro menos de 5 minutos. Posteriormente las muestras fueron llevados al Servicio de
Hemoterapia y banco de Sangre para su proceso, en donde se procedió al conteo de plaquetas basales antes
de la centrifugación en el analizador hematológico CELL-DYN Emerald de Abbott.
Preparación y activación del PRP
Las muestras obtenidas fueron centrifugadas a 900 g
por 10 minutos. Luego de la centrifugación, se separó la tercera parte inferior del plasma obtenido que
corresponde al PRP y se llevó a un tubo de vidrio estéril para proceder a realizar el conteo de
plaquetas post-centrifugación. Posteriormente se realizó la activación del PRP con gluconato de calcio
10% (Glu.Ca) al 10%, para esto primero se dividió en 4 alícuotas y se rotuló de la siguiente forma (i)
sin activador. (ii) 1 hora. (iii) 24 horas. (iv) 48 horas. Se añadió en una proporción de 1/10, 50 uL de
Glu.Ca y 450 uL de PRP en las alícuotas (ii), (iii) y (iv). Cada grupo excepto el (i) fue incubado a 37°
a 5% CO2 por 1 hora, 24 horas y 48 horas según corresponda. Luego de cumplido el tiempo fueron
almacenados en una congeladora de -40°C para realizar posteriormente la medida del PDGF-BB (figura
1).
Figura 1: Flujo de trabajo para la recolección, procesamiento y distribución del PRP de sangre de cordón umbilical Fuente: Elaboración propia.
Cuantificación del PDGF-BB
La determinación del PDGF-BB se realizó con el uso del Human PDGF-BB ELISA Kit (Número de producto: RAB0397; Número de Lote: 1128JO180) de la marca Sigma Aldrich, el cual utiliza la metodología de ELISA tipo Sandwich. Se realizó la preparación del estándar según especificación del inserto. Luego mediante dilución seriada se obtuvo la curva estándar. Las diluciones de la curva estándar fueron realizadas por duplicado, obteniéndose los valores promedios para cada dilución, previa sustracción del blanco como control, para la construcción de la curva estándar de los valores leídos en un lector de ELISA BioTek 50 TS (Merck) a una absorbancia de 450 nm (eje x) vs concentración de PDGF-BB (eje y) obteniendo la fórmula y = 161.46x - 21.938 con lo que se calculó los valores de PDGF-BB. El coeficiente de variación (CV) intraensayo fue inferior al 10% e inferior a 12% interensayo. El límite de detección fue de 1 pg/ml. Con un rango de la curva estándar de 0.549-400 pg/ml.
Análisis estadístico
Se evaluó la distribución de las variables utilizando métodos gráficos y numéricos. Para determinar la normalidad se realizó la prueba de Shapiro-Wilk. Las variables numéricas se presentaron como media ± desviación estándar ya que presentaron una distribución normal. Para el análisis estadístico se utilizó el programa estadístico STATA versión 17 para Windows (StataCorp LP, College Station, Texas, Estados Unidos). Los gráficos se realizaron en el programa GraphPad Prism Versión 8.
Aspectos éticos
Este estudio fue aprobado por el Comité de Ética de la Universidad Peruana Cayetano Heredia (Constancia E-043-09-23) y el Comité de Ética del Hospital Cayetano Heredia (Constancia N°160-2022). Las gestantes firmaron un consentimiento informado antes de la realización de los procedimientos de este estudio.
RESULTADOS
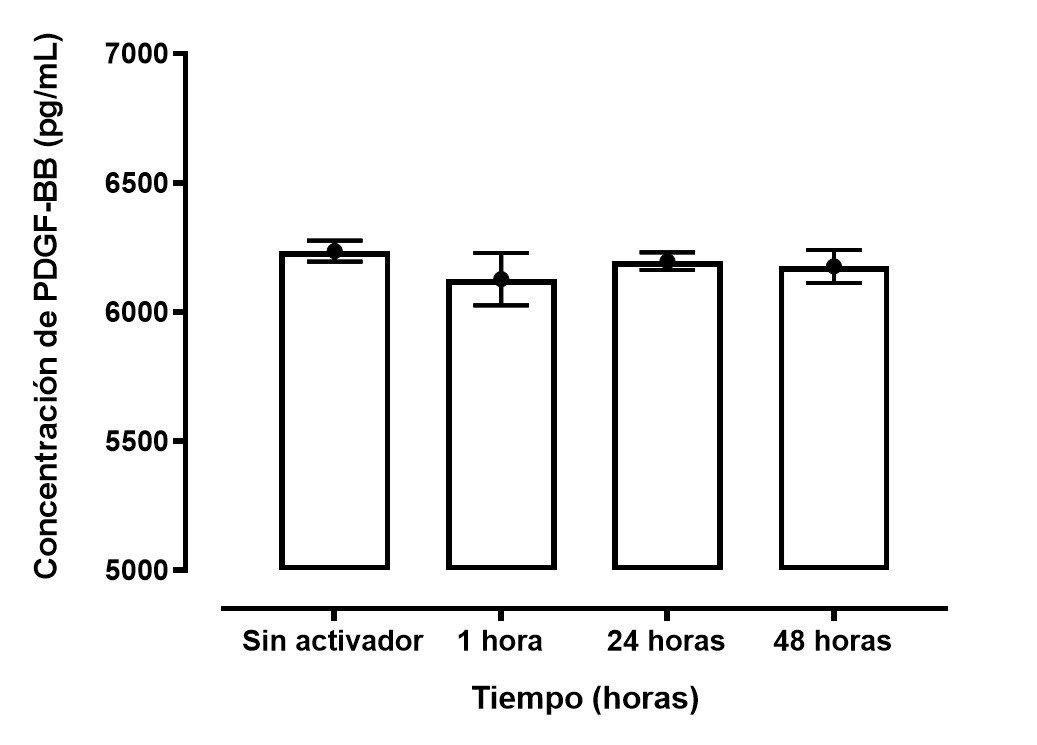
Se recogieron un total de 6 muestras de sangre de cordón umbilical de gestantes a término las cuales tenían una edad media ± desviación estándar (SD) de 22.1 ± 3.8. La concentración media (SD) de plaquetas post-centrifugación fue mayor que antes de centrifugado (617.2 ± 88.9 vs 221.2 ± 42.3). La liberación de PDGF-BB fue constante y sostenida durante los periodos de tiempo medido a 1 hora, 24 horas y 48 horas (6127.9 ± 101.6 pg/mL, 6197.5 ± 34 pg/mL y 6176.8 ± 63.3 pg/mL respectivamente), además se añadió como control una muestra sin Glu.Ca 10% como se observa en la tabla 1.
|
Características |
Media ± SD |
|---|---|
| Edad (años) | 22.1 ± 3.8 |
| Plaquetas pre-centrifugación (10^3 uL) | 221.2 ± 42.3 |
| Plaquetas post-centrifugación (10^3 uL) | 617.2 ± 88.9 |
| Concentración de PDGF-BB (pg/ml) | |
| Sin activador | 6236.8 ± 40.5 |
| 1 hora | 6127.9 ± 101.6 |
| 24 horas | 6197.5 ± 34 |
| 48 horas | 6176.8 ± 63.3 |
PDGF-BB: factor de crecimiento derivado plaquetas tipo BB.
SD: desviación estándar.
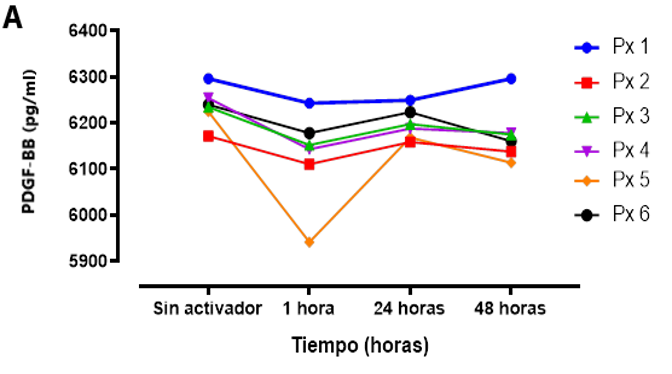
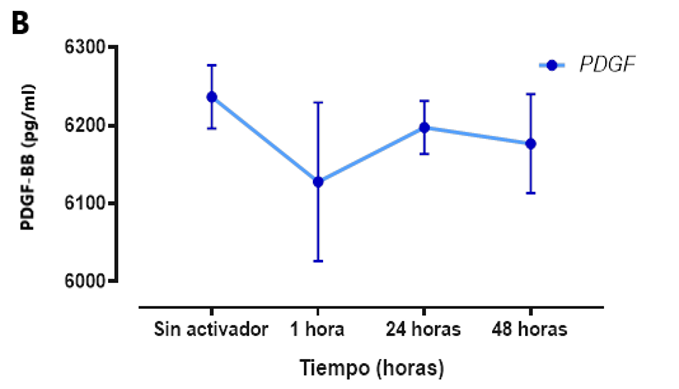
La concentración de PDGF-BB de las muestras medidas en determinados momentos estuvo por encima de los 6000 pg/ml figura 3. Se observó la dinámica de la liberación del PDGF-BB la cual se indujo rápidamente, pero se mantuvo constante y mantenida durante la primera hora, 24 horas y 48 horas luego de su activación, cabe mencionar que la misma tendencia se observó en el grupo que no se realizó activación con Glu.Ca. En la figura 3 (A) se observa la variabilidad de la liberación del PDGF-BB por cada muestra mientras que en figura 3 (B) se observa la variabilidad usando el promedio de la liberación de PDGF-BB luego de 1 hora, 24 horas y 48 horas luego de su activación.
Figura 2: Concentración de PDGF-BB obtenido del PRP de sangre obtenida de CU según la medida en diferentes tiempos (1 hora, 24 horas y 48 horas).
(A) se observa la cinética del PDGF-BB por cada muestra obtenida en determinado tiempo.
(B) se observa la cinética del PDGF-BB con el promedio de cada muestra obtenida en determinado tiempo.
DISCUSION
El presente estudio muestra la primera estimación de la cinética de la liberación del PDGF-BB en el PRP obtenido de sangre de CU, y cómo hallazgo principal se observó que este GF tuvo una concentración mantenida y constante durante las primeras 48 horas luego de su activación, además se observó concentraciones elevadas de PDGF-BB a diferencia de lo mostrado en la literatura con respecto a los rangos obtenidos de sangre periférica(1, 2).
El PRP se utiliza como fuente de factores de crecimiento los cuales juegan un papel muy importante en la regeneración de tejidos(3). Diferentes autores mencionan que la mediana de las concentraciones de PDGF-BB en sangre de sujetos sanos es aproximadamente 4ng/ml(19, 20), pero las concentraciones de los FC van a ser variables según la forma y método de obtención del PRP. Munawirah et al(21), realizaron un estudio para cuantificar PDGF-BB en el PRP de sangre periférica usando para su obtención tubos de ácido etilendiaminotetraacético (EDTA) y diferentes métodos de centrifugación obteniendo concentraciones medias entre 8330,86 pg/ml y 5206,75 pg/ml; de la misma forma, Amable et al(22), observaron que en el PRP activado con cloruro de calcio (ClCa2) y obtenido en tubos con citrato 3.2% mostró concentraciones de PDGF-BB de 20.1±10 ng/ml, siendo similar a lo mostrado por Lee et al(16), que obtuvieron una concentración de PDGF-BB obtenido del PRP activado de sangre periférica de 37.15±1.62 ng/ml. Estas variaciones también pueden ser observadas en las concentraciones de PDGF-BB obtenidas de sangre de CU. Yan et al(23), caracterizaron el PDGF-BB obtenido de lisado plaquetario de sangre de CU obteniendo una media de 7.62±1,29 ng/ml, mientras que en el estudio de Murphy et al(3) observaron concentraciones elevadas de más de 100 000 pg/ml para el PDGF-AA/BB obtenido del PRP de sangre periférica y CU activadas con calcio pero valores menores en las que no fueron activadas. Asimismo, Buzzi et al(13), mostraron valores de PDGF de 3233.2 (3461.7-4274.3) pg/ml siendo su recolección a través de bolsas usadas para donación de sangre, siendo este último con hallazgos similares a nuestro estudio. Las condiciones óptimas para la liberación de FC aún permanecen sin resolver(24). La variación mostrada en nuestros resultados comparándolo con los diferentes estudios podría estar basado en muchos factores como: la edad y el sexo del paciente, el método de obtención, el recuento de plaquetas, el método de preparación y los insumos usados para su activación y medición(25).
La mayoría de estudios de la cinética de factores de crecimiento se han realizado en el PRP obtenido de sangre periférica. Nuestros resultados muestran valores constantes y sostenidos de PDGF-BB durante las primeras 48 horas con valores por encima de 5000 pg/ml, los cuales son superiores al estudio realizado por Roh et al(2), en donde reportaron valores constantes de PDGF-BB en el PRP de sangre periférica durante los primeros 7 días en donde la activación con Glu.Ca indujo valores más de 1000 pg/ml , esto también fue observado por Mariani et al(26), los cuales muestran concentraciones constantes por debajo de 5000 pg/ml de PDGF-AA/BB durante 168 horas. En contraste, Roffi et al(27), muestran valores elevados liberados de PDGF-AA/BB a la hora de 27714.68(18591.5-35850.24) pg/ml y a los 7 días de 31670.63 pg/ml (18617.58–80462.27), esto podría ser debido a la cantidad de sangre que recolectó para la preparación del PRP (150 ml). Los periodos de incubación realizados en este estudio se realizaron en función de los conocimientos actuales sobre el inicio de los procesos angiogénicos y osteogénicos que se producen en el trascurso de los días(2, 28), por lo que nuestros datos al mostrar valores sostenibles del FC podrían ser fundamental para decidir los momentos de aplicación de PRP. Un hallazgo importante en nuestro estudio son las concentraciones observadas de PDGF-BB en el PRP sin estimulación, el cual es casi similar a lo obtenido agregando Glu.Ca al 10%, esto pudo deberse por la manipulación manual, la temperatura y la presión a la que se somete la plaqueta dentro de la aguja, lo cual también podría estimular su liberación(29).
El PDGF es un FC el cual se libera de plaquetas durante el proceso de coagulación sanguínea interviniendo en los procesos normales de cicatrización y reparación de tejidos(30), presenta 4 isoformas: A, B, C y D(31). El PDGF- BB es la isoforma más típica y tiene como función la reparación y proliferación celular, estimulando la angiogénesis y la síntesis de colágeno por lo cual juega un rol importante en la cicatrización de los tejidos(32). La Food and Drug Administration (FDA) establece que este FC es seguro y sus formulaciones han sido aprobadas para curación de ulceras en pie y en regeneración ósea(33). Las inyecciones de PRP que incluyen diferentes FC (incluido el PDGF-BB) ha mostrado beneficios en lesiones osteotendinosas, pero su limitación es que aun no hay control de la cantidad y el momento en que deben ser administrados (31). Debido a lo mencionado anteriormente, este estudio utilizó específicamente para la valoración de la cinética del PDGF-BB y mostrar la dinámica de su comportamiento a través del tiempo.
LIMITACIONES Y FORTALEZAS
Nuestro estudio tiene limitaciones. En primer lugar, nuestro diseño experimental solo midió las concentraciones de PDGF-BB en 3 momentos de tiempo, existiendo la posibilidad de que sus valores aumenten en próximos días como es mostrado en algunos estudios(2). En segundo lugar, el PDGF-BB solo se midió según puntos de tiempo, pero no tuvo en cuenta su agotamiento o descomposición la cual puede deberse a desnaturalización, oxidación o proteólisis, lo cual no se logró evaluar en este estudio(34). En tercer lugar, la diferencia observada en nuestros valores de PDGF-BB obtenidos a diferencia de otros reportes puede haber estado influenciado por diferentes factores de activación o el método de centrifugación usado en este estudio influyendo en la cinética. En cuarto lugar, no se ha informado sobre una valoración directa de la cinética del PDGF-BB del PRP obtenido en sangre de CU, por lo que nuestros resultados fueron comparados con estudios basados en PRP obtenido de sangre periférica. En quinto lugar, la obtención (tubos con aditivo) y el transporte de las muestras hasta su proceso podría haber influido en el concentrado de plaquetas en términos de estructura, exposición a enzimas de degradación y liberación de FC(35). Finalmente, debido a la cantidad de muestras obtenidas solo se obtuvo datos descriptivos y no se realizó un análisis estadístico más representativo. Sin embargo, la fortaleza de este estudio es que es el primer estudio que valora la cinética del PDGF-BB utilizando el PRP obtenido de CU y además que estos resultados podrían dar luces para futuras investigaciones en el campo de la medicina regenerativa.
CONCLUSIONES
En conclusión, nuestro estudio muestra que la liberación PDGF-BB del PRP obtenido de sangre de CU se indujo rápidamente y se mantuvo constante y de forma sostenida durante las primeras 48 horas luego de su activación, además se observó concentraciones por encima del rango normal reportado en la literatura. La sangre de CU podría ser una alternativa para la obtención de PRP pudiendo ser de utilidad para su uso en medicina regenerativa ya que tiene propiedades únicas que podrían usarse de manera terapéutica para diversas afecciones oculares, también como adyuvante para ayudar a la cicatrización de heridas cutáneas y procesos de regeneración articular.
Declaración de conflicto de interés: Los autores declaran no tener conflicto de
interés.
El presente estudio forma parte de la tesis: Peralta A y Nisi A. Evaluación de la cinética
de liberación del factor de crecimiento derivado de plaquetas (PDGF-BB) del plasma rico en
plaquetas obtenido de sangre de cordón umbilical [Tesis para optar el título profesional de
Químico Farmacéutico]. Lima: Facultad de Ciencias e Ingeniería, Universidad Peruana Cayetano
Heredia; 2023.
Contribuciones de autoría:
PA, AP y AN participaron en la conceptualización, investigación, metodología y
estadística, recursos, redacción y aprobación de versión final.
CL participó en la conceptualización, metodología y estadística y aprobación de versión
final.
CP y WB participaron en la investigación y obtención de recursos.
RP y JA participaron en la revisión crítica del articulo y aprobación de versión final.
Financiamiento: El estudio fue financiado por los autores.
Recibido: 15 de febrero del 2024
Aprobado: 20 de mayo del 2024
Correspondencia: Pedro Aro
Dirección: Av. Honorio Delgado 430, San Martín de Porres. Lima, Perú.
Teléfono: (01) 319-0000 - 980815956
Correo electrónico: pedro.aro.g@upch.pe
Artículo publicado por la Revista de la Facultad de Medicina Humana de la Universidad Ricardo Palma. Es un articulo de acceso abierto, distribuido bajo los términos de la Licencia Creatvie Commons: Creative Commons Attribution 4.0 International, CC BY 4.0(https://creativecommons.org/licenses/by/4.0/), que permite el uso no comercial, distribucion y reproducción en cualquier medio, siempre que la obra original sea debidamente citada. Para uso comercial, por favor póngase en contacto con revista.medicina@urp.edu.pe.