Introducción
El tumor fibroso solitario (TFS) es uno infrecuente, con una tasa de incidencia de 2.8 casos por 100 000 habitantes, que afecta sobre todo a la pleura, por lo general benigno y de hallazgo incidental; los de gran tamaño son los que causan síntomas
1, 2
. Rara vez, este tumor presenta síndromes paraneoplásicos, como la hipoglicemia persistente; esta asociación se denomina síndrome de Doege – Potter
2, 3
. El tratamiento definitivo de esta patología es la resección quirúrgica del tumor, idealmente previo diagnóstico y clasificación a través de una biopsia
4
.
A continuación, se presenta un caso de una paciente con el síndrome de Doege – Potter, quien fue diagnosticada y tratada en el Hospital Nacional Hipólito Unanue de Lima, Perú.
Reporte de Caso
Paciente mujer de 70 años, procedente de Huancavelica, Perú, sin antecedentes patológicos personales ni familiares relevantes; ingresó a hospitalización del departamento de Neumología del Hospital Nacional Hipólito Unanue, con un tiempo de enfermedad de cuatro años, cursó con tos productiva con esputo mucoide, dolor tipo opresivo en hemitórax izquierdo y disnea de incremento progresivo. Los familiares notaron que, desde 10 meses atrás, la paciente cursaba con episodios de desorientación, agitación psicomotriz o somnolencia, cada vez más frecuentes
Al ingreso, se encontró en el examen físico amplexación disminuida en hemitórax izquierdo, matidez y murmullo vesicular disminuido en tercio inferior del hemitórax izquierdo. No se evidenció alteraciones en el examen neurológico.
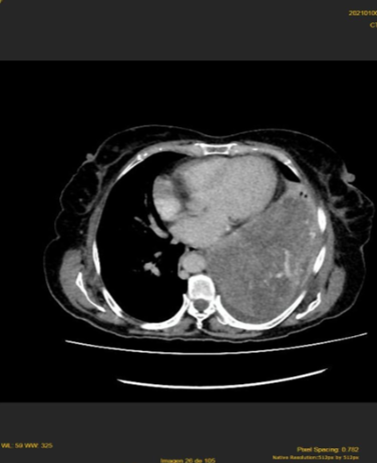
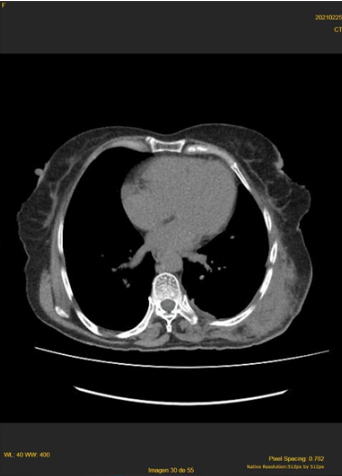
En la radiografía de tórax, se observó una radiopacidad homogénea en la mitad inferior del campo pulmonar izquierdo y en la tomografía espiral multicorte toraco – abdominal, una extensa tumoración sólida en los 2/3 inferiores del hemitórax izquierdo, desplazando caudalmente el hemidiafragma y estructuras intrabdominales, de 200 x 156 x 165 mm, con realce significativo al contraste. No hubo infiltración a estructuras óseas, pared torácica y órganos viscerales ni adenopatías mediastínicas. Se observó efusión pleural izquierda (figura 1). En el abdomen, no se hubo alteraciones, salvo el desplazamiento caudal del hemidiafragma, bazo y riñón izquierdo
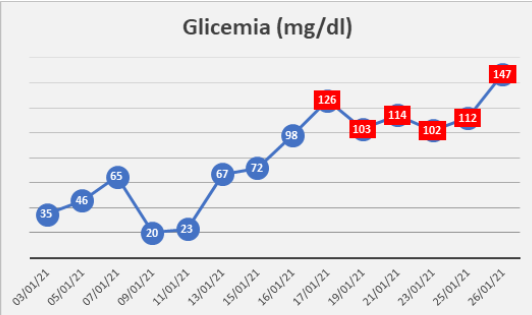
En los exámenes de laboratorio, se reportaron los valores de péptido C en 0.8 ng/ml (1.1 – 4.4), insulina basal en 0.2 U/ml (2.6 – 24.9), CA125 en 97.87 U/mL (<33.0 U/ml), CA 15-3 en 8.06 U/ml (0 – 28.5), CA 19.9 en 12.56 U/ml (0 – 34) y CEA en 4.11 ng/ml (<5.00). Además, cursó con hipoglicemia repetitiva (tabla 1), motivo por el que requirió infusión continua de dextrosa vía intravenosa. Los otros exámenes se encontraban dentro de límites normales.
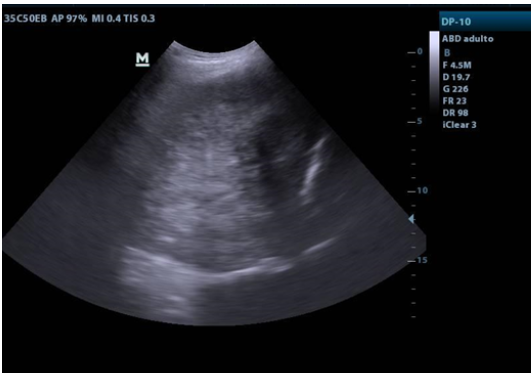
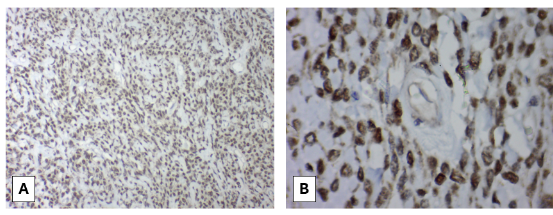
Se realizó una biopsia transtorácica ecodirigida con aguja gruesa 18G x 16cm. con trocar (figura 2). En el estudio histopatológico, se reportó tumor fibroso solitario (figura 3) y la inmunohistoquímica fue positiva a STAT6 (figura 4).
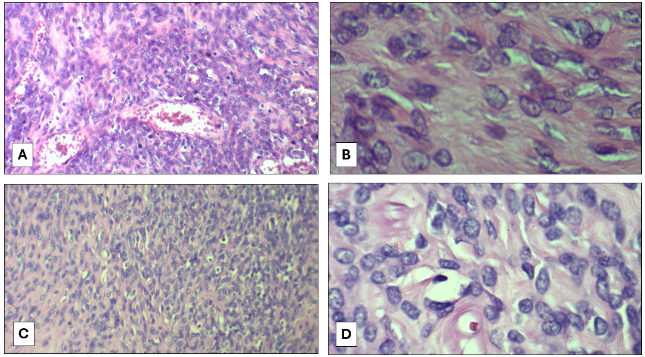
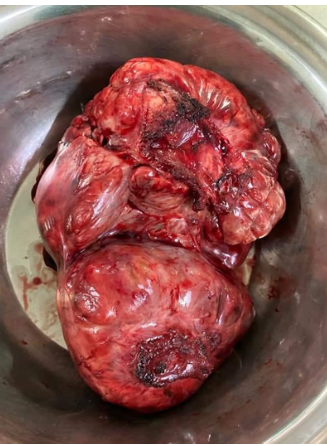
Con estos resultados, la paciente fue sometida a toracotomía, con exéresis de tumoración gigante y resección parcial de hemidiafragma izquierdo (figura 5). En el estudio de anatomía patológica, se observó, macroscópicamente, una tumoración pleural de 4230 g, de 27 x 20 x 14 cm, de superficie lisa de color pardo claro, brillante, lobulada y con la microscopía, se confirmó el diagnóstico obtenido por biopsia transtorácica de tumor fibroso solitario con áreas de hipercelularidad y otras hipocelulares, con necrosis focal en el 10 % y mitosis hasta 2/10 HPF. El resultado de inmunohistoquímica fue positivo a STAT6.
Los valores de glucosa sérica, luego de la extirpación de la tumoración torácica, se normalizaron (tabla 1) y 23 días después de la hospitalización, y con evolución favorable, la paciente fue dada de alta. En los controles ambulatorios, la paciente se mantenía asintomática, con control tomográfico a los 30 días sin evidencia de recidiva (figura 6).
La paciente, después de la recolección de datos, se dirigió a Huancavelica; se conversó con ella y aceptó verbalmente la publicación del presente caso; se le indicó que se mantiene la confidencialidad de sus datos personales.
Discusión
El tumor fibroso solitario (TFS) es mesenquimatoso fibroblástico poco común, descrito por primera vez a nivel pleural, zona de afectación más frecuente, y fue documentado en casi todos los sitios y órganos anatómicos
1, 2
. El 10 % de los casos son extratorácicos; el más común es a nivel abdominal
1, 2
. La tasa de incidencia es de solo 2.8 casos por 100 000 habitantes y la mayoría de estos se presenta en la sexta y séptima década de la vida, lo que afecta a ambos sexos por igual
1, 2
. Un menor número de los casos son malignos y el 90 %, aproximadamente, benignos
3, 4
.
Entre el 50 y 80 % de casos se presentan de manera asintomática, por lo que el hallazgo se da incidentalmente en imágenes radiológicas
2
. Habitualmente, se presentan como masas indoloras de crecimiento lento y, en algunos casos, pueden presentar síntomas, debido al efecto de masa o presión sobre estructuras adyacentes
1
. La sintomatología suele ser variable, se presenta disnea, dolor torácico, tos o hemoptisis
1, 2, 5
.
En pocas ocasiones, el TFS se puede presentar con síndromes paraneoplásicos; el más descrito es la hipoglicemia inducida por tumor de células no islotes (NICTH), conocido como el síndrome de Doege – Potter
1
. Este se caracteriza por hipoglicemia persistente refractaria, insulina sérica suprimida, hormona del crecimiento y péptido C sérico bajos, con una mayor producción tumoral de factor de crecimiento similar a la insulina 1 (IGF-1) y niveles de IGF-2 normales o elevados
2, 6
. El IGF-2 podría inducir la hipoglucemia al unirse con los receptores de insulina de los tejidos diana, transporta glucosa a los músculos e inhibe la gluconeogénesis en el hígado y la lipólisis en los adipocitos
2
. La mayoría de tumores asociados a hipoglucemia son de gran tamaño, lo cual sugiere que los efectos de la hipoglucemia tienen relación directa con el tamaño del tumor
5
. La hipoglucemia se observa con más frecuencia en mujeres que en hombres y cuando el tumor se localiza en el hemitórax derecho
7
. Tras la resección de la tumoración, desaparece gradualmente la sintomatología que pueda presentar el paciente, por lo que se considera el tratamiento definitivo
2
.
El tamaño de la tumoración es variable y es más común encontrarlo en la cavidad pleural derecha con un tamaño que logra superar los 20 cm de diámetro
3, 8
. Son bien circunscritos, de superficie lisa y muchas veces en forma lobulada
1, 9
. Las tumoraciones a nivel pleural y abdominal tienden a ser de mayor tamaño que en otras localizaciones
7
.
Los estudios por imágenes tienen un papel importante en el diagnóstico; en las radiografías de tórax se puede evidenciar masas de tamaño variable, bien delimitadas, en ocasiones asociadas a derrame pleural
5
. La tomografía computarizada con contraste suele mostrar una tumoración de baja densidad con abundante irrigación vascular, bien circunscrita, con áreas de necrosis, si son de gran tamaño
1
.
Son de gran variedad histológica, compuestos por células con núcleos ovoides a fusiformes, dentro de un estroma de colágeno con áreas de hialinización densa
1, 10
. La actividad mitótica del tumor no es alta, generalmente menos de 5 mitosis por 2 mm2; una mayor mitosis e hipercelularidad suelen ser los signos de agresividad del tumor
7, 13
. Los estudios de inmunohistoquímica y diagnóstico molecular son de gran importancia para el diagnóstico; entre los marcadores, se encuentran CD34, vimentina, CD99, BCL2, que se expresan de forma variable en el TFS
1, 8, 14
. Se debe tener en cuenta que estos marcadores pueden encontrarse positivos en otras neoplasias de diferenciación mesenquimatosa, por lo que el hallazgo del marcador molecular de fusión genética entre NAB2 Y STAT6 de patrón nuclear, al ser altamente específico y sensible, ha permitido diferenciarlo de otras tumoraciones
1, 11
. El producto STAT6 – NAB2 es el resultado de una inversión en el locus 12q13 que induce la expresión de la respuesta de crecimiento temprano, lo que demuestra la reacción en cadena de la polimerasa presente en un 90 % de los casos de TFS
1
.
La realización de una biopsia previa al tratamiento para diagnosticar y clasificar la tumoración es lo ideal para llegar a un diagnóstico certero
12
. Se ha empleado la biopsia por aspiración con aguja fina, biopsia transtorácica con aguja gruesa y la biopsia incisional abierta; sin embargo, se tiene una baja rentabilidad diagnóstica con las biopsias transtorácicas y de aspiración con aguja fina; algunas series tienen una tasa de éxito del 43 %
1
. La rentabilidad diagnóstica disminuye en lesiones a partir de 5 centímetros, ya que hay mayor probabilidad de que tengan necrosis y mayor de que se obtengan muestras no satisfactorias
12
. La biopsia guiada por ecografía de una lesión torácica de base pleural tiene una precisión diagnóstica similar a la guiada por tomografía, con menor tasa de complicaciones y menor tiempo de procedimiento
13
.
El abordaje terapéutico debe ser multidisciplinario
2
. El tratamiento inicial debe incluir el uso de glucocorticoides, vía oral o endovenosa, para evitar la hipoglucemia
10
. El pilar del tratamiento consiste en la resección quirúrgica completa
2, 3, 4
. En caso se requiera mayores intervenciones quirúrgicas por recurrencia, cada vez sería más desafiante, ya que se podría encontrar mayores adherencias
14
. Para evitar esto, se tienen terapias coadyuvantes de tratamiento que incluyen quimioterapia, radioterapia, crioablación o embolización, las cuales su uso no es en todos los casos
7, 10
. La opción quirúrgica depende de la ubicación de la tumoración y de las estructuras involucradas
3
. Su realización se asocia a una baja tasa de recurrencia local y de progresión
1
. En caso de tumoraciones altamente vascularizadas, se puede considerar la terapia de embolización seguida de la resección quirúrgica para disminuir el riesgo de sangrado
2
. La radioterapia o quimioterapia no se recomienda de uso rutinario, debido a la limitación de datos por su incidencia relativamente baja
2, 8, 12
. El uso de estas terapias se ha asociado a una pobre respuesta
11
. Se ha identificado que la malignidad está relacionada a tener tres o más de estos seis factores: La localización pleural parietal, tamaño ≥ 10 cm, hipercelularidad, atipia nuclear, ≥4 mitosis/10 campos de gran aumento y/o necrosis
15
. La hipoglucemia se asocia a malignidad, por lo que es un indicador de mal pronóstico; sin embargo, luego del tratamiento quirúrgico, se obtienen resultados satisfactorios, que incluye una tasa libre de recurrencias en los cinco años en aproximadamente 80 % de los casos
7
. Sin embargo, la tasa de recurrencia de malignidad se ha reportado en un 63 % de los casos, por lo que el seguimiento a largo plazo es esencial para la detección temprana de enfermedad recurrente o metastásica
14
. El periodo de seguimiento recomendado es de cada tres o seis meses por dos años y, posteriormente, de manera anual, el cual se debe realizar con tomografía computarizada
14
. Debido a la baja incidencia, no existen pautas estandarizadas para su vigilancia, por lo que debe ser individualizada de acuerdo a la ubicación del tumor y otros factores propios del paciente
1
.
La paciente del caso clínico se encontró dentro del grupo etario de presentación más frecuente de esta rara patología, sintomática por el tamaño del tumor (27 cm en su diámetro mayor y poco más de 4 kg de peso) y por la hipoglicemia persistente a pesar del tratamiento instaurado. La tumoración de la paciente estaba en el hemitórax izquierdo; la localización más asociada fue la hipoglicemia en el hemitórax derecho. El dosaje de péptido C e insulina sérica estaban por debajo de los límites normales, lo que es muy frecuente en el síndrome de Doege-Potter
2
.
Los hallazgos tomográficos fueron similares a los descritos en las revisiones. A pesar de la poca rentabilidad, el diagnóstico se obtuvo a través de una biopsia transtorácica con aguja gruesa ecodirigida
3
. El reporte histopatológico de la biopsia y, posteriormente, el reporte anatomopatológico de la pieza quirúrgica son semejantes a lo que se describe en la bibliografía. Estos hallazgos y el resultado de la inmunohistoquímica, con STAT6 positivo, son concluyentes para el diagnóstico de esta entidad
4
.
Luego de la extirpación del tumor, se evidencia la remisión de la hipoglucemia y no se repiten los episodios de desorientación o somnolencia, resolviendo el síndrome de Doege-Potter
5
. Aunque no se observa infiltración y baja actividad mitótica, el gran tamaño del tumor y su asociación con derrame pleural requiere seguimiento a largo plazo, ya que algunos casos se asocian a recurrencia o degeneración maligna
6
.
Figura 1
Tomografía espiral multicorte toraco – abdominal del 06/01/2021: Extensa tumoración sólida heterogénea de 200 x 156 x 165 mm. en campo pulmonar izquierdo, con realce al contraste, sin infiltración de estructuras óseas o pared torácica. Efusión pleural izquierda.
Figura 2
Ecografía torácica: Masa ecogénica visible a través de la cara posterior del hemitórax izquierdo, compleja y delimitada, realizada para la biopsia percutánea con aguja gruesa ecodirigida
Figura 3
Patrón histológico característico (H&E) del tumor fibroso solitario. A: (10x) Proliferación de células fusiformes. B: (40x) Presencia de abundantes fibras de colágeno tipo queloide. C: (10x) Hipercelularidad de aspecto mesenquimatoso. D: (40x) Pleomorfismo nuclear
Figura 4
Inmunohistoquímica del tumor fibroso solitario. Acentuada inmunorreactividad en células para STAT 6
Figura 5
Pieza quirúrgica: tumoración pleural de 4230 g, de 27 x 20 x 14 cm, de superficie lisa de color pardo claro, brillante lobulada
Figura 6
Tomografía espiral multicorte de tórax del 25/02/2021: efusión pleural laminar y leve engrosamiento pleural en campo pulmonar izquierdo
Tabla 1
En azul, los valores previos al tratamiento quirúrgico y con infusión continua de dextrosa intravenosa. En rojo, los registros en el posoperatorio.
Información Adicional
Declaración de conflictos de intereses: Los autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticas:
Protección de personas y animales.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos.
Los autores declaran que, en este artículo, no aparecen datos de pacientes.Derecho a la privacidad y consentimiento informado. Los autores declaran que, en este artículo, no aparecen datos de pacientes.
Uso de inteligencia artificial para generar textos
utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.
Financiamiento: Este artículo ha sido financiado por los autores.
Recibido: 25 de Octubre del 2023
Aprobado: 17 de julio del 2024
Datos de Correspondencia del Autor
Correspondencia: falta
Dirección: falta
Teléfono: falta
Correo electrónico:faltafalta
Artículo publicado por la Revista de la Facultad de Medicina Humana de la
Universidad Ricardo Palma. Es un artículo de acceso abierto, distribuido
bajo los términos de la Licencia Creative Commons: Creative Commons
Attribution 4.0 International, CC BY 4.0
, que permite el uso no
comercial, distribución y reproducción en cualquier medio, siempre que la
obra original sea debidamente citada. Para uso comercial, por favor póngase
en contacto con revista.medicina@urp.edu.pe.
REFERENCIAS BIBLIOGRAFICAS
1
Davanzo B, Emerson R, Lisy M, Koniaris L, Kays J.
Solitary fibrous tumor.
Transl Gastroenterol Hepatol 2018; 3:94.
DOI: 10.21037/tgh.2018.11.02
2
Fernandez-Trujillo L, Bolaños J, Alvarez C, Giraldo J, Velasquez M, et al.
Doege–Potter Syndrome and Hypoglycemia associated with Solitary Fibrous Tumor of the Pleura: Two Case Reports.
Clin Med Insights Circ Respir Pulm Med. 2020; 14: 1-7.
DOI: 10.1177/1179548420964759
3
Lopez-Hinostroza M, Moya - Salazar J, Dávila J, Absencio A, Contreras-Pulache H.
Doege–Potter syndrome due to endothoracic solitary hypoglycemic fibrous tumor.
Clin Case Rep. 2022;10:e05611.
DOI: https://doi.org/10.1002/ccr3.5611
4
Gohir Q, Ghosh S, Bosher O, Crawford E, Srinivasan K, et al.
Pleural-based giant solitary fibrous tumour with associated hypoglycaemia: unusual presentation with pulmonary hypertension in a patient with Doege–Potter syndrome.
Clinical Medicine. 2023; 5:518-20.
DOI: 10.7861/clinmed.2023-0274
5
Mindaye E, Tesfaye G, Aboye A.
Intrathoracic giant solitary fibrous tumor of the pleura: Case report.
Int J Surg Case Rep. 2021;85:106224.
DOI: 10.1016/j.ijscr.2021.106224
6
Donato B, Sewell M, Sen A, Beamer S.
Doege Potter syndrome presenting as multiple fibrous tumours of the chest.
Interact Cardiovasc Thorac Surg. 2022;35(2):ivac089.
DOI: 10.1093/icvts/ivac089
7
Guo W, Ji Y, Guo L, Che S, Huai Q, et al.
Severe hypoglycemia and finger clubbing in a patient with a BRCA1 mutation in a solitary fibrous tumor: a case report.
Ann Transl Med. 2021;9(13):1093.
DOI: 10.21037/atm-21-914
8
Solsi A, Pho K, Shojaie S, Findakly D, Noori T.
Doege-Potter syndrome and Pierre-Marie-Bamberger syndrome in a patient with pleural solitary fibrous tumor: a rare case with literature review.
Cureus. 2020;12(5): e7919.
DOI: 10.7759/cureus.7919
9
Castaldo V, Domenici D, Biscosi M, Ubiali P, Miranda C, et al.
Doege-Potter Syndrome; A Case of Solitary Fibrous Pleura Tumor Associated with Severe Hypoglycemia: A Case Report in Internal Medicine.
Endocrine, Metabolic & Immune Disorders-Drug Targets, 2023;23,1562-1569.
DOI: 10.2174/1871530323666230623112047
10
Mohammed T, Ozcan G, Siddique A, Araneta R, Slater D, et al.
Doege-Potter Syndrome with a Benign Solitary Fibrous Tumor: A Case Report and Literature Review.
Case Rep Oncol. 2021;14:470–476.
DOI: 10.1159/000512823
11
Berrebi D, Symczyk O, Cater T, Adelanwa A, Bacaj P, et al.
Outside the Thorax: Doege–Potter Syndrome Presenting as a Retroperitoneal Abdominal Mass.
Case Rep Endocrinol. 2021; 9919321.
DOI: 10.1155/2021/9919321
12
Guo Y, Liao X, Li Z, Chen Y, Wang S, et al.
Ultrasound-guided percutaneous needle biopsy for peripheral pulmonary lesions: diagnostic accuracy and influencing factors.
Ultrasound in Med. & Biol. 2018; Vol. 44, No. 5, pp. 1003–1011.
DOI: https://doi.org/10.1016/j.ultrasmedbio.2018.01.016
13
Mohamed M, Laz N, Kamel K, Mahmoud R.
The role of ultrasound-guided transthoracic Tru-Cut core biopsy in the diagnosis peripheral thorax lesion.
Egypt J Bronchol. 2021;15,31.
DOI: https://doi.org/10.1186/s43168-021-00080-z
14
Deguchi Y, Komuta W, Watanabe T, Saiga K, Kuruhashi K, et al.
Successful Surgical Treatment of a Recurrent Pelvic Solitary Fibrous Tumor of Uterine Origin Accompanied by Doege-Potter Syndrome: A Case Report.
Am J Case Rep. 2022; 23: e936806.
DOI: 10.12659/AJCR.936806
15
Chen S, Zheng Y, Chen L, Yi Q.
A broad ligament solitary fibrous tumor with Doege–Potter syndrome.
Medicine. 2018. 97:39.
DOI: 10.1097/MD.0000000000012564