Introduction
Asegurar el acceso a servicios de atención médica de calidad, particularmente para pruebas de detección esenciales como las mamografías, representa un desafío significativo en las naciones en desarrollo. Las mujeres a menudo enfrentan largos periodos de espera, los cuales a veces se extienden por varios meses, para someterse a una mamografía. Esta prueba crucial juega un papel fundamental en la detección temprana del cáncer de mama, donde el diagnóstico precoz es vital para un tratamiento efectivo y una mayor supervivencia
1
. Los retrasos en el diagnóstico pueden afectar significativamente la supervivencia y el bienestar de los pacientes, subrayando la importancia de la detección temprana. A esto se suman la escasez de recursos y de profesionales de la salud, lo que dificulta el acceso rápido y eficiente a la atención preventiva
2
. Tales limitaciones resaltan la necesidad urgente de mejorar la interpretación de los estudios radiológicos y de reducir la carga de trabajo de los especialistas en imágenes. Estas mejoras no solo optimizarían la colaboración interdisciplinaria, sino que también mejorarían la atención al paciente, especialmente para exámenes críticos como las mamografías
3
.
Los avances tecnológicos, en particular en inteligencia artificial (IA), han influido significativamente en numerosos sectores, incluida la atención médica
4
. Sin embargo, en áreas como América Latina, donde la infraestructura y los recursos de salud pueden obstaculizar de algún modo la integración de técnicas diagnósticas avanzadas basadas en herramientas informáticas, el potencial de estas innovaciones parece ser poco aprovechado. Una aplicación prometedora de la tecnología es el diagnóstico asistido por computadora (CAD, por sus siglas en inglés) para la detección de cáncer de mama mediante mamografías. El CAD aprovecha vastos conjuntos de datos y algoritmos de reconocimiento de patrones para detectar anomalías en las mamografías, lo que podría facilitar la identificación temprana de lesiones
5
. Dado que el cáncer de mama ocupa un lugar destacado entre las enfermedades más prevalentes que afectan a las mujeres a nivel mundial, la detección precoz es vital para mejorar las tasas de supervivencia y la calidad de vida de las pacientes. Ante estos desafíos, nuestro estudio tiene como objetivo examinar los últimos desarrollos en la tecnología de inteligencia artificial como una herramienta complementaria en las estrategias CAD para mamografías. Nuestro objetivo es fomentar una mejor colaboración interdisciplinaria entre clínicos, radiólogos y patólogos a través de una revisión de última generación sobre el tema. Al hacerlo, anticipamos agilizar el flujo de trabajo diagnóstico y aumentar la eficiencia en los procesos de detección y tratamiento del cáncer de mama.
1.1. Detección de cáncer de mama
La prevalencia del cáncer de mama entre las mujeres a nivel mundial es una preocupación apremiante, siendo el cáncer más diagnosticado y ocupando el quinto lugar en términos de tasas de mortalidad entre las naciones en desarrollo
5
. Esto subraya la necesidad urgente de avances en las metodologías diagnósticas para identificar de manera efectiva y constante los primeros signos de esta enfermedad. La detección temprana es esencial para reducir las tasas de mortalidad y detectar la enfermedad en sus primeras etapas, lo que aumenta las posibilidades de un tratamiento y cuidado óptimos del paciente
2
. En consecuencia, los esfuerzos por mejorar los métodos diagnósticos deben no solo mejorar la precisión, sino también garantizar la disponibilidad generalizada de interpretaciones consistentes de mamografías. Varios países desarrollados han iniciado iniciativas adicionales de detección mamográfica complementaria para analizar la efectividad de la detección temprana. En 2015, una evaluación realizada por la Agencia Internacional para la Investigación del Cáncer analizó datos de 40 estudios agregados en diferentes regiones de altos ingresos de Europa, Australia y América del Norte, donde se implementaron dichos programas de detección. Los hallazgos de la evaluación indicaron que la implementación de programas de detección mamográfica resultó en una disminución del 23% en las tasas de mortalidad por cáncer de mama
5
.
Ante este desafío, los sistemas de IA y CAD tienen el potencial de revolucionar el proceso de detección del cáncer de mama. Estas tecnologías ofrecen ventajas sustanciales al reducir potencialmente el tiempo que los radiólogos requieren para interpretar imágenes, apoyando así a los profesionales de la salud en sus responsabilidades diagnósticas
6
. Mediante la integración de los sistemas de IA y CAD en estos protocolos de detección, la eficiencia y precisión en la detección del cáncer de mama podrían mejorarse significativamente, lo que llevaría a mejores resultados para los pacientes.
1.2 BI-RADS en mamografías
Para crear una línea de comunicación a través de la cual tanto los radiólogos como otros médicos de diferentes especialidades clínicas puedan entenderse al hablar sobre la descripción de los hallazgos mamográficos, el Colegio Americano de Radiología desarrolló el léxico Breast Imaging Reporting and Data System (BI-RADS). Los descriptores en BI-RADS tienen el propósito de clasificar las masas observadas en una mamografía por parte del radiólogo, como se muestra en la tabla 1. Según la clasificación BI-RADS otorgada, se seguirá un camino clínico distinto.
Cada una de las categorías de hallazgos apunta a la naturaleza de la lesión o la interpretación clínica. Las categorías 1 y 2 requieren una revisión anual, y la categoría 3 un examen de seguimiento en seis meses. Dada la gran cantidad de masas que pueden entrar en estas categorías, surge la necesidad de un método más efectivo para evaluar las imágenes. Ha habido casos en los que la variabilidad de observación entre radiólogos ha generado un conflicto de opiniones en la evaluación de una imagen y la lesión observada, lo que podría llevar a una clasificación incorrecta y a distorsionar los pasos adecuados de vigilancia a seguir
5
. En un esfuerzo por mejorar la consistencia y precisión de la interpretación mamográfica, se han desarrollado sistemas CAD. Los sistemas CAD utilizan algoritmos para ayudar a los radiólogos a detectar y clasificar anomalías en las mamografías. Estos sistemas pueden ayudar a reducir la variabilidad entre los radiólogos y mejorar la calidad general de las interpretaciones mamográficas.
1.3 Diagnóstico Asistido por Computadora (CAD)
Históricamente, los sistemas CAD tradicionales han dependido en gran medida de la intervención humana, empleando parámetros predefinidos para detectar anomalías cuando se utilizan en el contexto de imágenes médicas, particularmente en el diagnóstico de cáncer de mama. Para las microcalcificaciones, estos sistemas analizan píxeles de alta intensidad que se asemejan a varillas, mientras que para las masas, examinan atributos específicos como formas, texturas, gradientes y niveles de escala de grises, como se muestra en la figura 1. Los sistemas CAD se dividen en dos grupos distintos: los sistemas de detección, responsables de identificar posibles anomalías, y los sistemas de diagnóstico, que evalúan la probabilidad de enfermedad basándose en las características de la anomalía. No obstante, los radiólogos conservan la autoridad final en el diagnóstico concreto y las decisiones de tratamiento del paciente
5
.
Aunque los sistemas CAD tradicionales han logrado un rendimiento comparable al de los lectores humanos en la detección de masas
3
, están limitados por la necesidad de características definidas manualmente. En un desarrollo notable
6
, se implementó con éxito un sistema CAD basado en una red neuronal convolucional (CNN, por sus siglas en inglés) para clasificar masas mamarias benignas y malignas. Su modelo utilizó una combinación de características profundas de bajo y alto nivel de diferentes capas de CNN, logrando una precisión de clasificación del 96.7%.
Otro sistema CAD fue propuesto para la detección y clasificación de masas mamarias, utilizando una arquitectura CNN regional conocida como "You Only Look Once" (YOLO)
7
. YOLO se distingue por su capacidad para aprender simultáneamente las Regiones de Interés (ROI, por sus siglas en inglés) y sus fondos. El sistema CAD basado en YOLO se estructura en torno a cuatro etapas principales: a) preprocesamiento de imágenes mamográficas, b) extracción de características a través de capas profundas multiconvolucionales, c) detección de masas utilizando un modelo de confianza, y d) clasificación de masas mamarias facilitada por una red neuronal completamente conectada. Esta metodología innovadora tiene como objetivo mejorar la eficiencia y precisión del diagnóstico de cáncer de mama al mitigar ciertas limitaciones inherentes a los sistemas CAD convencionales. La aplicación exitosa del sistema CAD basado en YOLO ha demostrado analizar mamografías con una precisión general del 99.7%.
Como se mencionó anteriormente, YOLO genera la probabilidad de confianza para cada posible ROI que representa la posición de la masa.
1.4 La IA y CAD en la detección del cáncer de mama
La IA y los sistemas CAD están revolucionando la detección del cáncer de mama al mejorar la precisión y la eficiencia en la detección. Los algoritmos de IA pueden analizar mamografías e identificar patrones sutiles y anomalías que pueden indicar las primeras etapas del cáncer, incluso antes de que sean perceptibles para el ojo humano. Los sistemas CAD trabajan en conjunto con los radiólogos, señalando áreas de preocupación para una evaluación posterior. Esta tecnología no solo mejora las tasas de detección, sino que también reduce las probabilidades de falsos positivos, lo que lleva a intervenciones más efectivas y oportunas. La IA y los sistemas CAD están transformando el panorama de la detección del cáncer de mama, ofreciendo una herramienta poderosa en la lucha contra esta enfermedad.
La precisión diagnóstica de la mamografía depende de factores como la anatomía del seno, la densidad del tejido y, principalmente, la habilidad y experiencia del radiólogo. En las lecturas únicas, se estima que el 70% de los cánceres de mama no detectados se deben a errores de interpretación, mientras que el 30% se atribuye a lesiones pasadas por alto. Para mejorar la sensibilidad de las mamografías de detección, se han introducido sistemas CAD para resaltar áreas sospechosas, incluidas microcalcificaciones y masas. La Administración de Alimentos y Medicamentos de EE. UU. aprobó el primer sistema CAD para mamografías en 1998. Para 2016, la utilización de la tecnología de mamografía digital había aumentado hasta el 91.8% en los EE. UU.
1
.
1.5 Aplicación clínica
El concepto de CAD fue introducido por primera vez por Winsberg en 1967. En el proceso de diagnóstico, el CAD emplea software de reconocimiento de patrones para identificar formas desconocidas en imágenes para su consideración por parte de los médicos. Diversas modalidades de imagen, incluidas mamografía, ultrasonografía, tomografía computarizada, resonancia magnética y biopsia, son utilizadas por los sistemas CAD para el diagnóstico de cáncer de mama. El CAD promete mejorar la eficiencia y la rutina de los radiólogos, al ahorrar tiempo entre las lecturas y mantener la consistencia en el reconocimiento de lesiones. El aprendizaje automático se integra en las imágenes mamarias a través del CAD, sirviendo como un "segundo par de ojos" y ayudando en la interpretación y procesamiento de imágenes médicas precisas. El objetivo principal del CAD es reducir los errores humanos en las observaciones y minimizar los informes falsos durante las lecturas de imágenes.
El CAD ha emergido como un enfoque de investigación importante en la imagen médica y la radiología diagnóstica. En este paradigma, los radiólogos utilizan los resultados generados por computadora como una "segunda opinión" para tomar decisiones diagnósticas finales. El CAD es un concepto que reconoce el papel equitativo de los médicos y las computadoras, distinto del diagnóstico automático por computadora que depende únicamente de algoritmos. El objetivo no es que las computadoras superen a los médicos, sino que su rendimiento complemente al de los médicos. Los sistemas CAD han encontrado una amplia aplicación para ayudar a los médicos, particularmente en la detección temprana de cánceres de mama a través de mamografías.
Aunque el rendimiento actual de los sistemas CAD es prometedor, aún no es suficiente para que funcionen como sistemas autónomos de detección y diagnóstico clínico. Varios sistemas CAD diseñados para ayudar en la detección temprana del cáncer de mama típicamente progresan a través de tres etapas: detección de tumores; segmentación y clasificación basada en la forma del tumor y los subtipos, utilizando modelos de aprendizaje profundo. La detección inicial implica identificar el ROI utilizando un detector CNN más rápido. Los algoritmos CAD dependen en gran medida de las mamografías, y se han realizado esfuerzos para establecer el reconocimiento del cáncer de mama y la agrupación de imágenes para mejorar la precisión y superar la dependencia del operador. A pesar de los avances significativos en el CAD desde la era temprana de las computadoras, persisten desafíos en áreas como las limitaciones algorítmicas, la recopilación de datos de entrada, el preprocesamiento, el procesamiento y las evaluaciones del sistema.
2. Metodología
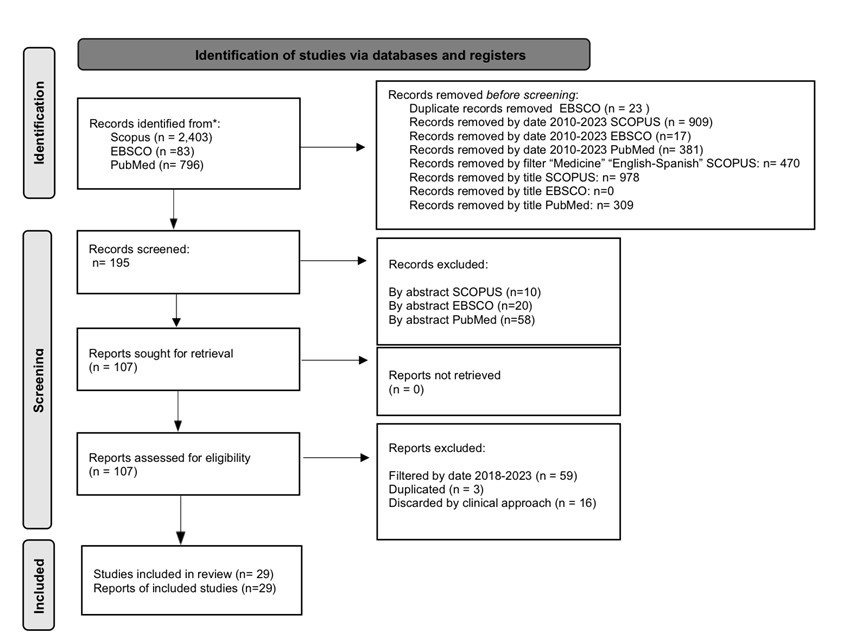
Se utilizó la metodología PRISMA
8
siguiendo las recomendaciones para revisiones de literatura. El diagrama 1 refleja el proceso de la etapa de búsqueda para esta revisión e incluye las consultas de búsqueda utilizadas para cada base de datos, como se muestra en la tabla 2.
3. Resultados
En la figura 2, se presenta una visión general de los conceptos principales encontrados en el presente trabajo, y cómo pueden ser comprendidos de manera ordenada, priorizando la práctica clínica y su pertinencia. Las siguientes secciones amplían cada uno de los elementos presentados en la figura.
3.1 Métodos clínicos y rendimiento del CAD
Se han empleado diferentes métodos como sistemas CAD basados en CNN, sistemas CAD basados en YOLO, redes convolucionales de resolución completa y sistemas CAD tradicionales. Para las investigaciones, se han utilizado diversos conjuntos de datos, incluyendo la Base de Datos Digital para la Detección de Mamografías, el INbreast, el Conjunto de Datos de Imágenes de Ultrasonido de Mama, el Subconjunto Curado de Imágenes Mamográficas de la Base de Datos Digital para la Detección de Mamografías (CBIS-DDSM) y conjuntos de datos privados.
En la tabla 3, se presenta el rendimiento de los sistemas CAD en la identificación de lesiones mamarias, basado en las categorías BI-RADS a lo largo de diferentes estudios. Los parámetros informados para cada algoritmo son la sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN) y precisión general. Los resultados demuestran la efectividad de los sistemas CAD en la asistencia para la detección de lesiones mamarias en varias categorías de BI-RADS.
Desde una perspectiva clínica, los artículos analizados ofrecen valiosos conocimientos sobre los avances de los sistemas CAD para la detección del cáncer de mama. Un estudio de Assari et al., en 2022
9
, se centró en la clasificación de masas mamarias sólidas, empleando modelos separados para cada modalidad de imagen y combinándolos en un solo modelo bimodal. El logro de una precisión del 90,38% y un área bajo la curva (AUC, por sus siglas en inglés) del 95,82% significa un progreso prometedor en la clasificación precisa de las masas mamarias, lo que es fundamental para una planificación diagnóstica y de tratamiento efectiva.
De manera similar, en el estudio de Boumaraf, S. et al., en 2020
5
, se clasificaron las masas mamográficas en cuatro categorías de evaluación utilizando un promedio de modelos en conjunto con un clasificador XGBoost. Su evaluación integral, que abarcó precisión, AUC, sensibilidad, especificidad, puntuación F1 y el Coeficiente de Correlación de Matthews a lo largo de diferentes conjuntos de datos, muestra la solidez de su enfoque. El uso de modelos separados para diferentes modalidades de imágenes y su posterior integración en un solo modelo resalta el potencial de los enfoques multimodales para mejorar la precisión diagnóstica. Al aprovechar estas múltiples métricas de evaluación, su estudio proporciona una comprensión profunda del rendimiento de los sistemas CAD, esencial para la toma de decisiones clínicas en el futuro. Científicamente, ambos estudios contribuyen al avance de las metodologías CAD para la detección del cáncer de mama. La integración de diversas modalidades de imagen permite una evaluación más integral de las masas mamarias, lo que puede reducir los diagnósticos falsos positivos y falsos negativos.
3.2 Avances y obstáculos en la aplicación global del CAD
Los recientes avances en los sistemas CAD para la detección de cáncer de mama mediante mamografías se muestran en la tabla 4, donde se destaca la importancia de la mamografía de detección para la detección temprana del cáncer de mama, así como los desafíos asociados con los sistemas CAD.
Las pruebas adicionales de diferentes modelos CAD resaltan el estado actual y los desafíos que aún enfrentan en la detección del cáncer de mama. Si bien el rendimiento reportado de los sistemas CAD es alentador, con un área bajo la curva ROC promedio de 0,86, aún no se consideran lo suficientemente confiables para su uso clínico autónomo a nivel mundial
10
, Uno de los principales desafíos que enfrentan los sistemas CAD es el bajo contraste entre los tejidos mamarios normales y malignos, particularmente prominente en el tejido mamario denso. Como se discutió previamente, esto representa un obstáculo significativo para la detección y clasificación precisas de lesiones.
Además, la fiabilidad de los sistemas CAD está limitada por su dependencia de conjuntos de datos específicos para su entrenamiento y ajuste, lo que dificulta generalizar los excelentes resultados de rendimiento reportados en la literatura. Abordar la variabilidad en las densidades mamarias presenta un desafío importante en el análisis mamográfico. El no calibrar adecuadamente los modelos de detección según la densidad específica de la mamografía puede llevar a mediciones erróneas e inexactitudes diagnósticas. Esta preocupación subraya la necesidad crítica de aprovechar una diversa gama de modelos de herramientas de IA, entrenados meticulosamente en una extensa biblioteca de variaciones mamográficas.
El aprendizaje por transferencia se destaca como una estrategia clave en este contexto, permitiendo optimizar el rendimiento del modelo incluso en escenarios con disponibilidad limitada de datos. De manera notable
6
, emprendió la segmentación y clasificación de lesiones benignas y malignas, utilizando metodologías de aprendizaje por transferencia con modelos preentrenados. Al utilizar esta información obtenida de modelos preexistentes, se presenta la oportunidad de mejorar la precisión diagnóstica y abordar la variabilidad en el diagnóstico asociada con las densidades heterogéneas del tejido mamario.
Sin mejoras sustanciales, particularmente mediante el avance de las técnicas de aprendizaje profundo y el aumento del poder computacional, los sistemas CAD están relegados a herramientas de opinión secundaria dentro de la práctica clínica. Estos desafíos subrayan la necesidad urgente de más investigaciones y avances tecnológicos para mejorar la fiabilidad y efectividad de los sistemas CAD en la detección del cáncer de mama.
3.3 Aplicaciones clínicas de los sistemas CAD
Un área importante donde la implementación de los sistemas CAD sería más beneficiosa es en la reducción del tiempo necesario para que los radiólogos evalúen las mamografías. Por ejemplo, los radiólogos experimentados, con amplia trayectoria, que pueden identificar lesiones más rápidamente que sus colegas con menos experiencia, pueden mejorar significativamente su eficiencia con los sistemas CAD. El modelo CAD proporciona un análisis rápido, lo que permite que el radiólogo experimentado verifique la observación de manera ágil, disminuyendo sustancialmente el tiempo necesario para la evaluación de cada mamografía
11
.
A pesar de ello, debemos asegurarnos de que, incluso con la evaluación más rápida de las mamografías, la precisión de los diagnósticos se mantenga lo más alta posible para garantizar un enfoque adecuado hacia la lesión. Varios modelos computacionales han demostrado tener mayor especificidad y precisión en comparación con los lectores humanos utilizando descriptores BI-RADS
12
, lo que resalta el potencial de los sistemas CAD-CESM (en español: Diagnóstico Asistido por Computadora – mamografía espectral mejorada con contraste) para mejorar la exactitud en la detección del cáncer de mama. Aunque la sensibilidad del modelo fue menor que la de los lectores humanos, los trabajos futuros que impliquen evaluaciones de los márgenes muestran cómo la sensibilidad del CAD-CESM puede mejorar, manteniendo así una alta precisión diagnóstica.
Una visión integral del rendimiento diagnóstico de los sistemas CAD en diferentes modalidades de imagen para el cáncer de mama se presenta en la tabla 5. Esta incluye datos de múltiples estudios, mostrando métricas clave como precisión, sensibilidad, especificidad, VPP, VPN y AUC.
Los estudios comparan el rendimiento de los sistemas CAD con el de radiólogos experimentados en diferentes niveles de pericia. Además, destacan la eficacia del CAD en la detección de lesiones malignas, contribuyendo a la evaluación del riesgo y diferenciando entre lesiones mamarias benignas y malignas. Estos hallazgos son cruciales para comprender el potencial del CAD como una herramienta de apoyo en la mamografía para la detección oportuna del cáncer de mama.
En general, los resultados de varios estudios que evaluaron los sistemas CAD para la detección del cáncer de mama mostraron una variación significativa en la precisión, sensibilidad, especificidad, VPP, VPN y AUC. Si bien algunos sistemas demostraron una alta precisión y tasas de detección, otros mostraron una menor sensibilidad y especificidad. Estos resultados variables se pueden atribuir al uso de diferentes modelos CAD, conjuntos de datos y métricas de evaluación en los estudios. La variación en estos parámetros influye significativamente en los resultados informados, lo que resalta una vez más el desafío en el camino hacia la futura aplicación global de los sistemas CAD.
3.4 Integración de herramientas de IA
Las herramientas de IA son prometedoras en cuanto a la imagenología mamaria, particularmente en la mamografía digital y la tomosíntesis mamaria digital, ofreciendo un método autónomo para el diagnóstico y potencialmente reemplazando la necesidad de un segundo lector
3
. La integración de sistemas de IA en la práctica clínica rutinaria podría ayudar a los radiólogos a alcanzar estándares de rendimiento y mejorar la detección del cáncer de mama
13
. No obstante, desarrollar métodos para que los radiólogos interpreten las decisiones de la IA será crucial para prácticas radiológicas eficientes y una mejor atención al paciente
14
.
La apariencia de las lesiones mamográficas puede estar vinculada a información histológica específica, lo que nos dirige hacia una estimación de la etapa y el riesgo del cáncer de mama
15
. Los avances en tecnologías como el análisis de características radiómicas de alto rendimiento y el aprendizaje profundo basado en IA han contribuido al desarrollo de numerosos esquemas CAD, pero se precisa de mayor investigación en el área de análisis multimodal con IA
4
.
Un estudio evaluó un sistema CAD basado en IA que detectó con éxito malignidades en mamografías digitales, hallando especialmente carcinoma lobulillar invasivo con alta sensibilidad para tipos específicos de masas y calcificaciones
16
.
Si bien algunos artículos no proporcionaron datos específicos de sensibilidad o especificidad (tabla 6), la tendencia general indica un potencial significativo de la IA para mejorar el diagnóstico del cáncer de mama y los resultados de los pacientes, lo que subraya la necesidad de mayor investigación y desarrollo en este campo.
3.5 Uso de herramientas de IA en la evaluación del cáncer de mama
En la tabla 7, se pueden observar dos estudios realizados por Lee S et al.
17
para evaluar la concordancia entre un programa de IA-CAD y los radiólogos en la evaluación de la densidad mamográfica y las puntuaciones de anormalidad en el cáncer de mama. El primer estudio comparó las evaluaciones del programa IA-CAD con las de los radiólogos y un programa de evaluación automatizado utilizando datos de 488 pacientes del Yongin Severance Hospital, mientras que el segundo estudio evaluó retrospectivamente las puntuaciones de anormalidad del cáncer de mama y los casos de falsos negativos de IA-CAD en 896 pacientes con 930 cánceres de mama.
Los hallazgos clave del primer estudio incluyen:
- ● Concordancia aceptable entre el sistema AI-CAD y los radiólogos en la evaluación de la densidad mamográfica.
-
● Concordancia similar entre los radiólogos y un analizador comercial automatizado de densidad.
Las implicaciones para la aplicación de AI-CAD en mamografías digitales incluyen:
● Mejora de los resultados de detección: AI-CAD mejora la especificidad de los radiólogos sin comprometer la sensibilidad, lo cual es particularmente beneficioso para mujeres con mamas densas o en programas de cribado prevalentes.
● Concordancia con radiólogos: AI-CAD muestra una concordancia aceptable con los radiólogos en la evaluación de la densidad mamográfica, ayudando en la evaluación del riesgo de cáncer de mama.
● Mejor categorización y detección de cáncer: AI-CAD se correlaciona con puntuaciones elevadas de anormalidad, ayudando en la categorización BI-RADS e identificando cánceres adicionales que los radiólogos no detectaron.
● Necesidad de algoritmos específicos: Los sistemas AI-CAD deben diseñarse y entrenarse con algoritmos específicos para la población.
● Ocurrencia limitada de cánceres: Se necesitan más estudios para confirmar la efectividad del AI-CAD debido a la limitada ocurrencia de cánceres en los datos de cribado reales.
En resumen, AI-CAD tiene el potencial de mejorar la precisión y eficacia de las mamografías digitales en conjunto con los radiólogos, pero se necesita mayor investigación para validar su efectividad en diferentes poblaciones.
3.6 Revisión de la IA en el cribado del cáncer de mama
La comparación del uso de CAD en la mamografía de cribado para la detección temprana de cáncer de mama muestra efectos variados en la precisión diagnóstica y las tasas de sensibilidad. Los estudios que compararon la lectura única (SR, por sus siglas en inglés) hecha por un radiólogo con SR más CAD mostraron una mayor sensibilidad y/o tasas de detección de cáncer con CAD. Aun así, la adición de CAD a SR generalmente aumentó el riesgo relativo (RR) y redujo la especificidad, excepto en un estudio. Al comparar la doble lectura por dos radiólogos (DR) con SR más CAD, no hubo cambios significativos en la sensibilidad o las tasas de detección de cáncer. En la mayoría de los casos, agregar un sistema CAD a la mamografía de cribado aumentó el RR, la sensibilidad y las tasas de detección de cáncer.
Las ventajas del análisis temporal en la detección y clasificación de anomalías mamarias utilizando datos de mamografías anteriores incluyen proporcionar un claro beneficio al identificar masas mamarias y microcalcificaciones, al aprovechar la comparación con datos previos de mamografías para ayudar en la detección y clasificación de anomalías. Sin embargo, surge una limitación cuando una anomalía recién desarrollada carece de suficientes datos de mamografías anteriores para su comparación, lo que hace que el análisis temporal sea menos efectivo en estos casos. Además, si bien la integración de datos de mamografías anteriores tiene un gran potencial para detectar anomalías mamarias, el alcance limitado de los estudios a gran escala restringe la aplicabilidad clínica general de estos hallazgos. Por lo tanto, aunque el análisis temporal usando datos de mamografías anteriores puede ser beneficioso en ciertos casos, su efectividad puede verse restringida por la disponibilidad de datos históricos relevantes.
Es importante señalar que, si bien la mayoría de los estudios mostraron mejoras en la sensibilidad y las tasas de detección de cáncer con la adición de CAD, hubo preocupaciones sobre la reducción de la especificidad y el aumento del RR en algunos casos. Esto indica que, si bien los sistemas CAD pueden mejorar la detección de anomalías, también pueden conducir a un aumento de falsos positivos.
4. Discusión
Los sistemas CAD muestran un futuro prometedor para mejorar la interpretación de mamografías y el cribado del cáncer de mama. Su integración en las prácticas radiológicas podría mejorar significativamente la precisión diagnóstica y las tasas de sensibilidad. Sin embargo, la implementación exitosa requiere más investigación para optimizar la integración del CAD, considerar las perspectivas de los radiólogos y asegurar la aceptación en los entornos clínicos.
Varios desafíos persisten en el CAD y el diagnóstico del cáncer de mama, en particular el bajo contraste entre los tejidos normales y malignos, especialmente en mamas densas. A pesar del prometedor rendimiento promedio, los métodos CAD actualmente no son suficientes para su uso clínico autónomo. Se necesitan mejoras significativas a través de avances en el aprendizaje profundo y el poder computacional para elevar los sistemas CAD a herramientas diagnósticas primarias.
La eficacia de la detección del cáncer de mama depende del rendimiento del sistema CAD, la población evaluada y la experiencia de los radiólogos. El CAD puede beneficiar particularmente a los radiólogos menos experimentados al ayudar en la identificación de tumores con microcalcificaciones. Comprender la integración clínica del CAD y su impacto en los profesionales de la salud sigue siendo crucial, por lo cual requiere una investigación más minuciosa. También es imperativo evaluar los costos asociados con los sistemas CAD para optimizar sus aplicaciones en el sistema de salud. La integración de datos de mamografías anteriores en herramientas de IA muestra un gran potencial, pero actualmente está limitada por la falta de estudios a gran escala. La adopción inicial en entornos clínicos puede servir como una herramienta complementaria para un segundo lector. La mayoría de los estudios demuestran una mejora en las tasas de sensibilidad y detección de cáncer con el uso del CAD, lo que demuestra su potencial para mejorar la precisión diagnóstica.
Tabla 1. Interpretación de las categorías BIRADS en evaluaciones de imágenes mamográficas
5
|
Categoria
|
Categoria Interpretación clínica
|
| Categoria 0 |
Incompleta, se requieren más evaluaciones por imágenes |
| Categoria 1 |
Negativa, no se encontró ninguna anormalidad |
| Categoria 2 |
Benigna |
| Categoria 3 |
Probablemente benigna |
| Categoria 4 |
Hallazgo sospechoso |
| Categoria 5 |
Altamente sugestiva de malignidad |
| Categoria 6 |
Malignidad confirmada por biopsia |
Tabla 2. Consultas de búsqueda para cada base de datos consultada
|
Base de datos
|
Cadena de búsqueda
|
| SCOPUS |
CAD AND Mammografias |
| EBSCO |
CAD AND Mamografías AND BI RADS |
| PubMed |
CAD AND Mamografías |
Tabla 3. Rendimiento CAD en el análisis de mamografías
| Estudio |
Tarea |
Método |
Base de datos |
Comparación |
Resultados |
| Al-masni, M., et al. en 2018 |
Segmentación y clasificación de lesiones benignas/malignas |
Sistema CAD basado en CNN y YOLO |
DDSM (18) |
Máquina de vectores de soporte, red neuronal probabilística, CNN. |
-Precisión: 99.7% para la detección de masas y 97% para distinguir entre lesiones benignas y malignas.
-Sensibilidad: 100% en casos benignos.
-Especificidad: 94% en casos malignos
-Puntaje F1: No reportado.
-MCC: No reportado
|
| Al-antari, M., et al. en 2018 |
Segmentación y clasificación de lesiones benignas/malignas. |
Modelo de aprendizaje profundo basado en una FrCN y una CNN, ambos con enfoque YOLO. |
Base de datos INbreast (7) |
YOLO, FrCN, CNN. |
No se segmentó la masa.
INbreast con segmentación de masas mediante validación cruzada de cuatro pliegues.
-Precisión: 95.64%
-Sensibilidad: 97.14%
-Especificidad: 92.41%
-Puntaje F1: 96.84
-AUC: 94.78%
-MCC: 89.91%
|
| Assari, Z., et al. en 2022 |
Clasificación de masas mamarias sólidas |
Entrenamiento de modelos separados para cada modalidad de imagen, luego integrándolos en un solo BCNN |
DDSM, BUSI, base de datos recopilada (9) |
Modelo monomodal sonográfico (SMCNN) y modelo monomodal mamográfico (MMCNN) |
-Precisión: 90.38%
-Sensibilidad: 90.91%
-Especificidad: 89.87%
-Puntaje F1: 90.32
-MCC: 80.78%
-SE: 90.91%
-SP: 89.8
-AUC: 95.82%
|
| Boumaraf, S., et al. en 2020 |
Clasificación de masas mamarias según BI-RADS |
Algoritmo genético modificado (GA) con una red neuronal de retropropagación (BPN) para la clasificación |
DDSM (5) |
Sistema CAD tradicional, clasificación BI-RADS |
-Precisión: 84.5%
-Sensibilidad: 84.5%
-Especificidad: 94.25
-Puntaje F1: No reportado
-MCC: 79.3%
-PPV: 84.4%
-NPV: 94.8%
|
| Chougrad, H., et al. en 2018 |
Segmentación y clasificación de lesiones benignas/malignas |
Aprendizaje por transferencia con modelos preentrenados |
DDSM, INbreast, BCDR y base de datos MIAS (6) |
Desempeño humano, radiólogos. |
-Precisión
-DDSM: 97.35%
-INbreast: 95.50%
-BCDR: 96.67%
-Marco de detección de cáncer de mama: 98.94%
-MIAS: 98.23%
-AUC
-DDSM: 0.98
-INbreast: 0.97
-BCDR: 0.96
-Marco de detección de cáncer de mama: 0.99
-MIAS: 0.99
-Sensibilidad: No reportada
-Especificidad: No reportada
-Puntaje F1: No reportado
-MCC: No reportado
|
| Baccouche, A., et al. en 2022 |
Segmentación y clasificación de lesiones benignas/malignas |
Experimentos comparativos realizados en modelos individuales y usando un clasificador XGBoost |
CBIS-DDSM, INbreast y un conjunto de datos privado (19) |
Conjuntos de datos de mamografías CBIS-DDSM, INbreast y privado |
-Precisión por:
-Clasificación de patología:
-CBIS-DDSM: 95.13%
-INbreast: 99.20%
-Privado: 95.88%
-Clasificación BIRADS:
-CBIS-DDSM: 85.38%
-INbreast: 99%
-Clasificación de forma:
-CBIS-DDSM: 90.02%
-AUC por:
-Clasificación de patología:
-CBIS-DDSM: 0.95
-INbreast: 0.99
-Clasificación BIRADS:
-CBIS-DDSM: 0.94
-INbreast: 1.0
-Sensibilidad por:
-CBIS-DDSM: 0.85
-INbreast: 1.0
-Especificidad por:
-CBIS-DDSM: 0.98
-INbreast: 0.96
-Puntaje F1:
-CBIS-DDSM: 0.91
-INbreast: 0.99
|
| James, J., et al. en 2018 |
Evaluar mamografías sintéticas en 2D mejoradas con CAD vs mamografías sintéticas estándar y mamografía digital de campo completo (FFDM) |
Dos radiólogos revisaron retrospectivamente las proyecciones mamográficas oblicuas y craneocaudales |
FFDM, mamografías sintéticas estándar y CAD mejoradas (20) |
Mamografías sintéticas estándar y FFDM convencional. |
-Mamografía sintética mejorada con CAD:
-AUC: 0.846
-Sensibilidad: 94.11
-Especificidad: 57.35
-Mamografía sintética estándar:
-AUC: 0.683
-Sensibilidad: 52.94
-Especificidad: 86.76
-FFDM convencional:
-AUC: 0.724
-Sensibilidad: 97.06
-Especificidad: 17.64
|
Tabla 4. Análisis de los avances actuales y los desafíos enfrentados en CAD
| Autor |
Objetivo |
Resultados reportados |
Conclusiones |
Observaciones |
| Ramadán S en 2020 |
El artículo revisa los avances recientes en los sistemas CAD para la detección y diagnóstico del cáncer de mama a través de mamografías, describiendo los métodos utilizados en los sistemas CAD y abordando la demanda de especialistas en imágenes mamarias. Enfatiza la importancia de la mamografía de cribado para la detección temprana del cáncer de mama y resalta los desafíos asociados (10). |
Los avances reportados y el estado actual del CAD para la detección del cáncer de mama muestran que, a pesar de los niveles de rendimiento prometedores, los sistemas CAD aún no son lo suficientemente confiables como para ser utilizados de manera independiente en la detección y diagnóstico del cáncer de mama mediante mamografías.
El rendimiento promedio de varios métodos CAD, medido por el área bajo la curva ROC, es de alrededor de 0.86. Sin embargo, los resultados de rendimiento excepcionales en la literatura no pueden generalizarse, ya que están basados en conjuntos de datos específicos. |
La detección asistida por computadora y el diagnóstico del cáncer de mama a partir de mamografías enfrentan desafíos debido al bajo contraste entre los tejidos normales y malignos, especialmente en tejido mamario denso.
El rendimiento promedio de los métodos CAD es alentador, pero no alcanza la confiabilidad para un uso clínico independiente.
Sin mejoras significativas, particularmente a través del aprovechamiento del aprendizaje profundo y mayor poder computacional, los sistemas CAD son considerados adecuados solo como herramientas de segunda opinión en la práctica clínica. |
No se presentó la metodología PRISMA. El artículo está más centrado en el estado tecnológico del CAD que en su aplicación clínica. |
| Guo Z et al. en 2022 |
Este artículo explora la aplicación de los sistemas CAD para la detección del cáncer de mama, enfocándose en su papel en la imagenología mamaria y la integración de la IA en radiología. Evalúa la efectividad del CAD en la mamografía de cribado y profundiza en el potencial del CAD utilizando técnicas de minería de imágenes para la detección del cáncer de mama. Además, revisa las metodologías en los sistemas CAD para la detección del cáncer de mama, con el objetivo de ofrecer una comprensión integral de la utilización del CAD en el diagnóstico y cribado del cáncer de mama (21). |
El estudio encontró que la resonancia magnética (RM) tenía la mayor sensibilidad, mientras que la mamografía (MM) tenía la más baja, independientemente del tipo de mama, densidad o historial. La sensibilidad aumentó con modalidades combinadas como US + RM, o MM + RM, o RM + MM + US. Además, la precisión de los sistemas CAD convencionales ha mejorado con la introducción de la IA y los algoritmos basados en IA. |
La eficacia de la detección del cáncer de mama depende del sistema CAD, de la población objetivo y de la experiencia de los radiólogos.
El CAD ayuda a radiólogos con menos experiencia, particularmente en la identificación de carcinomas con microcalcificaciones. A medida que la IA progresa, comprender la integración clínica del CAD y sus efectos en los profesionales se vuelve vital, lo que justifica más investigaciones.
Además, evaluar los costos del sistema CAD para la detección de carcinoma mamario es esencial para optimizar sus aplicaciones en el sistema de salud. |
El estudio comparó directamente la aplicación del CAD con diferentes modalidades de imagen junto con las mamografías. |
Tabla 5. Rendimiento de modelos CAD en diferentes modalidades de imagen
| Estudio |
Tarea |
Método |
Base de datos |
Comparación |
Resultados |
| Patel B et al. en 2018 |
Desarrollo y evaluación de un prototipo de herramienta CAD para mamografía espectral con contraste (CESM). |
Se desarrolló un prototipo de herramienta CAD-CESM utilizando análisis de textura y morfología para diferenciar entre lesiones mamarias benignas y malignas. |
CESM (12) |
CAD con 2 radiólogos experimentados |
CAD CESM:
- Precisión: 90%
- Tasa de detección en el grupo maligno: 88%
- Tasa de detección en el grupo benigno: 92%
RADIÓLOGO 1:
- Precisión: 78%
- Tasa de detección en el grupo maligno: 92%
- Tasa de detección en el grupo benigno: 62%
RADIÓLOGO 2:
- Precisión: 86%
- Tasa de detección en el grupo maligno: 100%
- Tasa de detección en el grupo benigno: 71%
Puntaje F1: No reportado
MCC: No reportado
|
| He Z et al. en 2021 |
Evaluar el rendimiento diagnóstico de un modelo CAD para masas mamarias. |
En el estudio MRMC, seleccionamos a seis especialistas en radiología en tres grupos. Los radiólogos diagnosticaron a 51 pacientes con y sin el modelo CAD. |
Imágenes FFDM (11) |
Seis radiólogos con CAD y sin CAD |
SIN AYUDA
SENSIBILIDAD
Lector 1: 0.545
Lector 5: 0.819
ESPECIFICIDAD
Lector 2: 0.621
Lector 6: 0.863
PPV
Lector 1: 0.857
Lector 2: 0.577
NPV
Lector 2: 0.720
Lector 5: 0.851
AUC
Lector 2: 0.783
Lector 3: 0.889
CON AYUDA
SENSIBILIDAD
Lector 1: 0.682
Lector 5: 0.901
ESPECIFICIDAD
Lector 1: 0.931
Lector 2: 0.621
PPV
Lector 1: 0.882
Lector 2: 0.633
NPV
Lector 1: 0.794
Lector 5: 0.909
AUC
Lector 3: 0.922
Lector 5: 0.847
|
| Yoon J et al. en 2022 |
Evaluar el desempeño de los sistemas AI-CAD en la evaluación del riesgo de malignidad de las calcificaciones detectadas en mamografía de cribado. |
Estudio retrospectivo de diagnóstico o pronóstico realizado en una institución. |
Sistema AI-CAD (22) |
Sistema AI-CAD y un radiólogo experto en mama. |
Precisión:
AI CAD: 80%
Radiólogo: 81.7%
Sensibilidad:
AI CAD: 92.1%
Radiólogo: 95.4%
Especificidad:
AI CAD: 90.3%
Radiólogo: 96.9%
|
| Dominkovic M et al. en 2020 |
Comparar el análisis CAD con las evaluaciones independientes de dos radiólogos en la mamografía de cribado. |
Los radiólogos revisaron las imágenes y clasificaron los hallazgos según la categoría del Sistema de Información de Imágenes Mamarias (BI-RADS). |
Sistema CAD (23) |
CAD en mamografía de cribado con dos radiólogos independientes en la misma muestra |
Precisión: No reportado
TODAS LAS LESIONES:
- Radiólogos: 89 (100%)
- CAD: 49 (54%)
- Sensibilidad: 54%
- Especificidad: 16%
- PPV: 23%
- NPV: 37%
LESIONES SIN ALN:
- Radiólogos: 69(100%)
- CAD: 29 (42%)
- Sensibilidad: 47%
- Especificidad: 16%
- PPV: 19%
- NPV: 43%
LESIONES SIN MASAS BENIGNAS Y SIN ALN:
- Radiólogos: 18(100%)
- CAD: 8 (44%)
- Sensibilidad: 44%
- Especificidad: 16%
- PPV: 6%
- NPV: 71%
LESIONES SOSPECHOSAS:
- Radiólogos: 7(100%)
- CAD: 6 (86%)
- Sensibilidad: 85%
- Especificidad: 16%
- PPV: 5%
- NPV: 96%
Puntaje F1: No reportado
|
| Watanabe A et al. en 2019 |
Detección asistida de cáncer de mama en FFDM 2D |
cmAssist™, un sistema AI-CAD |
Protocolo compatible con la Ley de Portabilidad y Responsabilidad de los Seguros de Salud (HIPAA) (2) |
Radiólogos utilizando el R2 ImageChecker CAD, versión 10.0. En el estudio de lectores, 7 radiólogos. |
Precisión: No reportada
Sensibilidad: No reportada
Especificidad: No reportada
Puntaje F1: No reportado
AUC: 7.2%
Tasa de detección de cáncer con el uso de cmAssist: 62%
Tasa de detección de cáncer sin cmAssist: 51%
IC: 1.14% a 15%
|
Tabla 6. Resultados actuales del rendimiento de la IA en la evaluación de lesiones
| Autor |
Objetivo |
Resultados reportados |
Conclusiones |
Observaciones |
| Jairam M et al. en 2021 |
Examinar el papel de los instrumentos de IA tanto en la mamografía avanzada como en la tomosíntesis digital de mama (DBT) (3). |
El diagnóstico asistido por IA mejora la precisión diagnóstica en comparación con los sistemas CAD tradicionales. Presenta un método de diagnóstico autónomo prometedor, que potencialmente sustituiría la necesidad de un segundo lector. Las herramientas de aprendizaje profundo identifican y restan prioridad a las mamografías negativas, aliviando la carga de trabajo de los radiólogos. |
La IA está lista para avanzar como un instrumento de apoyo en la imagenología mamaria, con un potencial significativo para mejorar la detección del cáncer de mama. |
El artículo describe varios estudios y explica sus hallazgos distintivos. No proporciona datos de especificidad o sensibilidad. |
| Masud R et al. en 2019 |
Proporcionar una visión general de la investigación actual sobre la integración y aplicación del CAD en la detección del cáncer de mama por radiólogos, destacando obstáculos y facilitadores en la adopción del CAD (24). |
Los factores que promueven la utilización del CAD incluyen la mejora en las tasas de detección de cáncer de mama, una mayor viabilidad financiera en la imagenología mamaria, y la eficiencia en el tiempo obtenida al reemplazar las interpretaciones duales. |
Se requiere más investigación para identificar las mejores estrategias para integrar el CAD en los flujos de trabajo de radiología y mejorar los resultados de los pacientes, destacando la importancia de incorporar la perspectiva de los radiólogos en el avance del uso del CAD. |
El artículo emplea un análisis retrospectivo para examinar y determinar el grado de implementación y los gastos asociados. |
| Retson T et al. en 2023 |
Profundizar en las diversas formas en que se aplica la IA en la imagenología mamaria, explorando su amplio rango de aplicaciones (14). |
Los esfuerzos futuros se centrarán en desarrollar técnicas para que los radiólogos interpreten las decisiones generadas por la IA, con el objetivo de mejorar la eficiencia de las prácticas radiológicas y la atención al paciente. |
Es esencial abordar las actualizaciones y el mantenimiento continuo de los algoritmos de IA para mantener un rendimiento óptimo, considerando posibles alteraciones derivadas de actualizaciones de software o cambios demográficos. |
El artículo no incluye sensibilidad ni especificidad. |
| Hamidinekoo A et al. en 2018 |
Describir la correlación entre los hallazgos de la mamografía y los fenotipos histopatológicos, considerando factores biológicos (15). |
Las características de las anomalías mamográficas pueden ser indicativas de detalles histológicos específicos, ofreciendo información sobre cómo los cambios microscópicos se manifiestan en las imágenes macroscópicas. |
Diversas modalidades de imagen proporcionan información diversa en diferentes escalas, ayudando a estimar la etapa y el riesgo del cáncer de mama. Los clínicos integran estas diversas fuentes de datos para mejorar el diagnóstico y la planificación del tratamiento de la enfermedad. |
El modelo propuesto de Vinculación de Mamografía-Histología-Fenotipo (Mammography-Histology-Phenotype-Linking-Model) tiene como objetivo establecer una conexión entre las características/fenotipos observados en las anomalías mamográficas y sus representaciones histopatológicas correspondientes. |
| Jones M et al. en 2022 |
Observar los avances recientes en la comprensión de la relación entre las características radiómicas y el microambiente tumoral, así como el progreso en el desarrollo de nuevos modelos de análisis de imágenes cuantitativas basados en IA en tres áreas clave del diagnóstico del cáncer de mama (4). |
Los métodos de radiómica y aprendizaje profundo por transferencia muestran potencial para extraer características de imágenes clínicamente relevantes y crear marcadores cuantitativos y modelos de predicción para la investigación del cáncer de mama. Este enfoque impulsado por IA está avanzando en la medicina personalizada utilizando datos específicos del paciente para la detección y diagnóstico del cáncer. |
Los avances en radiómica de alto rendimiento y aprendizaje profundo por transferencia han dado lugar a numerosos nuevos esquemas de CAD y modelos de predicción para el cáncer de mama, incluidos la predicción del riesgo de cáncer, la probabilidad de malignidad del tumor, subtipos o estadificación del tumor, respuesta al tratamiento y resultados de supervivencia del paciente. Sin embargo, estos nuevos esquemas de CAD basados en IA requieren una mayor validación con grandes bases de datos de imágenes diversas de múltiples sitios clínicos antes de su adopción clínica. |
Se necesita más investigación para una respuesta concluyente. |
| Arce S et al. en 2023 |
Enfatizar los avances recientes en la comprensión de la relación entre las características radiómicas y el microambiente tumoral, así como el desarrollo de nuevos modelos cuantitativos impulsados por IA para analizar características de imágenes en tres dominios del cáncer de mama (16). |
Se investigaron términos que abarcan el riesgo de cáncer de mama, diagnóstico/clasificación, CAD y predicción de respuesta al tratamiento/pronóstico. |
Más allá de los esquemas CAD comercialmente disponibles, los avances en tecnologías como el análisis de características radiómicas de alto rendimiento y el aprendizaje profundo impulsado por IA han impulsado la creación de numerosos nuevos esquemas CAD. |
Todos los pacientes en este conjunto de datos tenían cáncer, por lo que no se pudo calcular la especificidad del CAD de IA, y no se pudo realizar un análisis de características operativas del receptor. |
| Bahl M en 2018 |
Evaluar la posible mejora en las medidas de rendimiento como la sensibilidad, especificidad y AUC cuando los radiólogos reciben asistencia de un sistema de IA para interpretar mamografías (13). |
Su AUC promedio aumentó de 0.87 a 0.89 con la asistencia de IA. La sensibilidad mostró una mejora con la ayuda de IA (86% frente al 83%), y la especificidad demostró una tendencia favorable (79% frente al 77%). |
La incorporación de sistemas de IA en la práctica clínica estándar podría ayudar potencialmente a radiólogos de diversos niveles de experiencia a alcanzar los estándares de rendimiento. |
Aunque los sistemas de IA basados en aprendizaje profundo, como Transpara, tienen el potencial de ayudar a los radiólogos en la detección del cáncer de mama basado en mamografías, las mejoras en el rendimiento con la asistencia de IA siguen siendo marginales. |
| Kohli A et al en 2017 |
Examinar la evolución del CAD en mamografía, evaluar las razones detrás de las deficiencias del CAD y especular sobre estrategias potenciales para que los sistemas CAD futuros tengan éxito (25). |
El CAD mostró una eficacia limitada en mejorar la precisión en la detección del cáncer. A pesar de un aumento marginal en las tasas de detección de cáncer (entre el 2% y el 10%) y una aceleración leve en la detección del cáncer en 2 meses, no resultó en mejores resultados. |
El esfuerzo por detectar el cáncer de mama a través del CAD ha encontrado obstáculos y limitaciones. |
No se presentó la metodología PRISMA. |
Tabla 7. Evaluación de AI-CAD para la detección del cáncer de mama
| Estudio |
Objetivo |
Método |
Conjunto de datos |
Comparación |
Resultados reportados |
| Lee S et al. en 2022 |
Evaluar la concordancia entre un programa AI-CAD y los radiólogos en la evaluación de la densidad mamográfica, importante para la evaluación del riesgo de cáncer de mama (26). |
El estudio comparó las evaluaciones de densidad mamaria de un programa comercial de AI-CAD con las de radiólogos y un programa automatizado de evaluación, utilizando datos de 488 pacientes en el Yongin Severance Hospital. |
En el Yongin Severance Hospital, se compararon las evaluaciones de mamografías de un programa automatizado de densidad y un programa AI-CAD en 488 pacientes. Este conjunto de datos tiene licencia y no está disponible públicamente. |
Programa de evaluación automatizada de densidad y AI-CAD con las evaluaciones realizadas por radiólogos. |
Los resultados de la evaluación de densidad subrayan la necesidad de algoritmos específicos para la población. Las evaluaciones de densidad del AI-CAD mostraron una concordancia aceptable con los radiólogos, comparable a los programas comerciales. |
| Lee S et al. en 2022-1 |
Evaluar las puntuaciones de anormalidad del cáncer de mama basadas en características clínicas, radiológicas y patológicas (17). |
El estudio evaluó retrospectivamente las puntuaciones de anormalidad del cáncer de mama y los casos de falsos negativos de AI-CAD. Se incluyeron 896 pacientes con 930 cánceres de mama. Se aplicó AI-CAD comercial a mamografías digitales. |
Mamografías de 896 pacientes con cáncer de mama. |
Puntuación de anormalidad del algoritmo AI-CAD y las características clínicas, radiológicas y patológicas del cáncer de mama. |
BI-RADS 0 y BI-RADS 3 no fueron reportados, debido a que el estudio se centró solo en mamografías previamente revisadas con cáncer. El análisis reveló una correlación entre los cánceres de mama caracterizados por puntuaciones de anormalidad elevadas en AI-CAD y una mayor categorización de BI-RADS, características patológicas invasivas y estadios avanzados del cáncer. |
| Kim H et al. en 2023 |
Evaluar el impacto de AI-CAD en los resultados del cribado del cáncer de mama con mamografía digital (27). |
Análisis retrospectivo de datos de mujeres coreanas asintomáticas que se sometieron a mamografía de cribado con y sin soporte de AI-CAD. |
Resultados histopatológicos de la cirugía y biopsia guiada por imagen, así como la estabilidad en las imágenes de seguimiento. Este conjunto de datos tiene licencia y no está disponible públicamente. |
Desempeño de los radiólogos con y sin el soporte de AI-CAD en la mamografía digital de cribado. |
AI-CAD mejora la especificidad de los radiólogos sin sacrificar la sensibilidad, funcionando como una herramienta de apoyo en la lectura única de DM para la detección del cáncer de mama, especialmente útil en la interpretación de DM para mujeres con senos densos o aquellas que se someten a cribados frecuentes. Se necesitan estudios adicionales con un mayor número de casos para confirmar la verdadera efectividad de AI-CAD en la tasa de detección de cáncer (CDR) y la sensibilidad, debido a la limitada ocurrencia de cánceres en los datos reales de cribado. |
| Yoon et al. en 2023 |
Evaluar los resultados de las anormalidades detectadas por AI-CAD y su rendimiento diagnóstico autónomo en una población de cribado (28). |
Diseño retrospectivo y transversal. El estudio incluyó 6,499 mamografías de campo completo en cuatro vistas de 5,228 mujeres que se habían sometido a biopsia para diagnóstico patológico o a una ronda de cribado. |
6,499 mamografías de campo completo en cuatro vistas de 5,228 mujeres que se habían sometido a biopsia o cribado adicional en la instalación. |
Desempeño de los radiólogos y un software de soporte diagnóstico basado en IA en la interpretación de imágenes mamográficas para la detección de cáncer de mama. |
AI-CAD identificó cánceres adicionales que inicialmente fueron pasados por alto por los radiólogos en una población consecutiva de cribado. A pesar de esto, el AI-CAD autónomo resultó en tasas de sensibilidad notablemente más altas en comparación con las interpretaciones de los radiólogos, con el 89% de las marcas de AI-CAD confirmadas como negativas. |
Tabla 8. Avances en la detección automatizada de anomalías mamarias
| Autor |
Objetivo |
Resultados reportados |
Conclusiones |
Observaciones |
| Loizidou K et al. en 2022 |
Revisar los avances recientes en la detección y clasificación automatizada de anomalías mamarias utilizando mamografías secuenciales, centrándose en el uso de información previa y orientando aplicaciones futuras. (29) |
El análisis temporal proporciona una clara ventaja en la detección y clasificación de masas mamarias y microcalcificaciones (MC). Sin embargo, esta técnica no ofrece beneficios cuando una anomalía recién desarrollada carece de datos previos de mamografías suficientes para comparación. |
La integración de datos previos de mamografías tiene un gran potencial para la detección de anomalías mamarias. No obstante, el alcance limitado de estudios a gran escala restringe la aplicabilidad clínica generalizada de estos hallazgos. |
La lenta adopción en entornos clínicos puede inicialmente confinar la sustracción temporal a un rol suplementario para un segundo lector. Los autores se centraron más en los aspectos tecnológicos de las herramientas y se encontró poca información sobre las aplicaciones clínicas. |
| Henriksen E et al. en 2019 |
Comparar el uso del CAD en mamografías de cribado para la detección temprana del cáncer de mama, enfocándose en la precisión diagnóstica y las tasas de sensibilidad. (1) |
La mayoría de los estudios que comparan SR con SR y CAD mostraron mayor sensibilidad y/o tasas de detección de cáncer cuando se usa CAD. Comparar DR con SR y CAD no reveló cambios significativos en la sensibilidad o las tasas de detección. Agregar CAD a SR aumentó la tasa de sensibilidad y redujo la especificidad, excepto en un estudio. |
Todos los estudios, excepto dos, mostraron que agregar CAD a SR aumentó la tasa de sensibilidad y la tasa de detección de cáncer (CDR). En comparación con DR, no se observaron diferencias estadísticamente significativas en la sensibilidad o en las tasas de detección de cáncer. |
La revisión siguió y proporcionó las directrices PRISMA respectivas, y analizó y comparó 13 estudios diferentes. Se necesitan más estudios para evaluar correctamente la eficacia del CAD en programas de cribado poblacional organizado, con un seguimiento más largo, lectores de alto volumen y mamografía digital. |
| Loizidou K et al. en 2023 |
Detectar y clasificar anomalías mamarias, incluidas masas y microcalcificaciones. (30) |
Los autores no proporcionan una evaluación global de lo que podrían significar los resultados reportados por cada estudio. |
Esta revisión cubre el papel de la mamografía en la detección de masas mamarias y MC, pero reconoce la necesidad de otras modalidades de imagen. Se necesita más investigación para validar los algoritmos CAD con suficientes datos clínicos. A pesar de las limitaciones, esta revisión ofrece información valiosa para estudios futuros. |
El artículo presenta un análisis detallado del estado actual del CAD en mamografías y su potencial aplicación clínica. Los autores se centraron en el aspecto técnico. |
Figura 1
Diagrama PRISMA de la etapa de revisión de la literatura del proyecto.
Conclusion
Se necesita una investigación más profunda, especialmente en programas organizados de cribado poblacional con tiempos de seguimiento más largos y mamografía digital, con el fin de evaluar completamente la eficacia del CAD. La validación de los algoritmos CAD con suficientes datos clínicos sigue siendo un área crítica para futuras investigaciones y mejoras.